LncRNA DILC在胆囊癌中的表达及意义
张绍平,徐 怡
(重庆医科大学附属第一医院綦江医院肝胆外科,重庆 401420)
胆囊癌是一种高侵袭性恶性肿瘤,尽管近年来胆囊癌的诊治取得了巨大进展,但是患者5年生存率仍不高[1],因此亟需寻找新的生物学标志物及潜在治疗靶点。长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200个核苷酸的非蛋白编码转录子,在染色质修饰、转录调节和转录后调节等多方面发挥作用。lncRNA参与了多种肿瘤的发生和发展,与癌细胞增殖、侵袭、迁移和凋亡等多种生物学行为有关。DILC是近年来发现的一种新型lncRNA,DILC在不同组织中发挥的作用不同,在肝癌、膀胱癌和结直肠癌中发挥抑癌基因作用[2-4],在胆囊癌中发挥癌基因作用[5]。LIANG等[5]发现DILC在胆囊癌组织中表达上调,可以促进癌细胞增殖和侵袭。DILC与胆囊癌患者预后的关系如何,既往鲜有报道。本研究旨在观察DILC在胆囊癌组织中的表达,并探讨其与临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料
选取80例胆囊癌组织标本(胆囊癌组)和30例慢性胆囊炎组织标本(对照组),均于2011年1月至2018年12月在重庆医科大学附属第一医院綦江医院接受诊治。胆囊癌患者80例,男28例,女52例;年龄28~72岁,平均(62.02±10.32)岁,术前均未接受过放疗、化疗或免疫治疗。术后以电话和门诊方式对胆囊癌患者进行随访,每3个月随访1次,随访时进行影像学检查。获得生存情况、复发或转移情况等内容。随访时间截止至2019年6月。对照组患者30例,男12例,女18例;年龄31~58岁,平均(49.35±6.37)岁。本研究经本院伦理委员会批准。
1.2 实时荧光定量PCR法检测
采用实时荧光定量PCR法检测组织中DILC的表达。PCR步骤严格按照试剂盒说明书进行操作。用TRIzol试剂(上海联迈生物工程有限公司)和AMV反转录试剂盒(美国Life Technologies公司)提取胆囊癌和慢性胆囊炎组织中总RNA,随后反转录为cDNA,使用2×SYBR Green PCR Mastermix试剂盒(美国Life Technologies公司)检测DILC相对表达量。本研究引物均由苏州泓迅生物科技股份有限公司设计并提供。DILC:上游5′-CGCACAGAGCAAAGCCATTT-3′;下游5′-GCAAGGGGCTAGAAGAAGGG-3′。内参β-actin:上游5′-GGCCCAGAATGCAGTTCGCCTT-3′;下游5′-AATGGCACCCTGCTCACGCA-3′。PCR反应条件为:95 ℃ 20 s、95 ℃ 10 s、60 ℃ 20 s,共40个循环。用2-ΔΔCq法计算DILC相对表达量。以DILC表达量的中位数为截断值,将胆囊癌患者分为高表达组和低表达组。
1.3 siRNA转染和侵袭、迁移实验
胆囊癌细胞GBC-SD和人胆囊上皮细胞HGBEC购于宁波明舟生物科技有限公司,将GBC-SD细胞分为转染组和阴性对照组。当细胞生长融合度达到50%时进行转染,转染组加入DILC siRNA(5′-GGGCTTCAATTTACAAGCATT-3′),阴性对照组加入无关序列(5′-UUCUCCGAACGUGUCACGUTT-3′)。siRNA序列由上海吉马制药公司合成。操作步骤严格按照Lipofectamine 2000试剂盒(美国Sigma公司)说明书进行。细胞均置于37 ℃、5%CO2、饱和湿度的细胞培养箱中进行培养。细胞融合度达80%时收集细胞,用实时荧光定量PCR法检测DILC的表达水平。用Transwell侵袭实验检测细胞侵袭能力,试剂盒购于上海研拓生物科技有限公司,细胞培养24 h后显微镜下计算穿膜次数,随机取10个视野,取平均值[6];用细胞划痕实验检测细胞迁移能力,细胞培养24 h后显微镜下取5个视野,测量划痕两侧细胞间距取平均值[6]。实验均重复3次,取平均值作为结果。
1.4 统计学方法

2 结果
2.1 胆囊癌组织和胆囊癌细胞中DILC的相对表达量
胆囊癌组DILC相对表达量明显高于对照组,差异有统计学意义(t=16.899,P<0.001)。GBC-SD细胞DILC相对表达量明显高于HGBEC细胞,差异有统计学意义(t=10.265,P<0.001)。见封三图1。
2.2 DILC表达与临床、病理特征的关系
高表达组T分期为T3—T4期、TNM分期为Ⅲ—Ⅳ期的占比明显高于低表达组,差异有统计学意义(P<0.05)。见表1。
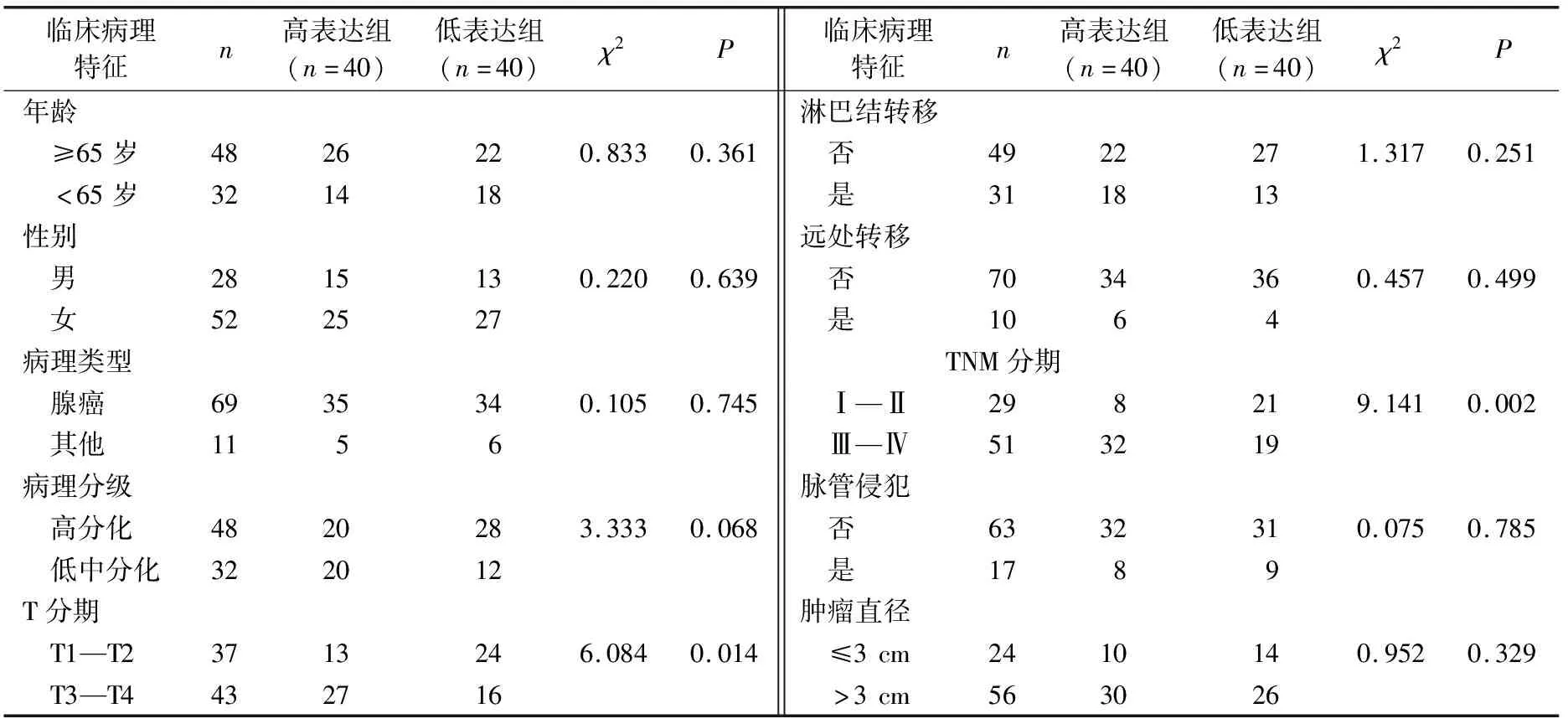
表1 DILC表达与临床特征的关系 例
2.3 胆囊癌患者的生存分析
80例患者随访5~102个月,中位随访时间为45个月。随访期间57例患者死亡,占71.25%,其中52例因肿瘤复发死亡,5例由于术后合并感染等非肿瘤因素死亡(作删失数据处理)。80例胆囊癌患者术后生存时间为6~98个月,平均(28.4±5.34)个月。1年、2年、3年、5年生存率分别为:52.50%、36.25%、32.50%、22.50%。见封三图2。
2.4 胆囊癌患者生存预后的COX多因素分析
多因素分析结果显示,T分期(T3—T4)、淋巴结转移、TNM分期(Ⅲ—Ⅳ)、DILC高表达是胆囊癌患者不良预后(生存时间)的独立危险因素(P<0.05)。见表2。
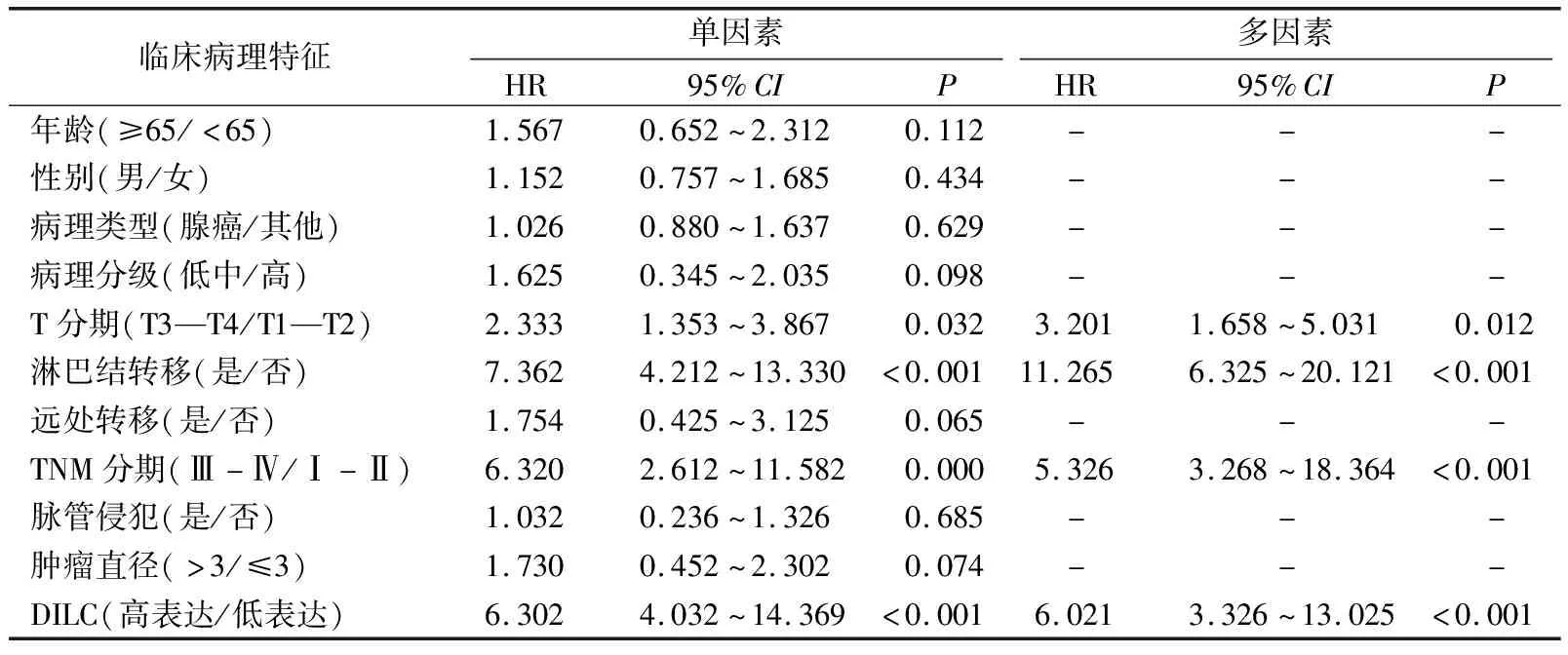
表2 胆囊癌患者生存预后的单因素和COX多因素分析
2.5 DILC对细胞侵袭和迁移的影响
转染组侵袭细胞数为(120.32±35.69)个·视野-1,明显低于阴性对照组的(286.33±89.75)个·视野-1(P<0.001),见封三图3。转染组细胞迁移距离为(6.32±0.55)pixel,明显低于阴性对照组的(16.02±0.96)pixel(P<0.001),见封三图4。
3 讨论
胆囊癌是胆道系统最常见的恶性肿瘤,发病隐匿,临床症状不典型,患者预后较差[7]。既往研究[8]显示,胆囊癌患者5年生存率约5%,平均生存期13.2~19个月。本研究80例患者5年生存率为22.5%,术后生存时间为6~98个月,平均(28.4±5.34)个月。生存时间的延长可能与胆囊癌诊治手段的提高有关,但其总体生存时间仍不能令人满意。
胆囊癌发病的生物学机制现在并未完全明确。LncRNA在胆囊癌中的作用越来越被重视,lncRNA与胆囊癌细胞增殖、侵袭、迁移、自噬和化疗敏感性等有关[9-11],可能会成为胆囊癌早期诊断和预后判断的生物学标志物,是潜在的治疗靶点[12]。本研究发现lncRNA DILC与胆囊癌患者的肿瘤分期和生存预后密切相关。
DILC在多种癌症中异常表达,DILC发挥的生物学作用具有组织特异性。MA等[3]发现,DILC可能通过抑制STAT3信号通路抑制膀胱癌细胞的侵袭。在肾透明细胞癌的研究中,ZHANG等[13]发现DILC可能通过PTEN/AKT信号通路抑制癌细胞增殖、迁移和侵袭。DILC也能通过IL-6/STAT3信号抑制结肠癌进展[2]。在胆囊癌中,DILC可能发挥癌基因作用。LIANG等[5]发现DILC在胆囊癌组织中表达上调,本研究结果与之一致,提示DILC在胆囊癌中发挥癌基因作用。另,本研究发现,高表达组T分期为T3—T4期、TNM分期为Ⅲ—Ⅳ期的占比明显高于低表达组(P<0.05),提示DILC与肿瘤浸润深度有关。影响胆囊癌预后的因素有很多,本研究发现肿瘤分期和淋巴结转移均与胆囊癌患者生存时间有关,这与既往报道[14-15]一致。DILC高表达同样是胆囊癌患者不良预后(生存时间)的独立危险因素,这可能与DILC促进胆囊癌细胞侵袭和迁移有关。本研究结果显示,转染组侵袭细胞数和细胞迁移距离均低于阴性对照组(P<0.001),这也提示DILC在胆囊癌中的生物学机制目前尚未明了,可能通过下调Wnt/β-catenin信号通路促进癌细胞侵袭[5]。
综上所述,DILC在胆囊癌组织中高水平表达,并且与肿瘤分期和生存预后有关。DILC可以促进胆囊癌细胞侵袭和迁移,其对胆囊癌作用的机制需要未来进行深入探讨。

