本体OAE对我国上市疫苗相关不良反应表征研究的可行性分析
谢江安,资文瑞,冉 攀,张 耀,周文梅,黄星荧,何勇群
(1.重庆邮电大学,生物信息学院,重庆 400065; 2.密西根大学 医学院,安娜堡,密西根州 48109,美国)
任何疫苗在上市使用前都需要经过严格的临床试验验证,保证其有效性的同时确保其安全性。经过临床试验得出的疫苗接种后出现的不良后果称之为疫苗副作用(Vaccine adverse effects)。疫苗副作用与疫苗接种之间的因果关系是建立在可控对照试验的基础上,因此这类因果关系是基本可靠的[1]。然而,由于临床试验的持续时间以及抽样样本相对有限,接种后某些潜在的不良后果无法及时监测到或者尚未表现出来,这类不良后果的群体危害性可能更大。鉴于此,各国医疗卫生部门及疫苗制造商均采取了相应的措施对上市疫苗接种后出现的不良后果予以监控、报道、收集。由于这些不良后果来源于随机的主观报道,我们无法确定其与疫苗接种之间的因果关系,因此不能简单的将其等同于疫苗副作用。实际报道和研究中我们将这类不良后果称之为疫苗不良反应。根据美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)的定义,疫苗不良反应(Adverse event, AE)是指人们接种疫苗产品后出现的任何不良医学症状[1]。
显然,探索“疫苗-疫苗接种者-不良反应”三者之间的逻辑关系,对于研究疫苗作用机理、改善疫苗安全性以及设计开发新疫苗均具有重要的理论指导意义和实际参考价值。然而,由于我国疫苗信息化起步较晚、医学术语体系建设相对落后等原因,目前我们关于上市疫苗不良反应的分析研究大多停留在流行病学统计调查阶段,主要研究过程是采用EXCEL或SPSS软件建立数据库对监管系统收集到的不良反应案例进行分布特征和相关指标的统计学分析[2-4]。在此过程中,由于没有引入一套完整的术语分类体系,导致原始数据的可用性大大降低,且后期无法支撑深层次的“疫苗-接种者-不良反应”之间的相关性研究。近年来,本体因其具备逻辑推理和知识发现、支持人机共识等优点而被广泛应用于生物医学大数据的整合、共享、检索、分析以及新知识的挖掘[5]。例如,基因本体GO (Gene Ontology)[6]已经成为基因组学、蛋白质组学和系统生物学等领域研究的基础性工具。He等人开发的不良反应本体OAE (Ontology of Adverse Events)[7]先后多次成功应用到美国上市疫苗相关不良反应的分析研究工作中,并得到了美国食品与药物管理委员会FDA (Food and Drug Administration)和欧洲生物信息研究所EBI (European Bioinformatics Institute)的持续关注。OAE正逐步成为药物(包括疫苗)不良反应研究领域的主流生物医学本体,因此,尽快将其引入到我国上市疫苗相关不良反应的分析研究中科学可靠、势在必行。
1 我国现行上市疫苗相关不良反应报告体系
由于我国医疗卫生系统整体信息化起步较晚,信息化的疫苗不良反应报告体系也是在2005年国务院颁布《疫苗流通和预防接种管理条例》后逐步开发并推广应用。目前,我国上市疫苗相关不良反应监控与数据收集采用AEFI (Adverse Events Following Immunization,预防接种异常反应)报告系统[8]。在AEFI体系中,医疗机构、接种单位和疾病预防控制机构执行人员作为责任报告人,将预防接种实施过程中或接种后发生的特定AEFI(如发热、过敏、晕厥等),以特定格式的AEFI登记表报告给所在地的县级疾病预防控制机构(CDC),经过县级CDC审核调查的AEFI及时向同级卫生行政部门报告并逐级上传到市、省级CDC,最终汇总到国家疾病预防控制中心免疫规划中心管理的疑似预防接种异常反应信息监测与评价系统。
在AEFI的调查报告及后续分析研究中,AEFI的分类诊断起到至关重要的作用。然而,当前我国AEFI体系依据可能的发生原因,仅将AEFI笼统地分为七大类,即一般反应(Common adverse event)、异常反应(Abnormal adverse event)、疫苗质量事故(Vaccine quality event)、实施差错事故(Program error)、偶合症(Coincidental event)、心因性反应(Psychogenic reaction)和不明原因反应(Unexplained reaction)。对于无法准确判断其为上述哪一种类别的AEFI,只能简单地将其列为“其他”不良反应,这直接导致了大量AEFI信息毫无逻辑关系的堆积在一起。事实上,疫苗接种后的不良反应类型多种多样,现有的AEFI分类体系远远不能达到对真实情况科学合理的表征与报告。例如,美国疫苗不良反应报告系统VAERS (Vaccine Adverse Event Reporting System)[9]采用MedDRA (Medical Dictionary for Regulatory Activities)[10]作为其不良反应症状的术语分类体系,而MedDRA中症状相关术语条目已经超过9 000多种。He等人开发的不良反应本体OAE[7]现有的表征术语也有近6 000种,并长期处于持续增加更新中。因此,我国现行上市疫苗不良反应报告体系中迫切需要引入类似完整的医学术语分类系统。
2 不良反应本体OAE
OAE (http://www.ontobee.org/ontology/OAE)[7]是由密西根大学医学院Dr. He研究团队(http://www.hegroup.org/)开发的基于社区驱动(Community-driven),针对医疗干预(Medical interventions)后发生的不良反应进行数据标准化和术语逻辑关系表征的生物医学本体(BioPortal: http://bioportal.bioontology.org/ontologies/OAE)。OAE严格按照开放生物医学本体(Open Biomedical Ontology, OBO)[11]规定的开源、协作、使用通用写作语法的构建原则,逻辑化地定义了医疗干预与不良反应之间的关系以及个体差异对不良反应后果的影响[7]。
如图1所示,在OAE中术语‘adverse event’被定义为患者经历某次医疗干预后发生的任何病理生理过程(Pathological bodily process: OGMS_0000060,BFO术语process: BFO_0000003的子类)。术语‘medical intervention’定义为一类计划实施的过程(planned process: OBI_0000011,也是process: BFO_0000003的一个子类),该过程致力于诊断、预防或缓解疾病或损伤。术语‘adverse event’和‘causal adverse event’被同时应用在OAE中描述医疗干预后发生的不良反应事件(见图1)。二者最主要的区别是‘causal adverse event’只用在不良反应和医疗干预明确了因果关系的情况下。OAE采用逻辑关系术语‘induced_by’来表征因果关系,因此,术语‘causal adverse event’等价于逻辑公理[‘adverse event’ and (‘induced_by’ some ‘medical intervention’)]。开发OAE的主要目的不是为了全面解决不良反应和医疗干预之间的因果关系问题,相反为了更好的理解因果关系,OAE仅仅指定出特定不良反应的中心属性特征。事实上,我们几乎不可能定义出特定不良反应是或不是与特定医疗干预有因果关系,医疗干预与不良反应之间的因果关系只能被定义为一种可能性或假设。为此,OAE中整合了一系列与方法学相关的术语词汇用于不良反应潜在的因果关系分析(如术语‘Naranjo ADR probability score’可以用来注释药物不良反应的可能性大小)[7]。
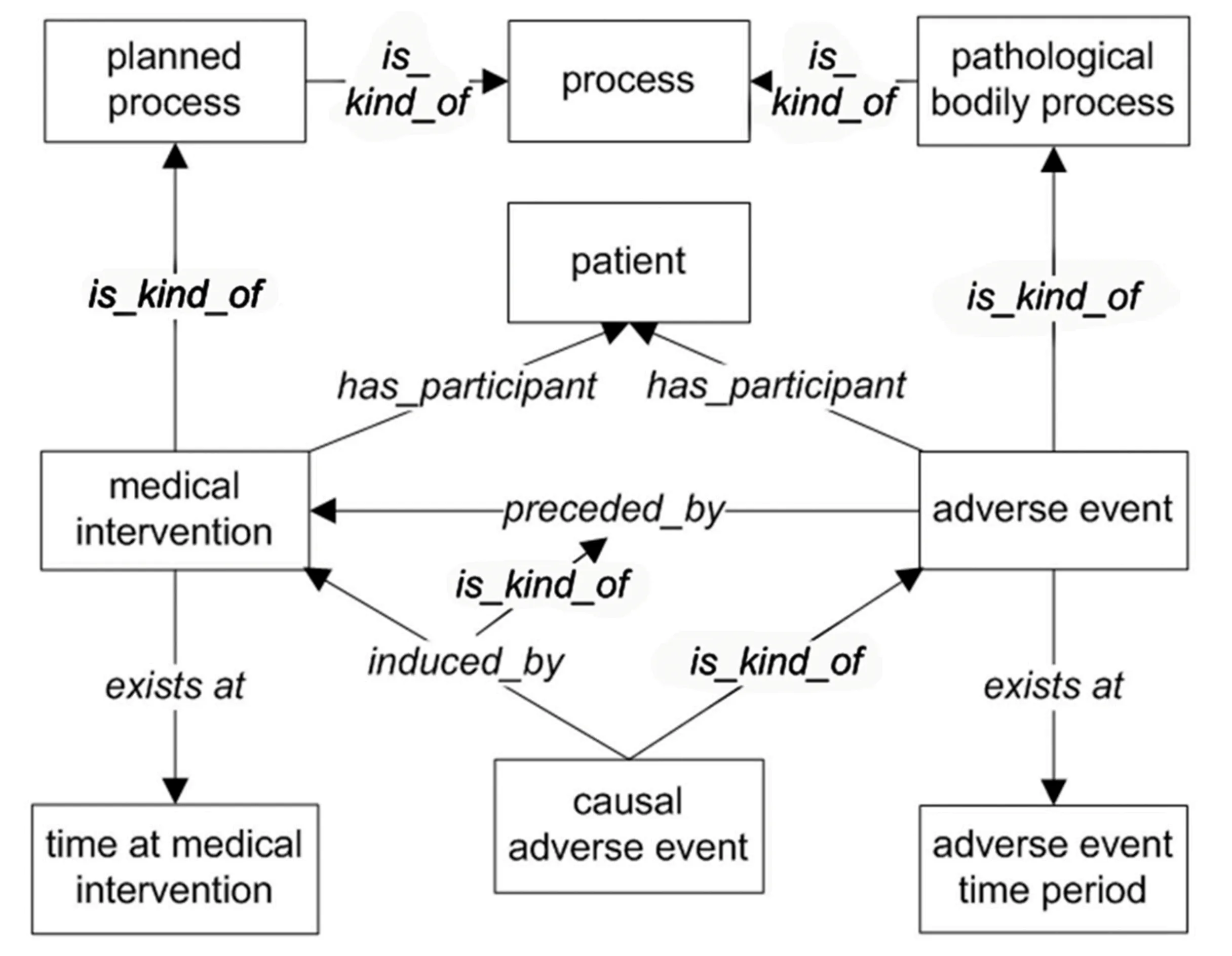
图1 OAE中术语‘adverse event’和‘causal adverse event’逻辑关系基本设计模式[7]Fig.1 Basic design pattern of terms ‘adverse event’ and ‘causal adverse event’ in OAE[7]
截止2019年8月30日,OAE中共计包含了5892个术语词汇(见表1),其中OAE专属术语包括4460个类(Class)、8个对象属性(Object property)、2个数据类型属性(Datatype property)和3个注释属性(Annotation property);其他1419个术语均来自对已有本体(如BFO、GO和OBI等)术语的共享和再利用。特别地,当前国际上疫苗不良反应数据采集与标准化大都采用MedDRA作为默认的术语词汇库(如VAERS等)。由于OAE和MedDRA的术语系统结构存在明显区别,实际应用中将MedDRA术语通过内置的关联ID匹配到OAE中的相关术语,特定MedDRA术语集就可利用OAE的等级结构进行分类分析。实际研究表明OAE在疫苗不良反应数据分析领域比MedDRA具备更好的应用前景[12-14]。
3 OAE在疫苗相关不良反应分析研究中的应用
OAE等级架构严密、术语定义明确、其间逻辑关系清晰,因此能够支持不同层级术语间的逻辑关系推理,这为实际研究中不良反应和疫苗接种之间的相关性或潜在因果关系分析提供了理论基础。OAE中的术语更新也是采用理论研究与实际需求相结合的模式驱动完成。针对特定疫苗的不良反应研究即是一次OAE术语体量的增加和更新过程,因此,OAE自开发之日起,总是在不断的实际研究及应用中得以逐步完善。
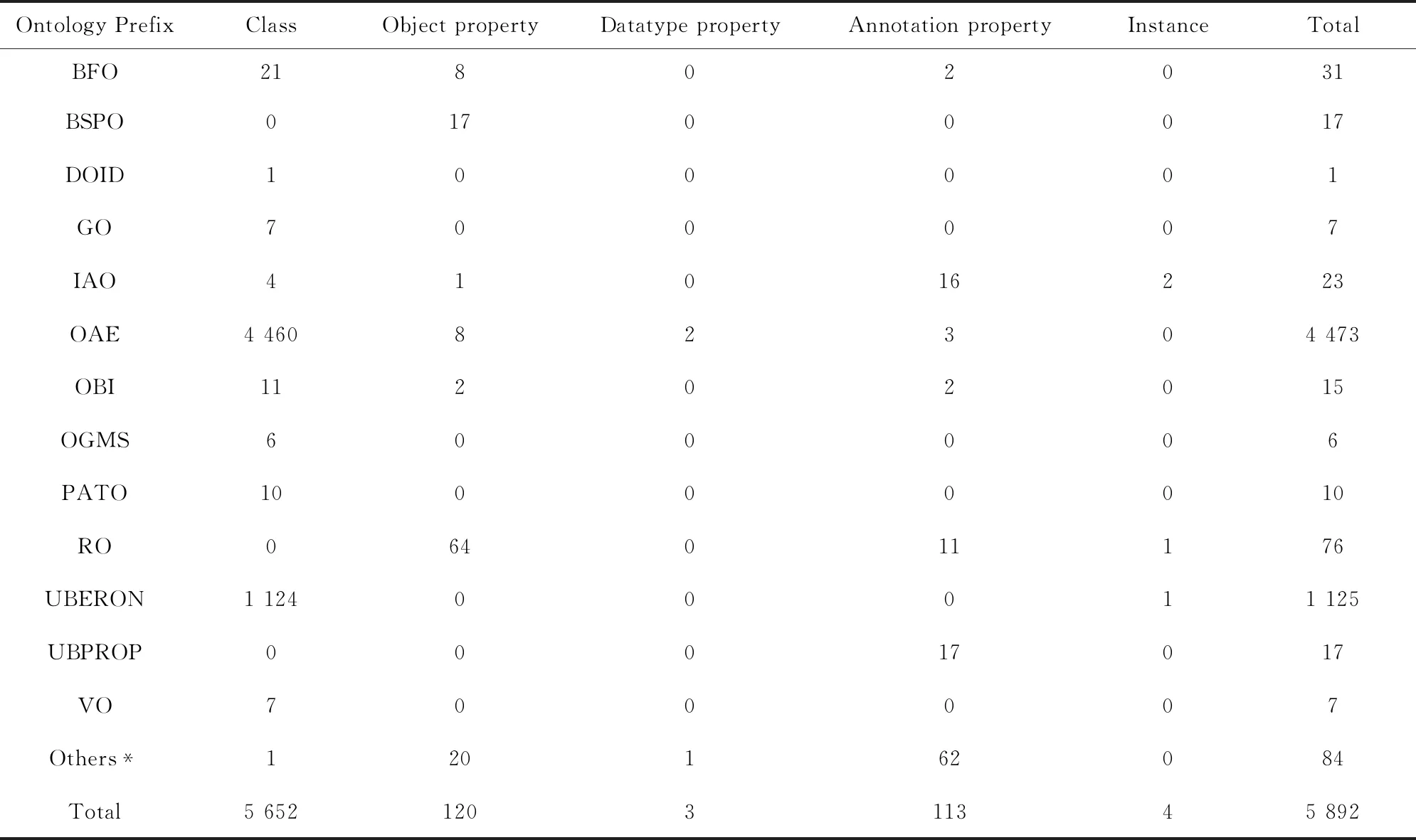
表1 OAE术语总览(截止2019年8月30日)Table 1 Summary of ontology terms in OAE (imported as of August 30, 2019)
Sarntivijai等人[14]采用CODAE (Combinatorial, Ontology-based Detection of AE method)系统地比较分析了两类季节性流感疫苗(TIV和LAIV)相关不良反应的发生情况,结果显示:48个TIV敏感AE主要涉及到接种者的神经和肌肉病变(如麻痹、运动障碍、肌无力等);68个LAIV敏感AE集中涉及到接种者的炎症反应和呼吸系统疾病。同时,基于OAE、MedDRA和SNOMED-CT术语分类系统分别进行的AE逻辑关系分类表明:OAE的分类结果相对最优。
Xie等人以OAE作为术语标准化和逻辑分类工具完成了三类美国上市疫苗的不良反应谱系研究。通过收集文献资料、纸质及电子病例和相应数据库中的数据,系统地比较分析了卡介苗作为结核病预防性疫苗和膀胱癌治疗性疫苗所引发的不良反应发生谱系[12]。基于OAE的分类研究结果表明:卡介苗作为结核病预防性疫苗相关的不良反应主要集中在免疫系统、皮肤和呼吸系统;相比之下,卡介苗作为膀胱癌治疗性疫苗相关的不良反应主要发生在泌尿系统。该研究是首次系统集中地统计并分析了卡介苗两种不同用途下的不良反应发生情况。针对美国上市的三种甲乙肝疫苗(甲肝单价苗Havrix,乙肝单价苗Engerix-B和甲乙肝联合疫苗Twinrix),从VAERS数据库中获取了相应的不良反应数据,基于OAE的分类研究得出:甲乙肝疫苗的不良反应发生谱系主要涉及到接种者的行为和神经学病变、免疫系统、视觉系统和肝胆系统[13]。其中29种不良反应可归集为严重不良反应,且黄疸是仅有的一个与甲肝疫苗、乙肝疫苗以及甲乙肝联合苗都相关的严重不良反应。基于PubMed文献库检索到的同行评议论文,荟萃分析识别出20种不良反应发生在动物的布鲁氏菌病疫苗接种过程中;46种不良反应发生在由于非主观原因而意外接种动物布鲁氏菌病疫苗的人群中[15]。OAE等级分类研究表明:这些动物相关的不良反应主要集中在动物的免疫和生殖系统,并最终导致流产或不孕不育的发生;而人相关的不良反应主要涉及到行为和神经学方面的病变,并表现出类似流感发生的症状,这与人类直接感染布鲁氏菌出现的临床症状是基本一致的。此项研究的结果有利于我们更好的理解布鲁氏菌病疫苗引发的人畜不良反应,同时有助于未来设计更安全有效的布鲁氏菌病疫苗。
Xie等人[12-13]在研究过程中,以实际案例比较分析了OAE和MedDRA的分类表征效果。术语分类过程中存在多重继承的现象,使得等级结构的确立及更新变得困难,例如‘liver inflammation AE’既可是‘inflammation AE’的子集,也可为‘liver AE’的子集(见图2a和2b)。OAE解决多重继承问题的方法是对于每一个术语只主张一个父辈术语,同时允许通过逻辑推理归集到其他合适的父辈术语下。此例中,‘liver inflammation AE’只主张为‘inflammation AE’的子集术语(见图2a),经过逻辑推理后(基于OAE内部已经声明的公理),‘liver inflammation AE’也归集为‘liver AE’的下属子集(见图2b)。MedDRA因其没有界定类似的逻辑关系和公理导致了其很多术语的等级结构混乱不清。MedDRA中存在很多以“NEC”(not elsewhere classified,未分类)作为后缀的术语(见图2c)。显然,此类术语定义方式是任意的、模棱两可的,会导致混淆不明的分类结果。例如,‘abnormal faeces’的MedDRA父辈术语是‘faecal abnormalities NEC’,这在术语分类体系中是毫无逻辑而无任何实际意义的分类结果。此外,MedDRA中很多术语的上下级关系存在明显的逻辑错误。例如,MedDRA将‘faeces pale’和‘abnormal faeces’归集为同一分类水平(见图2c),这是明显的逻辑错误,因为事实上‘faeces pale’是‘abnormal faeces’的子集术语(见图2a)。
Sarntivijai等人[16]通过MedDRA-OAE术语映射,将基于MedDRA的药物TKIs/mAbs相关不良反应导入OAE术语系统,进而匹配到已有的人类表型本体(Human Phenotype Ontology, HP)[17]、解剖学本体(Uber Anatomy Ontology, UBERON)[18]和基因本体(Gene Ontology, GO)[6],成功实现了该药物不良反应的临床表型与分子生物学机制的关联分析研究。近期,Haendel等人[19]在新英格兰医学期刊(The New England Journal of Medicine)上发表的综述论文全面阐述了包括OAE在内的众多生物医学本体通过对来自临床检验和生物医学研究得到的异构数据知识的系统表征与整合,可以实现对任何病人的精准分类分析。
4 OAE之于我国上市疫苗不良反应研究的意义
如前所述,我国现行不良反应报告体系的术语分类相对简单,虽然引入了部分ICD-10的术语词汇,但不成体系,不足以精准支持上市疫苗相关不良反应的后续分析研究工作。为此,我们急需一套完整的医学术语系统用于支撑我国疫苗产品的信息化建设。
在过去的十多年中,本体对生物医学大数据和精准医学的研究发挥了不可替代的方法学作用,其强大的数据整合分析能力吸引了国内科技工作者的持续关注。2018年国家人口与健康科学数据共享服务平台牵头组织成立了中国生物医学本体联合工作组(China Biomedical Ontology Consortium, OntoChina)。OntoChina(http://www.ontochina.org/)旨在通过引入国际上先进的本体知识构建理念,依托国内生物医学领域从业者的广泛协作,建设服务我国生物医学大数据研究的本体资源库,并促进生物医学本体在我国卫生信息化建设中的应用。OntoChina成员中国中医科学院朱彦博士等已经着手基本形式化本体(Basic Formal Ontology, BFO)[20]的中文翻译工作,这将为接下来特定生物医学领域的中文本体开发提供完整的顶层框架结构。
OAE已多次成功应用到医疗干预相关不良反应的分析研究中。事实上,OAE的开发者在其开发和应用过程中,根据实际情况,已经添加了部分术语的中文对照。不久的将来,随着BFO中文化的推进,我们完全可以实现OAE的整体汉化(包括全部术语条目和逻辑关系表述)。同时,得益于OAE完全开源免费的属性,结合本体开发工具(如Ontobee[21]、Ontofox[22]和Ontorat[23]等),可以实现OAE与其他中文生物医学本体的互联互通。因此,OAE的尽快采用不但可以完善我国上市疫苗安全监督体系,而且能够从根本上改变现有的疫苗接种与不良反应分析研究模式。
5 前景与展望
毫无疑问,人类已进入大数据时代。如何从海量原始数据中获得有科学研究或经济社会价值的内涵数据是广大科技工作者为之工作的重中之重。在此过程中,实现异构数据的标准化,关联数据的整合,数据的实时共享、快速检索、科学分析和新知识挖掘等是检验大数据分析成功与否的关键。而本体作为数据注释的基础性工具体系可以很好的完成上述任务,这也在实际应用中得到了充分的证明。当前国外生物医学本体学研究与应用发展迅速,已经形成了完整的开放生物医学本体(Open Biomedical Ontology, OBO)体系(OBO Foundry)[11]。相对而言,国内生物医学本体研究较为滞后。然而,随着国际学术交流合作日益增多,未来我国本体学研究将呈现蓬勃发展之势。
《“健康中国2030”规划纲要》明确指出了我国卫生信息化建设的目标:加强健康医疗大数据应用体系建设,推进基于区域人口健康信息平台的医疗健康大数据开放共享、深度挖掘和广泛应用。消除数据壁垒,建立跨部门跨领域密切配合、统一归口的健康医疗数据共享机制,实现公共卫生、计划生育、医疗服务、医疗保障、药品供应、综合管理等应用信息系统数据采集、集成共享和业务协同。尽管我国卫生信息化建设相对西方发达国家起步较晚、发展滞后,但是基于国家层面的政策推动和国际上先进建设理念(如本体术语体系)的引入,我们在卫生信息化建设过程中可以少走弯路,甚至实现弯道超车。
特别地,对于当前我国上市疫苗安全监督体系建设,除了需要引入像OAE这样标准的生物医学术语系统外,我们也期望能够在此基础上开发出类似于美国VAERS的、完全属于中国上市疫苗的不良反应报告系统,这将会极大的推动我国上市疫苗安全性的监管及后续分析研究工作。

