TLR4/MyD88/NF-κB在克罗恩病结肠组织的表达及临床意义
朱瑞齐 庄培丽 周璐 王丹丹 冯百岁

[关键词] 克罗恩病;TLR4;MyD88;NF-κB
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2021)29-0017-04
Expression and clinical significance of TLR4/MyD88/NF-κB in the colonic tissues of patients with Crohn′s disease
ZHU Ruiqi ZHUANG Peili ZHOU Lu WANG Dandan FENG Baisui
Department of Gastroenterology, the Second Affiliated Hospital of Zhengzhou University, Zhengzhou 450003, China
[Abstract] Objective To explore the expressions of toll-like receptor 4 (TLR4), myeloid differentiation factor 88 (MyD88) and nuclear factor kappa B (NF-κB) in the colonic tissues of patients with Crohn′s disease (CD) by immunohistochemistry, and to analyze whether there are differences between groups and whether there is any correlation between them and disease activity. Methods A total of 17 colonic tissue specimens from CD patients hospitalized in The Second Affiliated Hospital of Zhengzhou University and 5 colonic tissue specimens from the control group were collected. The expressions of TLR4, MyD88 and NF-κB were compared between the two groups,and their expressions in the groups with different severity of CD were also compared to see if there was any difference. Results The expression levels of TLR4, MyD88 and NF-κB in colonic tissues were higher in the CD group than those in the normal control group. The expression levels of TLR4 and MyD88 were significantly moderately correlated with erythrocyte sedimentation rate (ESR), and the expression level of NF-κB was significantly moderately correlated with C-reactive protein (CRP) and albumin levels. Conclusion The expressions of TLR4, MyD88, and NF-κB in colonic tissues of CD patients are higher than those in normal colonic tissues, and the TLR4/MyD88/NF-κB pathway plays an important role in the pathogenesis of CD. The expression levels of TLR4, MyD88 and NF-κB are significantly correlated with various inflammatory indicators.
[Key words] Crohn′s disease; Toll-like receptor 4; Myeloid differentiation factor 88; Nuclear factor kappa B
炎癥性肠病(Inflammatory bowel disease,IBD)是一种与人体免疫密切相关的慢性肠道疾病,包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),典型临床表现为持续或反复发作的腹痛、黏液脓血便和体重减轻等,可伴有皮肤、眼部、肝胆等肠外表现[1]。近20余年来,我国IBD患者就诊人数呈快速上升趋势[2]。IBD的病因及发病机制尚不明确,遗传、环境、免疫失调等多种因素均参与其发病[3]。越来越多的研究证实,炎症反应相关通路在CD发病中尤为重要。
有研究发现,在葡聚糖硫酸钠(Dextran sulfate sodium,DSS)诱导的小鼠结肠炎模型中发现小鼠结肠组织炎症部位TLR4、MyD88、NF-κB高表达,并且通过一种新型可溶性蛋白HM0539证明该物质可通过减少TLR4的激活并抑制MyD88的转导来调节下游NF-κB的激活对小鼠结肠炎显示出显著的保护作用[4-5]。TLR是先天性免疫识别受体的重要部分,在对病原微生物的识别中发挥着重要作用,TLR4通过非特异性地和病原相关分子结合启动信号转导,引发肠道炎症介质的释放,参与UC的发病[6]。MyD88是含有TLR结构域的接头蛋白,它作为TLR信号通路中的下游信号因子在TLR信号通路中起着关键作用[7]。TLR4可通过MyD88途径进行信号通路的转导。NF-κB是一种高度保守的转录因子,广泛存在于各种组织,在免疫和炎症反应中有着重要地位,NF-κB是多种信号转导途径的汇聚点,在肿瘤及炎症反应相关基因的表达中起着至关重要的作用[8-9]。越来越多的研究证实,TLR4/MyD88/NF-κB信号通路在UC的发病中有重要作用[10]。但该通路在CD发病中作用有待进一步研究,现报道如下。
1 资料与方法
1.1 一般资料
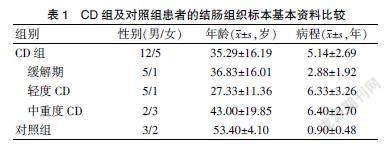
收集2019年12月至2020年12月郑州大学第二附属医院消化内科入院治疗的CD患者内镜活检标本或手术切除的结肠组织标本共17例,其中男12例,女5例。CD的诊断及评估标准均严格按照2018年炎症性肠病学组制定的共识执行。所选患者排除其他自身免疫性疾病、严重营养不良及急性感染性疾病。收集5例同时期住院行结直肠癌手术的患者切缘阴性的组织标本作为对照组,并由专业的病理医生确认。上述实验方案均经郑州大学第二附属医院医学伦理委员会批准同意后实施,所选患者均签署知情同意书。
1.2 方法
通过免疫组织化学法检测结肠组织TLR4、MyD88、NF-κB的表达情况,所用主要试剂为北京Bioss公司生产的兔源Toll样受体4抗体和兔源MyD88抗体及Affinit公司生产的兔源NF-κB p65抗体;通过入院病历收集患者的性别、年龄、病程等资料,记录患者入院时的症状(腹痛、大便次数等)、体征、既往史等,收集入院后首次血常规、肝功、ESR、CRP、肠镜报告等。采用Best CDAI评分对CD患者的病情评估并分组,共包含稀便次数、腹痛程度、一般情况、肠外表现与并发症、阿片类止泻药、腹部包块、血细胞比容降低值、100×(1-体重/标准体重)共8项指标,计算各指标得分后乘以相关权重得出总分,<150分为缓解期,≥150分为活动期,其中150~220分为轻度,221~450分为中度,>450分为重度。
1.3 免疫组织化学染色结果分析
免疫组化的结果在400倍高倍镜下观察,随机选取3个不同视野计算均值。①计数标准:阳性细胞百分比:0~5%计0分;6%~25%计1分;26%~50%计2分;51%~75%计3分;>75%计4分。②染色强度:无着色为0分;浅黄色为1分;棕黄色为2分;黄褐色为3分;然后计算上述两项得分的乘积,所得值即为阳性等级评分:0分计为阴性,1~4分计为弱阳性,5~8分计为阳性,9~12分则计为强阳性,染色结果由2位病理科医生在双盲情况下观察所得。
1.4 统计学方法
采用SPSS 22.0统计学软件分析并处理数据,计量资料采用(x±s)表示,计数资料采用χ2检验,各组数据经方差齐性或正态检验后,两组或多组比较采用单因素方差分析的S-N-K多重比较或秩和检验,相關性分析采用Spearman相关性分析,检验标准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
收集17例CD患者结肠组织标本,根据Best CDAI评分对患者的病情程度进行评估,其中缓解期6例,轻度6例,中重度5例,同时收集5例结直肠癌手术患者的切缘组织的病理蜡块;组间性别和年龄比较,差异无统计学意义(P>0.05)。见表1。
2.2 免疫组化法检测CD患者结肠组织TLR4、MyD88和NF-κB的表达
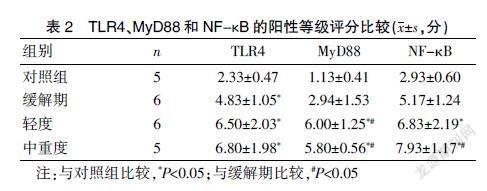
2.2.1 TLR4 为广泛表达的受体,在多种炎性细胞及结肠组织的黏膜上皮细胞等均可表达,对照组和CD组相比阳性细胞占比更少且染色程度更轻,CD组间均可见大量呈淡黄色或棕黄色的阳性区域。患者结肠组织TLR4表达的阳性等级评分平均水平,中重度CD组为(6.80±1.98)分、轻度CD组(6.50±2.03)分、缓解期CD组为(4.83±1.05)分,较对照组的(2.33±0.47)分表达水平均升高,差异均有统计学意义;CD组组间比较,差异无统计学意义(P>0.05)。见图1、封三图1。
2.2.2 MyD88 定位于细胞质,表达情况如下,对照组和缓解期CD组与活动期CD组相比阳性细胞占比更少且染色程度更轻,活动期CD组可见中等至大量呈淡黄色或棕黄色的区域。结肠组织MyD88表达的阳性等级评分的平均水平如下,中重度CD组为(5.80±0.56)分、轻度CD组为(6.00±1.25)分,较缓解期CD组(2.94±1.53)分和对照组(1.13±0.41)分表达升高,差异均有统计学意义,轻度CD组和中重度组间相比以及缓解期组和对照组比较,差异无统计学意义(P>0.05)。见表2、封三图2。
2.2.3 NF-κB 为广泛表达的受体,是诸多信号通路核心枢纽之一,静息状态下多存在于细胞浆,活化后则存在于细胞核。其表达情况,CD各组和对照组相比阳性细胞占比更多且染色程度更重,CD组间均可见大量呈棕黄色或者黄褐色阳性区域。患者结肠组织NF-κB表达的阳性等级评分平均水平,中重度CD组为(7.93±1.17)分、轻度CD组为(6.83±2.19)分、缓解期CD组为(5.17±1.24)分,较对照组的(2.93±0.60)分水平高,差异有统计学意义(P<0.05);缓解期组相比轻度CD组,差异无统计学意义(P>0.05);相比中重度组,差异有统计学意义(P<0.05)。见表2、封三图3。
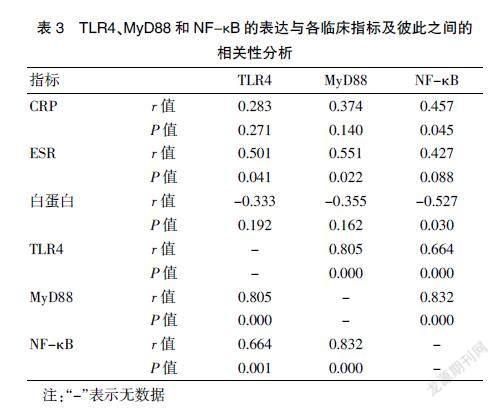
2.3 TLR4、MyD88和NF-κB的表达与各临床指标及彼此之间的相关性分析
相关性分析结果显示,NF-κB与CRP间存在显著的中等强度正相关,与白蛋白存在显著的中等强度负相关,与其余指标无明显相关;TLR4和MyD88与ESR间存在显著的中等强度正相关,与其余指标无明显相关,即TLR4、MyD88、NF-κB与炎症指标关系密切。TLR4、MyD88和NF-κB在CD组表达升高且彼此间存在不同程度的正相关,TLR4和MyD88间存在显著强相关,MyD88与NF-κB间存在显著强相关,可以推测上述指标与CD发病及疾病活动关系密切。见表3。
3 讨论
IBD 是一组病因不明、发病机制不清的肠道慢性炎症性疾病,包括 UC和CD两种类型。CD病变可累及整个消化道,主要症状为腹痛和腹泻,可伴体重减轻、发热、疲劳、贫血等全身表现,可并发瘘管、腹腔脓肿、肠腔狭窄、肠梗阻和肛周脓肿等并发症,严重影响患者的生活质量[2]。近年来我国IBD发病及就诊人数不断上升,给社会及患者家庭带来巨大的负担[11]。随着越来越多的生物制剂不断问世及投入使用,很大程度地改善患者的生活质量,但不是所有患者均对生物制剂应答良好,且目前仍缺乏能根治或长期有效维持缓解的手段,现有研究表明免疫功能紊乱在IBD发病中占重要地位,所以对于IBD发病机制的研究非常重要。
本研究中,通过免疫组化的方法检测CD结肠组织中TLR4、MyD88和NF-κB的表达发现TLR4、MyD88和NF-κB在CD患者的結肠黏膜中表达均高于对照组,活动期的CD结肠组织中MyD88的表达高于缓解期,下游分子NF-κB在中重度患者的表达也高于缓解期的患者。同时,相关性分析结果显示,NF-κB与CRP间存在显著的中等强度正相关,与白蛋白存在显著的中等强度负相关。TLR4和MyD88与ESR间存在显著的中等强度正相关,上述结果提示TLR4、MyD88、NF-κB与CD的发病关系密切且与疾病活动度相关。相关分析还显示,TLR4和MyD88间存在显著强相关,而MyD88与NF-κB也存在显著强相关,所以本研究推测该通路联系紧密,彼此间以正向调节的形式参与CD发病,且信号间的传递受其他因素干扰较小。
有研究证实,通过应用NF-κB抑制剂PDTC等证明通过抑制NF-κB信号转导,可以减轻肠道的炎症反应[12]。不仅如此,益生菌、短链脂肪酸、寡糖等有利于减轻肠道炎症反应的物质均有抑制NF-κB表达的作用[13-15]。但NF-κB作为多条信号通路的共同下游信号因子,除本文中提到的TLR4/MyD88/NF-κB通路外,MLCK/NF-κB[16]和TLR4/MAPK/NF-κB[13]等信号通路也参与了IBD的发病,具体哪条通路更重要,其机制复杂仍需进一步研究。不仅如此,通过CD147刺激肠上皮细胞中NF-κB的磷酸化,会加重肠道炎症反应[17]。种种迹象均表明NF-κB在IBD的发病中非常重要。此外,TLR4非特异性地和病原相关分子结合启动信号转导,通过抑制其表达也可以发挥减轻肠道炎症反应的作用[18]。但作为上游信号因子,TLR4不仅可通过经典的MyD88诱导NF-κB的表达增加,还可以通过非经典的MyD88途径及MAPK等途径来诱导NF-κB的表达增加[19]。所以,本研究可通过TNBS诱导的小鼠结肠炎模型验证上述结果,同时通过特异性的抑制MyD88的表达来观察NF-κB的表达情况及对肠道炎症反应的抑制作用。
综上所述,CD结肠组织中TLR4、MyD88和NF-κB的表达在本实验中相比于对照组表达增加,且TLR4、MyD88和NF-κB与疾病活动度相关的临床炎症指标间存在相关性。但本研究为单中心小样本研究,免疫组化的结果也存在一定的主观差异,所以仍需更多的实验验证上述结果,需要相关的动物或细胞实验验证上述通路的具体机制。
[参考文献]
[1] Kaser A,Zeissig S,Blumbegr RS. Inflammatory bowel disease[J]. Annu Rev Immunol,2010,28:573-621.
[2] 吴开春,梁洁,冉志华,等.炎症性肠病诊断与治疗的共识意见(2018年·北京)[J]. 中国实用内科杂志,2018,38(9):796-813.
[3] Kobayashi T,Siegmund B,Le Berre C,et al. Ulcerative colitis[J]. Nat Rev Dis Primers,2020,6(1):74.
[4] Chen YY,Li RY,Shi MJ,et al. Demethyleneberberine alleviates inflammatory bowel disease in mice through regulating NF-kappaB signaling and T-helper cell homeostasis[J]. Inflamm Res,2017,66(2):187-196.
[5] Li Y,Yang S,Lun J,et al.Inhibitory effects of the lactobacillus rhamnosus GG effector protein HM0539 on inflammatory response through the TLR4/MyD88/NF-small ka,cyrillicB axis[J]. Front Immunol,2020,11:551 449.
[6] Shi YJ,Gong HF,Zhao QQ,et al. Critical role of toll-like receptor 4 (TLR4) in dextran sulfate sodium (DSS)-induced intestinal injury and repair[J]. Toxicol Lett,2019, 315:23-30.
[7] Nagpal K,Plantinga TS,Wong J,et al. A TIR domain variant of MyD88 adapter-like(Mal)/TIRAP results in loss of MyD88 binding and reduced TLR2/TLR4 signaling[J]. J Biol Chem,2009,284(38):25 742-25 748.
[8] Huang YF,Li QP,Dou YX,et al. Therapeutic effect of brucea javanica oil emulsion on experimental Crohn′s disease in rats:Involvement of TLR4/ NF-kappaB signaling pathway[J]. Biomed Pharmacother,2019,114:108 766.
[9] Gambhir S,Vyas D,Hollis M,et al. Nuclear factor kappa B role in inflammation associated gastrointestinal malignancies[J].World J Gastroenterol,2015,21(11):3174-3183.
[10] Brenna O,Furnes MW,Drozdov I,et al. Relevance of TNBS-colitis in rats:A methodological study with endoscopic,histologic and transcriptomic[corrected] characterization and correlation to IBD[J]. PLoS One,2013,8(1): e54 543.
[11] Park J,Cheon JH. Incidence and prevalence of inflammatory bowel disease across asia[J].Yonsei Med J,2021, 62(2): 99-108.
[12] Jia Q,Zhang H,Su Y,et al. Strictosamide alleviates the inflammation in an acute ulcerative colitis (UC) model[J]. J Physiol Biochem,2021,77(2):283-294.
[13] Lu K,Zhou J,Deng J,et al.Periplaneta americana oligosaccharides exert anti-inflammatory activity through immunoregulation and modulation of gut microbiota in acute colitis mice model[J]. Molecules,2021,26(3):1718.
[14] Kikut J,Konecka N,Zietek M,et al. Diet supporting therapy for inflammatory bowel diseases[J]. Eur J Nutr,2021, 148(6):1087-1096.
[15] Guo C,Wang Y,Zhang S,et al. Crataegus pinnatifida polysaccharide alleviates colitis via modulation of gut microbiota and SCFAs metabolism[J]. Int J Biol Macromol,2021,181:357-368.
[16] Al-Sadi R,Engers J,Haque M,et al. Matrix metalloproteinase-9 (MMP-9) induced disruption of intestinal epithelial tight junction barrier is mediated by NF-kappaB activation[J].PLoS One,2021,16(4):e249 544.
[17] Xu Z,Liu R,Huang L,et al. CD147 Aggravated Inflammatory Bowel Disease by Triggering NF-kappaB-Mediated Pyroptosis[J]. Biomed Res Int,2020,2020:5 341 247.
[18] Dejban P,Nikravangolsefid N,Chamanara M,et al. The role of medicinal products in the treatment of inflammatory bowel diseases (IBD) through inhibition of TLR4/NF-kappaB pathway[J]. Phytother Res,2021,35(2):835-845.
[19] Su Q,Li L,Sun Y,et al. Effects of the TLR4/Myd88/NF-kappaB signaling pathway on NLRP3 inflammasome in coronary microembolization-induced myocardial injury[J]. Cell Physiol Biochem,2018,47(4):1497-1508.
(收稿日期:2021-05-08)

