正交试验优化桑叶中蛋白提取工艺
刘苗苗,史 锐,吴 鹏,丛龙娇
(辽宁中医药大学 药学院,辽宁 沈阳 110000)
桑叶为桑科植物桑(MorusalbaL.)的干燥叶,味甘、苦,性寒,归肝、肺经。《中国药典》记载桑叶药材具有疏散风热、清肺润燥、清肝明目的功效,主要用于治疗风热感冒、肺热燥咳、头晕头痛、目赤昏花等[1],中医称之为“铁扇子”,是常用的中药材。桑叶中化学成分复杂,主要含有N-糖化合物、芸香苷、槲皮素、挥发油、蛋白质、维生素及微量元素等多种活性成分,具有降血糖、降血脂、降血压、抗菌和抗病毒等药理活性[2-4]。桑叶中蛋白含量较高,其干物质中含有粗蛋白约29.83%[5]。随着植物蛋白的药用价值的逐步被植物蛋白发现,人们将更多的目光放在植物蛋白的深入研究上。因此对其的提取工艺进行优化具有重要的学术意义和应用价值。
1 材料与仪器
1.1 材料与试剂
药材:桑叶于2019年7月采自于辽宁本溪的一棵野生桑树,经辽宁中医药大学康廷国教授鉴定为桑科植物桑(MorusalbaL.)的叶,采摘后的桑叶洗净晒干后粉碎备用。
试剂:考马斯 G-250(上海源叶生物科技有限公司);牛血清白蛋白(上海源叶生物科技有限公司)。
1.2 仪器与设备
电热恒温鼓风干燥箱;FW100高速万能粉碎机;UV5100紫外可见-分光光度计;KQ5200DB型数控超声波清洗器。
2 方法
2.1 桑叶蛋白质含量测定方法
2.1.1 标准品蛋白溶液制备 取牛血清白蛋白50 mg,精密称定,置于100 mL容量瓶中,加水定容至刻度线,摇匀,即得浓度为0.502 mg·mL-1的蛋白质标准溶液。
2.1.2 线性关系考察 按文献[6]方法配制考马斯亮蓝G-250溶液。分别精密吸取标准品溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL于10 mL棕色容量瓶中,分别加水定容至2 mL,摇匀;再分别加入考马斯亮蓝G-250溶液10 mL,振荡,放置10 min。取空白溶液组进行基准校正后,于595 nm下测定吸光度(A)。以标准品质量浓度(mg/mL)为X轴,吸光度(A)为纵坐标Y轴绘制标准曲线,并求出线性回归方程。
2.2 桑叶蛋白提取工艺的优化研究
2.2.1 桑叶蛋白提取方法 先将桑叶洗净除去杂质,用55 ℃烘箱烘干,干燥后用粉碎机粉碎,粉末过3号筛,按照一定料液比加入一定质量分数的NaCl提取溶剂,超声波处理后用水浴锅浸提,离心后取上清液,得到桑叶蛋白质溶液。
2.2.2 单因素考察 (1)NaCl质量分数对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数分别为0.1%、0.2%、0.4%、0.6%、0.8%、1.0%的NaCl溶液为提取溶剂,按照1∶20的料液比在超声功率为100 W,超声温度为40 ℃的条件下超声处理20 min,40 ℃水浴浸提60 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
(2)料液比对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数为0.4%的NaCl溶液为提取溶剂,分别按照1∶10、1∶20、1∶30、1∶40、1∶50、1∶60的料液比加入提取溶剂,在超声功率为100 W、超声温度为40 ℃的条件下超声处理20 min,40 ℃水浴浸提60 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
(3)超声温度对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数为0.4%的NaCl溶液为提取溶剂,料液比为1∶30,在超声功率固定为100 W,超声温度分别为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃的条件下超声处理20 min,40 ℃水浴浸提60 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
(4)超声时间对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数为0.4%的NaCl溶液为提取溶剂,料液比为1∶30,在超声功率为100 W,超声温度为40 ℃的条件下分别超声处理10 min、20 min、30 min、40 min、50 min、60 min,40 ℃水浴浸提60 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
(5)浸提温度对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数为0.4%的NaCl溶液为提取溶剂,料液比为1∶30,在超声功率为100 W,超声温度为40 ℃的条件下超声处理20 min,分别在25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃的温度下水浴浸提60 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
(6)浸提时间对桑叶蛋白提取率的影响:精密称取0.5 g桑叶粉,以质量分数为0.4%的NaCl溶液为提取溶剂,料液比为1∶30,在超声功率为100 W,超声温度为40 ℃的条件下超声处理20 min,在40 ℃水浴中分别浸提30 min、40 min、50 min、60 min、70 min、80 min,离心后取上清液,采用考马斯亮蓝方法测出A值,计算桑叶蛋白的提取率。
2.2.3 正交试验 根据单因素试验的考察结果,NaCl质量分数(A)、料液比(B)、超声时间(C)、浸提时间(D)4个因素对蛋白提取率具有显著性影响。为了进一步研究4个因素对提取率的影响,优选桑叶蛋白提取工艺,每个因素选取3个水平,采用L9(34)安排试验,具体因素水平见表1。

表1 桑叶蛋白L9(34)因素水平提取工艺
2.3 桑叶样品蛋白质含量的计算
按“2.2.1”项下方法制备供试品溶液,得到不同提取方法所制备的桑叶蛋白溶液,从中取0.5 mL溶液,其余按照“2.1.2”项下条件操作,取空白溶液组进行基准校正后,于595 nm下测定吸光度。
2.4 桑叶蛋白提取率计算
根据每次实验测得的吸光度A求出蛋白质浓度C(mg/mL),桑叶蛋白提取率=(C×V/m)×100%,其中V为桑叶蛋白溶液的体积,m为提取所用桑叶样品质量(g)。
3 结果与分析
3.1 标准曲线的绘制
标准曲线如图1所示,以蛋白质浓度(mg/mL)为X轴,吸光度(A)为Y轴绘制标准曲线,得到y=2.161 4x+0.060 8(R2=0.993 6)。结果表明牛血清白蛋白在0.050 2~0.502 0 mg/mL浓度范围内与吸光度值线性关系良好。

图1 牛血清白蛋白曲线
3.2 桑叶蛋白提取单因素试验结果分析
3.2.1 不同提取溶剂浓度对桑叶蛋白提取的影响 研究发现,大部分蛋白质都可以溶于水、稀盐、稀酸或碱溶液,而通过对植物叶蛋白提取进行考察发现,NaCl溶液是提取植物叶蛋白最常用的浸提剂,其盐溶作用可以促进蛋白的水解,同时稀盐溶液中的盐离子与蛋白质结合可以保护蛋白质不变性[7]。图2显示,NaCl的质量分数为0.4%时,吸光度A值达到最高,为0.637。当NaCl溶液浓度进一步增加时,吸光度反而下降,原因可能是随着盐浓度的增加,核酸提取的量也增大,给桑叶蛋白的提取纯化带来困难[8]。故0.4% NaCl溶液为最适合提取桑叶蛋白的溶剂。

图2 提取溶剂浓度对桑叶蛋白提取的影响
3.2.2 不同料液比对桑叶蛋白提取的影响 料液比是提取工艺中常考虑的因素之一,在提取中不同料液比会影响溶液的黏度和浓度。料液比较小时,溶液黏度大,蛋白质分子不易扩散,提取率小;而料液比偏大时,由于浓度差变小,蛋白质的提取反而更加困难,因此通过实验确定桑叶蛋白质提取的最适料液比十分重要。实验结果如图3,当料液比为1∶30时,吸光度值最高,达到0.743,因此选择料液比为1∶30作为桑叶蛋白提取的最适条件。

图3 料液比对桑叶蛋白提取的影响
3.2.3 不同超声温度对桑叶蛋白提取的影响 在关于蛋白质的提取研究中,温度一直是需要考虑的重要因素,本实验对提取时超声的温度进行考察,结果如图4。吸光度随着温度升高而增加,在40 ℃时达到最高值,为0.642,最后趋近于平稳,相较于其他因素,超声温度对桑叶蛋白提取率无显著影响,故设定超声温度40 ℃为提取桑叶蛋白的最适条件。
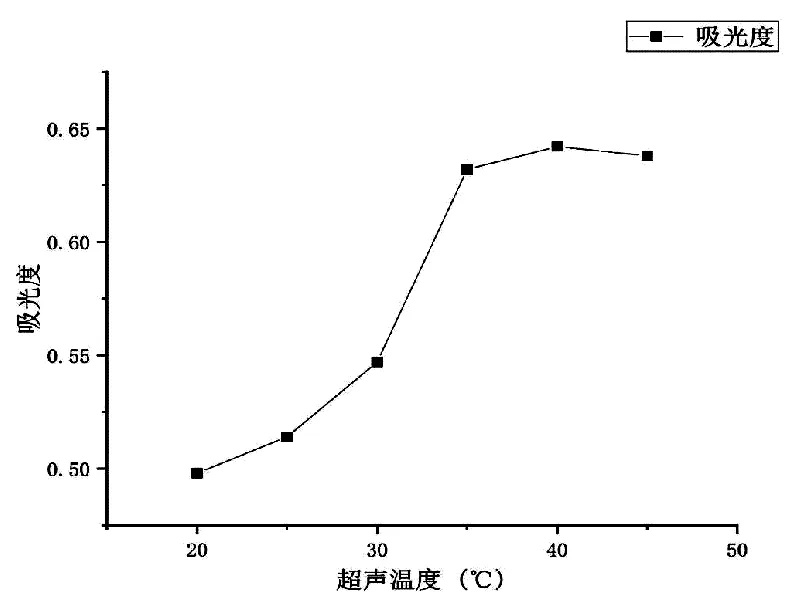
图4 不同超声温度对桑叶蛋白提取的影响
3.2.4 不同超声时间对桑叶蛋白提取的影响 本次实验中,超声的功率设定为100 W不变,对超声时间进行考察。由图5可知,在超声30 min后吸光度值达到最高,为0.856,随后逐渐下降,因此选择超声30 min作为提取桑叶蛋白的最适条件。
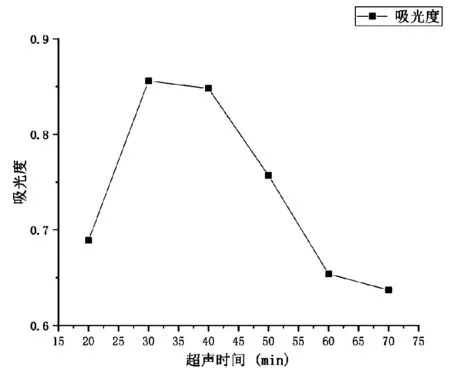
图5 不同超声时间对桑叶蛋白提取的影响
3.2.5 不同浸提温度对桑叶蛋白提取的影响 除了超声温度外,本实验还对浸提温度进行了考察。由图6可知,当浸提温度为40 ℃时,吸光度值达到最高,为0.689。升高5 ℃后反而有下降现象,因此将浸提温度设定为40 ℃,是桑叶蛋白提取的最适温度。

图6 不同浸提温度对桑叶蛋白提取的影响
3.2.6 不同浸提时间对桑叶蛋白提取的影响 本实验对不同浸提时间进行考察,结果如图7。由图7可知,随着浸提时间延长,吸光度值有逐渐升高的现象,在60 min时到达最高值,A值为0.723,随后呈逐渐下降趋势,可能是由于浸提时间过长,导致溶液中的蛋白质出现凝聚现象,因此选择浸提时间为60 min作为桑叶蛋白的最适提取条件。
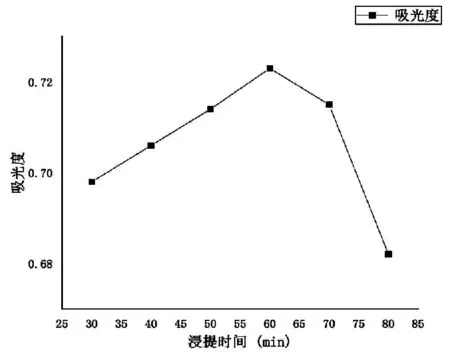
图7 不同浸提时间对桑叶蛋白提取的影响
3.3 正交试验结果分析
按照上述设计的因素水平进行提取测定,结果见表2。表中K值显示,提取最优的组合为A1B3C1D1,即桑叶蛋白提取的最优工艺为NaCl质量分数0.3%,料液比1∶35(g/mL),超声时间25 min,浸提时间55 min。
3.4 验证性实验
运用上述最优提取方法进行验证性实验,平行测定3次,结果见表3。桑叶蛋白平均提取率为6.05%,RSD为1.29%,与正交表内结果相比,确定此工艺为最优提取工艺,且重复性好,稳定性强,含量高。
4 讨论
本实验确定的桑叶蛋白的最佳提取工艺为NaCl质量分数0.3%,料液比1∶35(g/mL),超声时间25 min,浸提时间55 min。在此提取工艺下验证3次,得到桑叶蛋白提取率分别为5.94%、6.01%、6.03%,平均提取率为6.01%,RSD为1.29%。相较于以往的研究,正交试验法优化得到的工艺可有效提高桑叶中蛋白质的提取率,为后续该资源的合理应用奠定了基础。

表2 正交试验设计及结果 (n=3)

表3 验证实验结果

