银离子络合法提取纯化大西洋鲑鱼中二十二碳六烯酸(DHA)用于特定位点碳同位素分析(PSIA-C)
马 艺, 朱震宇,2*, 马 然,2, 王 颖, 赵 雨, 周友平,2
(1.陕西科技大学 化学与化工学院 天然产物稳定同位素组学实验室, 陕西 西安 710021; 2.陕西科技大学 陕西省轻化工助剂重点实验室, 陕西 西安 710021)
0 引言
生物源二十二碳六烯酸(DHA,all cis-4,7,10,13,16,19-docosahexaenoic acid),俗称“脑黄金”,是一种ω-3系列多不饱和长链脂肪酸(long chain polyunsaturated fatty acid,LC-PUFA)[1],简记为22:6(ω-3)(图1).DHA作为人体重要的生命活性物质,能有效促进人体(特别是新生儿脑部和神经系统)生长发育,具有防治糖尿病、心脑血管疾病和抗癌、抗炎、降血脂等重要的生理功能和保健作用[2-7].DHA被认为是一种必须从食物中获得的人体必需脂肪酸(EFA,essential fatty acids)[8],这是基于人体内缺乏Δ6 Fad (图2)和Δ15(ω-3)去饱和酶,不能将C18饱和脂肪酸转化为亚油酸(LOA,linoleic acid,18:2(ω-6)、α-亚麻酸(ALA,α-linolenic acid,18:3(ω-3)等合成DHA的前体脂肪酸.
然而,目前并不清楚,在人体从食物中获得足够LOA和ALA的前提下,通过体内链延长和去饱和是否能够合成有意义量的DHA[9].换言之,目前并不清楚人体正常发育所需要的DHA,有多少直接来自饮食,有多少来自于体内LOA和ALA的转化.
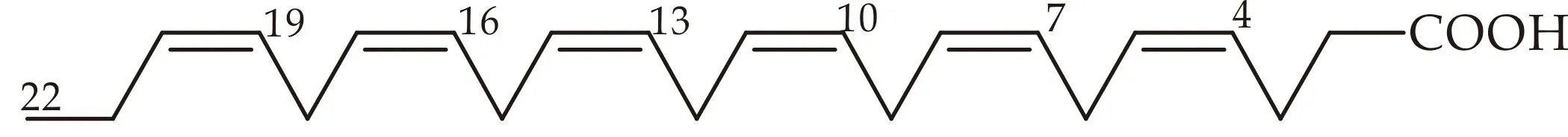
图1 DHA结构式(全顺式-4,7,10,13,16,19-二十二碳六烯酸)
18
[10]
[11]
如果人体内DHA完全来自食物,其碳同位素组成(通常用δ13C表示δ13Csample=13Rsample/13Rstandard-1,13Rsample和13Rstandard分别是样品和标准的13C/12C)由来源生物如藻类或者鱼类等决定.如果部分是由食物中C18PUFA先体基础上通过链延长和去饱和转化形成,那么额外添加的4个C同位素组成应该和C18PUFA先体的同位素组成不同(图2).因此迫切需要能够从亚分子(或者原子)水平上测定DHA分子内不同位置碳的同位素组成,比较人体内和其食物中DHA的碳同位素组成,实现定量确定这两种途径的贡献.

Fad:脂肪酸去饱和酶;Evol:脂肪酸链延长酶;LOA:linoleic acid (18:2n-6);ALA:α-linolenic acid (18:3n-3);SDA:stearidonic acid (18:4n-3);EPA:eicosapentaenoic acid (20:5n-3);DPA:docosapentaenoic acid (22:5n-3);TPA:tetracosapentaenoic acid (24:5n-3);THA:tetracosahexaenoic acid (24:6n-3);DHA:docosahexaenoic acid (22:6n-3).Δ4途径[11]:粗实线箭头;Sprecher途径[10]:虚线箭头.为了以示区分,来自C18先体和链延长合成DHA过程中添加的碳用不同颜色标注
为达到上述目的,必须从人体和其食物中提取和纯化DHA以及与其合成代谢相关的PUFA,这是因为无论是化学降解后利用IRMS(isotope ratio mass spectrometry)或者核磁共振波谱仪(NMR)进行分子内同位素组成分析(position-specific isotope analysis,PSIA),都必须有足够量的纯样品.
目前,已报道的脂肪酸分离纯化方法有:银离子络合法(silver ion complexation)、溶剂低温结晶法(low temperature solvent crystallization)、尿素包合法(urea clathration)、超临界流体萃取(supercritical fluid extraction)、分子蒸馏法(molecular distillation)、酶分析法(enzymatic assay)等,其中银离子络合法具有高效、经济、少污染,所需设备简单等优点[13].银离子络合法是基于银离子与C=C键之间的相互作用,C=C键中的不饱和电子与Ag+形成一个σ配位键,同时,Ag+反过来给出一对d电子到C=C键上形成π键,即Ag的s轨道与C=C键的π成键轨道结合,形成一个σ配位键.银的d轨道与碳-碳双键的π反键轨道结合,形成一个π键[14].该方法已被成功用于分离含不同数量双键的混合物如多苯环芳烃(polynuclear aromatic hydrocarbons,PAHs)和PUFA[13].
考虑到大西洋鲑鱼(Atlantic salmon)是人体DHA的重要来源之一,本文详细报道大西洋鲑鱼混合脂肪酸提取、甲酯化及银离子络合法纯化获得DHA的技术优化细节,为后续利用核磁共振(nuclear magnetic resonance,NMR)测定DHA分子内特定位点碳同位素组成做准备.
1 实验部分
1.1 仪器和试剂
1.1.1 化学试剂
硝酸银、三氯甲烷,均为分析纯,国药集团化学试剂有限公司;氯化钠、无水硫酸钠均为分析纯,天津大茂化学试剂厂;乙醇、甲醇、正己烷、二氯甲烷、乙酸乙酯,均为色谱纯,Adamas-beta;200-300目柱层析用硅胶,青岛海洋化工有限公司;14% 三氟化硼-甲醇,Sigma-Aldrich;二十二碳六烯酸,上海TCI化成工业发展有限公司;二十二碳六烯酸甲酯,Sigma-Aldrich.
1.1.2 仪器设备
冷冻干燥机,Alpha 2-4 LD plus,CHRIST;超声仪,昆山市超声仪器有限公司;真空干燥箱,上海一恒科学仪器有限公司;层析柱,欣维尔玻璃仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;循环冷却器,郑州长城科工贸有限公司;磁力搅拌器,巩义市予华仪器有限责任公司;全自动研磨仪,上海净信实业发展有限公司;超纯水制造系统,西安优普仪器设备有限公司;气相色谱,Agilent technologies 7890B;Trace 1300/ISQ气质联用仪,ThermoFisher Scientific.
1.2 实验方法
1.2.1 样品制备
将大西洋鲑鱼肉(原产地智利,购买于京东生鲜)冷冻干燥24 h至恒重,使用全自动研磨仪将样品磨成粉状.
研磨基本参数:研磨预设频率,60 Hz;研磨运行时间,30 s.
1.2.2 混合脂肪酸提取方法
参考Folch法[15],并作了相应改进提取脂肪酸.称取300 mg的大西洋鲑鱼粉末于50 mL具塞离心管中,加入15 mL氯仿-甲醇(2∶1,v/v) 溶液(含0.01% 2,6-二叔丁基-4-甲基苯酚),室温超声30 min后过滤,滤液中加入饱和氯化钠溶液,进行萃取,收集下层有机相(脂质溶液),加入无水硫酸钠干燥30 min后,旋蒸除去溶剂,得到混合脂肪酸.
1.2.3 混合脂肪酸甲酯化方法
称取100 mg混合脂肪酸于10 mL圆底烧瓶中,加入14% BF3-CH3OH溶液2 mL,反应液在75 ℃条件下回流搅拌30 min,待烧瓶冷却至室温后加入10 mL去离子水,转移至分液漏斗中,用正己烷萃取三次,合并有机相,加入无水硫酸钠干燥,过滤、旋蒸浓缩得到油状混合脂肪酸甲酯.
1.2.4 10%硝酸银-硅胶的制备
称取36 g硅胶(200~300目),4 g硝酸银于250 mL铝箔纸包裹的圆底烧瓶中,加入去离子水36 mL和95%的乙醇54 mL,常温下搅拌3 h后,在88 ℃的条件下旋蒸除去溶剂(1.5 h).随后将银化硅胶在120 ℃的真空干燥箱内活化16 h,备用.
1.2.5 DHA甲酯的分离
使用1.2.4制备的硝酸银硅胶对混合脂肪酸甲酯中的DHA甲酯进行分离.采用干法装柱,将混合脂肪酸甲酯样品用正己烷稀释后上样,按参考文献[16]调整洗脱剂比例,按洗脱剂极性由小到大依次洗脱.首先,采用相对较弱极性洗脱剂(low polarity eluent)将饱和脂肪酸(fa0)及单不饱和脂肪酸(fa1)洗脱掉;然后采用相对中等极性洗脱剂(medium polarity eluent)将含有2~4个双键的脂肪酸(fa2-fa4)洗脱下来;接下来采用较强极性的洗脱剂(high polarity eluent)将含有五个双键的脂肪酸(fa5)及少量六个双键的脂肪酸(fa6,即DHA)洗脱下来;最后采用乙酸乙酯(EtOAc)将银化硅胶中DHA洗出并收集洗脱液.对流出液均使用GC/MS检测定性.为了获得大量DHA进行NMR测定单个位点碳同位素值,实验通过增加分离的样品量,同比例增加硝酸银硅胶柱的用量,在少量样品实验的基础上,反复实验,对洗脱剂极性进行调整,保证DHA甲酯得到有效的分离.洗脱流程如图3所示.

AgNO3表示银化硅胶;fa0 (saturated FAMEs);fa1 (monounsaturated FAMEs);fa2 (diunsaturated FAMEs);fa3 (triunsaturated FAMEs);fa4 (tetraunsaturated FAMEs);fa5 (pentaunsaturated FAMEs);fa6 (DHA)
2 结果与讨论
2.1 混合脂肪酸甲酯GC/MS分析
2.1.1 脂肪酸甲酯的GC/MS分析条件
采用Trace 1300/ISQ气质联用仪(ThermoFisher Scientific)对混合脂肪酸甲酯进行分析.
(1)气相色谱条件
DB-HeavyWAX(30 m × 0.250 mm × 0.25μm)毛细管柱;柱温:130 ℃;进样口温度:270 ℃;程序升温:初始温度130 ℃保持2 min,以10 ℃每分钟的速率升温至270 ℃保持2 min;进样量:1μL;载气:He;载气流量:1.5 mL/min;不分流进样;溶剂延迟:5 min.
(2)质谱条件
EI离子源;离子源温度:250 ℃;传输线温度:250 ℃;电子能量:70 eV;发射电流:50μA;电子倍增电压:1818.8 V;质量范围:50~650 amu.
2.1.2 脂肪酸甲酯总离子色谱图
混合脂肪酸甲酯GC/MS色谱见图4所示.分析谱图可以获得大西洋鲑鱼体内所含的脂肪酸种类及其相对含量,具体见表1所示.

图4 混合脂肪酸甲酯(FAME)部分总离子流色谱图(total ion chromatogram,TIC)
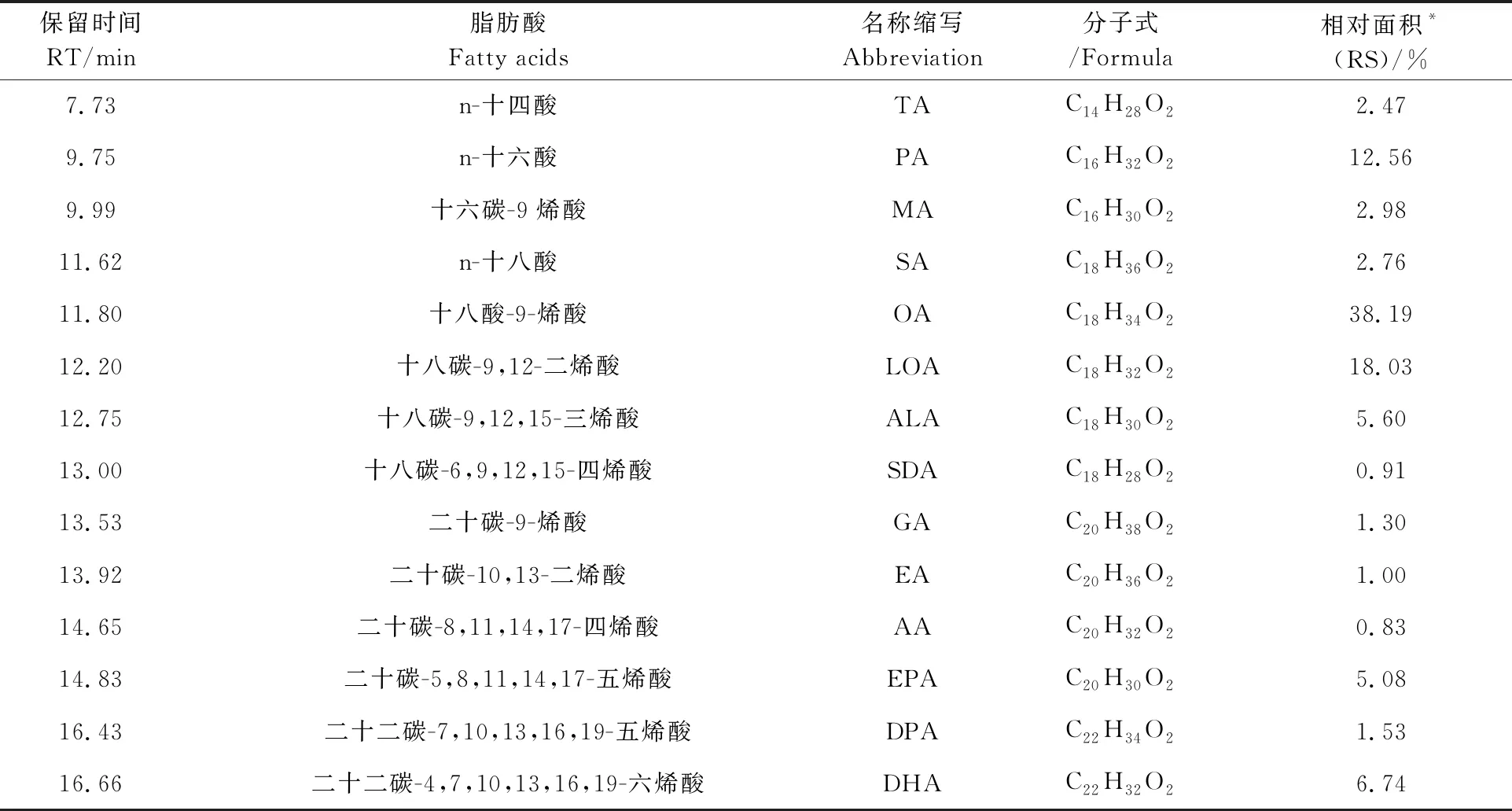
表1 大西洋鲑鱼中脂肪酸的GC/MS结果
2.2 DHA定量分析
采用气相色谱(Agilent technologies 7890B)对混合脂肪酸中的DHA进行定量.
2.2.1 色谱条件
DB-HeavyWAX(30 m × 0.250 mm × 0.25μm)毛细管柱;柱温:130 ℃;进样口温度:270 ℃;程序升温:初始温度130 ℃保持2 min,以10 ℃每分钟的速率升温至270 ℃保持2 min;进样量:1μL;载气:N2;载气流量:1.5 mL/min;不分流进样.
2.2.2 标准曲线的绘制
配制DHA甲酯标准品20 mg/mL,分别移取50,100,150,200,250微升标准储备液,定容至1 mL,然后进行气相色谱分析.以标准液浓度(Concentration)为横坐标,对应的色谱峰面积(Area)为纵坐标绘制标准曲线,得到DHA甲酯的标准曲线为Area=70.60*Concentration - 5.28,R2=0.996,p<0.05,n=5.当浓度在1~5 mg/mL时,DHA甲酯的浓度与气相色谱峰面积有稳定良好的线性关系,如图5所示.
(1)样品的测定
酯化过程中DHA的转化率为96%,按照1.2.3步骤处理后的样品溶液,进样GC分析后,将测得的峰面积代入回归方程,计算出样品中DHA的含量为1.3 mg/g.
(2)精密度实验
取实际样品,进行GC测定,同一份样品连续进样8次,进行精密度实验,DHA甲酯的相对标准偏差为3.12%.
(3)回收率实验
在空白基质中加入一定量的脂肪酸标准品,按1.2.2和1.2.3做完整个流程,空白加标回收率为82.43%.

图5 DHA甲酯标准回归线
2.3 不同因素对分离效果的影响
2.3.1 硝酸银浓度对DHA分离效果的影响
使用1.2.4同样的方法分别制备硝酸银浓度为5%,10%,15%,20%的银化硅胶.
装柱:采用干法装柱,称取1.5 g银化硅胶装柱,用银化硅胶三倍体积的正己烷将柱子压实,0.05 g脂肪酸甲酯用1 mL正己烷稀释后,用移液枪沿内壁缓慢滴加.
洗脱:银化硅胶柱层析分别用正己烷∶乙酸乙酯=4∶1;二氯甲烷:乙酸乙酯=3∶1;二氯甲烷:乙酸乙酯=1∶1为洗脱液.每5 mL收集一次,进行GC/MS检测.
薄层色谱法确定硅胶柱层析洗脱剂比例为正己烷∶乙酸乙酯=50∶1.
硝酸银浓度和洗脱液体积及DHA纯度关系见图6、图7所示.
从图6可以看出,随着硝酸银浓度的增加,银离子对DHA的吸附能力越强,在层析柱上的保留时间越长,需要使用更多的洗脱剂将DHA洗脱下来.从图7的曲线可以看出,未使用硝酸银活化的普通硅胶不能有效的分离DHA而对比不同硝酸银浓度时得出结果,当硝酸银浓度为10%时,可以有效地对DHA进行分离,并且成本相对较低.

图6 不同浓度AgNO3洗脱时液体体积

图7 不同浓度AgNO3洗脱时DHA纯度
2.3.2 洗脱剂比例对DHA分离效果的影响
(1)少量样品分离结果分析
称取活化的银化硅胶1 g,混合脂肪酸甲酯30 mg.用硅胶三倍体积的二氯甲烷将柱子压实后上样.硝酸银见光易分解,柱外需要用铝箔纸包裹.分别用正己烷(HEX)∶二氯甲烷(DCM)=4∶1;二氯甲烷(DCM)∶乙酸乙酯(EtOAc)=49∶1;正己烷(HEX)∶乙酸乙酯(EtOAc)=4∶1.按极性从小到大依次洗脱,将每个组分洗脱液进行收集,N2吹干后溶解在二氯甲烷中,利用GC/MS分析其中的脂肪酸甲酯成分,分析结果见表2所示.

表2 小量混合脂肪酸甲酯洗脱物(百分)组成与洗脱液组成关系
实验结果显示不同比例洗脱剂可以分离不同饱和度的脂肪酸.本实验的目的是提取大量(>200 mg)高纯度(>95%)的DHA,进行NMR单个位点C同位素值测试.因此,需要成比例的增加样品及银化硅胶的质量.
(2)大量样品分离结果分析
称取活化的银化硅胶40 g,混合脂肪酸甲酯1.3 g用硅胶三倍体积的二氯甲烷将柱子压实后上样.柱外用铝箔纸包裹.分别用正己烷∶乙酸乙酯=4∶1;二氯甲烷∶乙酸乙酯=3∶1;二氯甲烷∶乙酸乙酯=2∶1;二氯甲烷∶乙酸乙酯=1∶1四个不同梯度.按极性从小到大依次洗脱,将每个组分洗脱液进行收集,用GC/MS分析其中的脂肪酸甲酯成分,分析结果见表3所示.
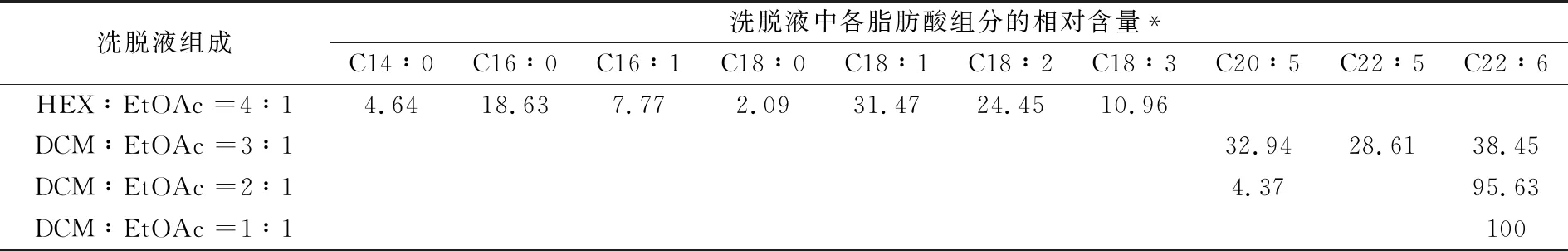
表3 大量混合脂肪酸甲酯洗脱物(百分)组成与洗脱液组成关系
实验结果表明,如果只是根据少量样品分离结果进行比例放大,并不能达到有效分离获得大量高纯度DHA.因此,根据上样量来调整洗脱液成分组成及洗脱液比例、洗脱速度、洗脱压力、洗脱时间等,找到适合的条件进行分离.
根据银离子络合原理,双键越多与银离子络合时键合力越强.鱼肉样品中,本实验提取的目标物DHA(二十二碳六烯酸)在混合脂肪酸中双键数目最多,相对极性最强.在使用银化硅胶柱层析方法分离时,基于强极性分子间更强的分子间作用力,使用更大极性的溶剂进行洗脱进而达到提取纯化DHA的目的.实验的洗脱结果(表2、表3)很显然符合这种理论预测.
3 结论
为了获得足够量、高纯度的DHA用于基于NMR的分子内C同位素分析,本实验优化了目前广泛使用的银离子络合柱色谱方法.通过Folch法提取的大西洋鲑鱼中混合脂肪酸被甲酯化后,在硝酸银-硅胶柱上通过调整洗脱液组成、洗脱速度、洗脱压力、洗脱时间等,获得高纯度DHA.具体认识如下:
(1)当硝酸银浓度为10%时,DHA分离效果最佳.
(2)选择二氯甲烷∶乙酸乙酯=3∶1作为洗脱剂时,混合脂肪酸甲酯中的饱和脂肪酸和双键数目为1~5的不饱和脂肪酸可有效去除.接下来,使用纯乙酸乙酯对柱子进行洗脱,通过GC/MS检测,合并DHA纯度在95%以上的流出液.
(3)根据GC/MS对混合脂肪甲酯的分析结果表明,不饱和脂肪酸占全部有脂肪酸含量为81.94%.本实验所重点关注的DHA在所有脂肪酸中相对百分含量为6.74%.根据酯化实验过程中得到DHA 的转化率为96%,及标准回归线计算得出,本研究采用的大西洋鲑鱼中DHA含量为1.3 mg/g.

