土地利用方式对高寒地区湿地土壤细菌群落结构和多样性的影响
许楠 刑军会 隋心 丁俊男 史传奇 于少鹏






摘要:土地利用方式的改变会导致土壤生态系统功能发生改变,土壤微生物能够敏感地反映土壤质量及不同生态系统功能的演变。为研究土地利用变化对湿地微生物群落结构的影响,以三江平原3种典型的土地利用方式农田、湿地、林地为研究对象,采集其中的原始湿地、开垦后改种大豆田、林地3种土壤,采用基于细菌16S rRNA基因的高通量测序技术,研究上述土壤细菌的群落结构,并研究其与土壤环境因子间的关系。结果表明,不同土地利用方式土壤中的优势菌门均为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria),但土地利用方式明显改变了土壤细菌属的组成和丰度。结合Chao指数和ACE指数,发现农田细菌生物丰富度显著高于林地土壤及湿地土壤,3种土壤中辛普森(Simpson)、香农(Shannon)指数几乎相同,说明细菌群落多样性没有明显差异。相关性分析表明,土壤pH值及有机碳含量是影响微生物群落组成的重要驱动因子。说明土壤利用方式改变后改变了土壤pH值、含水率及土壤养分含量,从而对细菌群落结构产生影响。
关键词:高寒地区湿地;土壤利用方式;高通量测序;细菌群落结构;土壤理化性质;多样性
中图分类号: S181;S154.3文献标志码: A
文章编号:1002-1302(2021)24-0233-08
收稿日期:2021-04-15
基金项目:黑龙江省寒区湿地生态与环境研究重点实验室年开放课题(编号:201910、202006);黑龙江省院所基本应用技术研究专项(编号:ZNBZ2019ZR05);哈尔滨学院青年博士科研启动基金(编号:2020106);哈尔滨学院科研启动基金(编号:HUSC202108)。
作者简介:许 楠(1982—),男,吉林榆树人,博士,讲师,主要从事湿地生态学研究。E-mail:xunan0451@126.com。
通信作者:于少鹏,博士,教授,主要从事湿地生态学研究。E-mail:wetlands@126.com。
不同土地利用方式可以引起陆地生态以及生物地球化学循环过程的变化,导致土壤性质和土地生产力的改变[1]。由人类活动主导的土地(包括农田、林地和湿地等)利用方式的变化,可以从根本上改变土壤质量和养分循环(如C、N、P),从而影响土壤微生物群落的构建[2-3]。 微生物群落参与特定的土壤生化反应,在土壤养分和生态系统过程的调节中发挥着重要作用,对土壤质量和植物生物量具有非常大的影响[4]。Jangid等研究发现,湿地转变为农田后引起细菌丰度和种类的显著变化,并确定土地利用变化是微生物群落组成的主要决定因素[5]。 Krashevska等比较短期土地利用变化对微生物群落的影响,发现自然雨林转变为人工种植橡胶园时,细菌丰度显著下降[6]。Mendes等发现,林地土壤中嗜酸菌和衣原体含量较高,林地砍伐地区放线菌含量较高,农田中硝化菌、嗜热球菌和嗜热菌的含量较高[7]。Wood等发现,热带林地转变为油棕种植后,细菌多样性增加,而再生林和原始林地之间细菌多样性和群落组成只有细微的差异[8]。所以对土地利用类型、土壤特性以及土壤细菌群落结构和多样性之间相互作用的更全面了解,将改善陆地生态系统的预测和管理。
黑龙江省作为中国最大的商品粮生产基地,土壤肥沃,具有悠久的农耕历史,其土壤理化性质及其肥力对农业的可持续发展至关重要[9]。黑龙江省三江平原作为主要粮食生产基地之一,粮食生产安全问题直接影响整个黑龙江省乃至全国的粮食安全。自20世纪50年代以来,随着人口的增加,为解决温饱问题,该地区就采取开荒方式获得农田。由于只种地不养地,作物产量不稳定,达不到经济平衡就弃耕、撂荒,再辟新荒。原始湿地被开垦成农田,天然植被消失,农田撂荒时,地面呈裸露状态,对土壤破坏严重,短期内很难恢复原有植物群落[10]。21世纪初,政府意识到生态环境问题的严重性,将部分湿地和撂荒地种植林地,來保护当地脆弱的生态环境,促进经济持续稳定发展[9-10]。
目前,土地利用方式转变对三江平原地区土壤微生物的影响研究较少,本研究在三江平原地区选择原始湿地、农田、林地3种不同利用方式的土壤进行试验,分析长期不同的土地利用方式是否改变了土壤理化性质以及土壤细菌群落结构和多样性,为研究区土壤肥力的维持、培育以及土壤微生物多样性的保护提供科学依据,也为该地区生态重建以及土地资源合理利用提供科学依据。
1 材料与方法
1.1 研究样地概况
研究样地设在黑龙江省三江平原(133°37′~133°45′E、47°43′~47°52′N),平均海拔51.5~5.14 m,属中温带大陆性季风气候,春季干旱多风,夏季炎热多雨,冬季寒冷少雪,平均气温2.3 ℃,平均降水量454 mm,封冻期在11月上旬,解冻期在5月上旬。在该地区选择的3种土地利用方式分别是:(1)原始湿地,面积约为500 hm2,植被主要为小叶章(Deyeuxia angustifolia)、垂梗繁缕(Stellaria radians)、二歧银莲花(Anemone dichotoma)、山黧豆(Lathyrus quinquenervius)、箭头唐松草(Thalictrum simplex);(2)农田,20年前在草原上垦殖而成的农田,面积约为200 hm2,种植作物主要为大豆,每年进行机器翻耕1次,春季施加史丹利玉米复合肥(N+P2O5+K2O≥40%)525 kg/hm2,6月中旬追肥225 kg/hm2。(3)林地,面积约为500 hm2,为20年前在湿地上栽植的落叶松人工纯林,作为研究样地。
1.2 样品的采集
2019年6月在原始湿地、农田、林地3种不同土地利用方式的样地中分别选取3块50 m×50 m大小的标准地,采用5点混合取样法取0~20 cm 深度的土壤样品。各层土样混合均匀后去除样品中的碎石、根茎,通过2 mm筛过筛,一部分放入 15 mL 的离心管中置于液氮中保存,转移到实验室并存储在-80 ℃冰箱中,用于DNA提取及进行微生物分析。其余土样在实验室内分为两部分,一部分放入4 ℃冰箱中,一部分自然风干后,用于土壤理化性质的测定。
1.3 土壤样品理化性质的测定
土壤含水率的测定:将取回的新鲜土样立即放入铝盒在天平上称质量,精确至0.01 g,将盒盖倾斜放在铝盆上,置于已预热至(10±2) ℃的恒温干燥箱中烘8 h,取出称质量计算;土壤pH值采用水土比为2.5 ∶1的酸度计测定;土壤有机质含量采用德国Elementar公司生产的vario TOC仪测定土壤有机碳含量;全氮含量的测定:称取过0.149 mm筛子的土样0.25 g,加入2 g硫酸锌和硫酸铜混合后的加速剂和5 mL浓H2SO4进行消煮,消煮完定容过滤,用连续流动分析仪进行测定;全磷含量采用硫酸-高氯酸酸溶-钼锑抗比色法测定;土壤速效磷含量采用0.5 mol/L碳酸氢钠浸提-钼锑抗比色测定。
1.4 DNA提取和高通量测序
使用Power Soil DNA提取试剂盒,按照说明书的使用方法,称取0.5 g鲜土,对所有土壤样品(n=18)基因组DNA进行提取。通过1%琼脂糖凝胶电泳检测提取的基因组DNA。 PCR在GeneAmp 9700 PCR系统上进行。使用通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)用于细菌16S rRNA基因。通过2%琼脂糖凝胶电泳检测扩增的产物,并使用AxyPrep DNA凝胶提取试剂盒从凝胶中回收,用Tris-HCl洗涤,并通过2%琼脂糖凝胶电泳验证。使用QuantiFluorTM-ST荧光仪对PCR产物进行定量,并根据需要调整样品以进行测序。测序由北京百迈克技术有限公司(中国北京)使用Illumina HiSeq平台进行的。
1.5 16S rRNA基因序列分析
將原始的fastq序列文件通过Trimmomatic进行质量过滤,然后通过FLASH拼接,要求符合以下标准:(1)小于50 bp并且平均质量得分小于20分的序列;(2)允许2个核苷酸错配,并删除含有歧义碱基的片段;(3)重叠长度超过10 bp的序列根据其重叠序列被合并。
使用UPARSE(7.1版,http://drive5.com/uparse/),将操作分类单位(OTU)与97%的相似性分类,并使用UCHIME鉴定并去除嵌合序列。通过RDP分类算法(http://rdp.cme.msu.edu/)针对Silva(SSU123)16S rRNA数据库分析了所有16S rRNA基因序列的分类。
1.6 数据分析
使用mothur软件计算属于α多样性分析的群落丰富度参数(Chao指数、ACE指数),群落多样性参数(Simpson指数、Shannon-Wiener指数)。使用R软件包可视化分析描述计算β多样性,并且计算基于OUT水平的冗余分析(RDA)。采用单因素方差分析( One-way ANOVA)法分析不同用地类型对土壤性质和微生物多样性的影响,并用Duncan’s检验法检验每个指标在不同用地类型间的差异显著性( α=0.05)。所有样品结果均为“平均值±标准差”。组间P<0.05的结果被证明具有统计学意义。
2 结果与分析
2.1 不同土地利用方式下土壤理化性质的变化
3种土地利用方式土壤的理化性质见表1。3种样本土壤均偏酸性,其中农田的pH值最低,湿地居中,林地则最高;与农田土壤含水率(15.48%)和林地土壤(23.19% )相比,原始湿地土壤含水率为73.66%,含水率更高。
2.2 不同土地利用类型土壤细菌OTU
湿地、林地和农田3种土地利用类型共有3 917种土壤细菌OTU序列,其中共同拥有2 149个土壤细菌OTU序列。湿地土壤细菌特有OTU数量最高,为398,占总数的18.52%;农田土壤细菌特有OTU数量为298,占总数的7.61%;林地土壤细菌特有OTU数量为60,占总数的1.53%。分析结果表明,在原始湿地和农田土壤中细菌OTU数量较高,且原始湿地土壤中所特有的OTU数量最多(图1)。
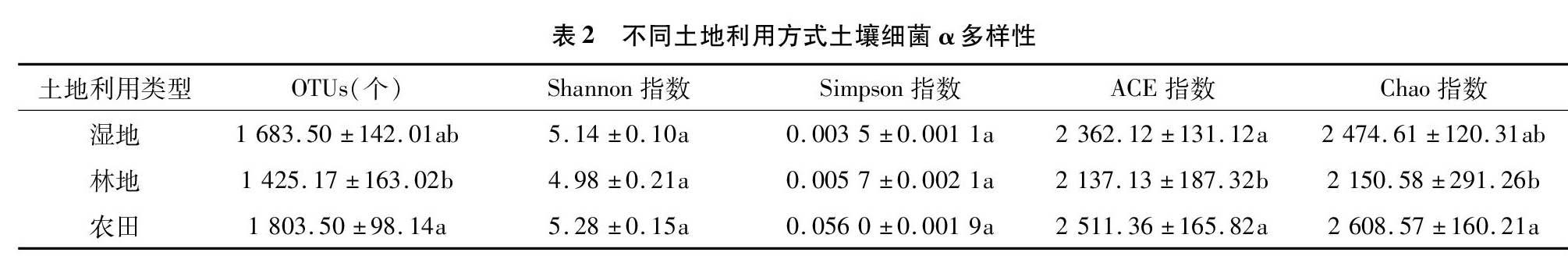
2.3 不同土地利用方式土壤微生物α和β多样性的变化
湿地、林地、农田3种土地利用类型土壤样品细菌的α多样性指数见表2。Shannon指数表现为农田>湿地>林地,表明农田的细菌多样性最低,但3种土地利用类型Shannon指数没有显著差异。土壤样品的Simpson指数表现为农田>林地>湿地,但三者差异也不显著。ACE指数表现为农田>湿地>林地,且湿地与林地和农田存在显著差异(P<0.05)。Chao1指数农田>湿地>林地,且3种土地利用类型之间存在显著差异(P<0.05)。分析结果表明,细菌多样性在3种土地利用类型中没有显著差异,但细菌丰富度在农田土壤中最高,在湿地土壤中最低。
不同土地利用方式细菌群落β多样性选用Bray-Crutis距离的Pcoa来衡量,分析结果见图2,不同土地利用方式的细菌群落结构之间差异显著(PERMANOVA:r=0.83,P<0.05),样品内部的差异不显著,差异主要来自不同样本间(图3)。表明长期土地利用的变化会导致细菌群落结构发生改变。
2.4 不同土地利用方式土壤细菌群落结构组成分析
从整体的细菌群落结构组成来看,所有的OTUs属于58个细菌门,把序列无法分类到已知的门水平则该门统一分类于“其他”。从3种土地类型所有门水平的相对丰度来看,样本中的优势菌门均为酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)。湿地土壤优势细菌中的酸杆菌门相对丰度为27.97%,变形菌门相对丰度为23.07%,放线菌门相对丰度为18.88%。原始湿地转变森林后酸杆菌门相对丰度减少了9.31百分点,而原先的放线菌门相对丰度则增加了14.50百分点,变形菌门相对丰度减少了0.85百分点;在湿地转变为农田土壤中酸杆菌门相对丰度减少了21.37百分点,放线菌门相对丰度则增加了2.03百分点,变形菌门相对丰度则增加了5.77百分点。
采用双样本t检验方法,对不同土地利用方式细菌群落门水平丰度和属水平丰度差异进行分析。从门水平(图4-A)来看,共有2个细菌门Actinobacteria和Bacteroidetes)在3种土地利用方式中有显著差异(P<0.05)。湿地、林地有4个门存在显著差异(P<0.05),主要为Actinobacteria、Verrucomicrobia、BRC1、Latescibacteria(图4-B)。湿地和农田有5个门存在显著差异(P<0.05),主要为Acidobacteria、Bacteroidetes、Planctomycetes、Latescibacteria、WWE3(图4-C)。森林和农田有4个门存在显著差异(P<0.05),主要为Acidobacteria、Bacteroidetes、Planctomycetes、WWE3(图4-D)。
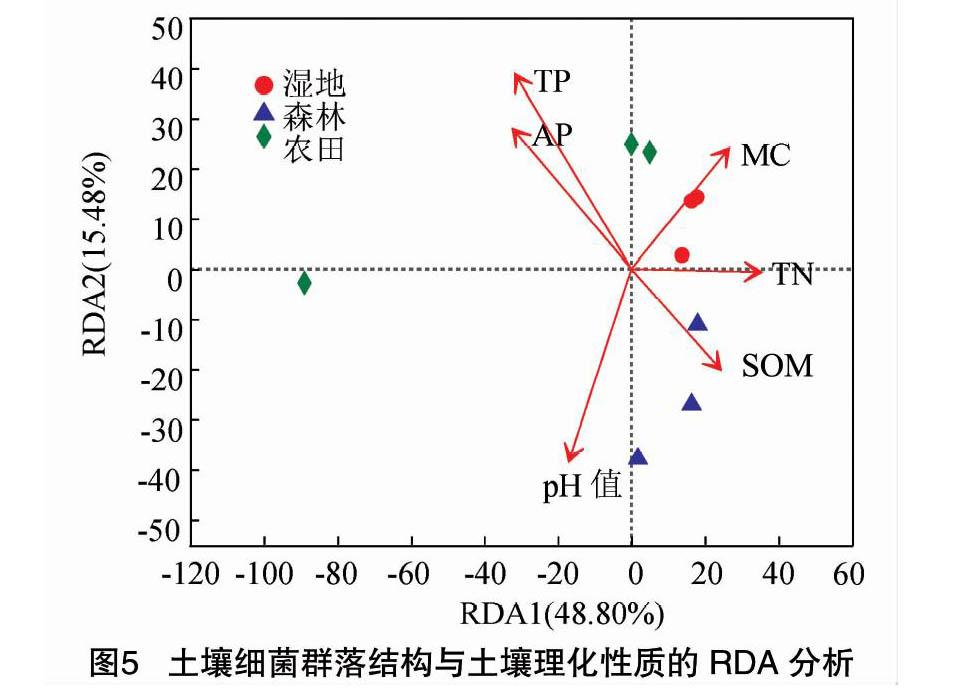
2.5 不同土地利用方式土壤细菌群落与理化性质的冗余分析
将土壤理化性质分别与门和属分类水平下细菌的群落组成关系进行冗余分析,分析结果见图5。第1序轴解释了所有信息的81.31%,第2序轴解释了所有信息的7.37%,前两轴可以解释88.68%。pH值、TN含量的射线较长,表明其对细菌群落组成影响较大,而SOM、AP、TP含量的射线较短,表明其对细菌群落组成影响较小。
3 讨论
3.1 土地利用方式对土壤微生物群落组成及多样性影响
土壤微生物群落多样性的变化可以反映土壤生态系统的质量和健康水平[11-12]。人类对自然生态系统的活动干扰,是改变生态系统服务功能最重要的直接驱动力,研究细菌群落结构和多样性的变化,可以深入揭示不同土地利用下土壤细菌群落结构上的差异[13-15]。不同土地利用方式显著改变了土壤细菌ACE指数、Chao指数,使细菌群落丰度发生显著改变,农田和林地的细菌群落丰度要高于原始湿地。土地利用方式变化并没有改变土壤细菌群落的主要门,3种土地土壤中的优势菌门均为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria),它们可占各样本细菌群落总量的 80% 以上,这与之前研究土壤微生物群落结构结果[16-17]一致。但它们的优势菌门的相对丰度发生显著变化,与原始湿地相比,林地和农田中的放线菌门相对丰度降低9.31、21.37百分点;变形菌门相对丰度在林地中增加5.77%,在农田中增加14.50百分点;酸杆菌门相对丰度在林地中增加6.88百分点,在农田中降低2.03百分点。相关研究表明,变形菌门和放线菌门主要參与有机质分解[18],变形菌门和酸杆菌门由于其不同的生活方式,常被用作衡量土壤营养状况[19],相关研究表明,变形菌门的相对丰度与土壤碳含量有正相关关系,变形菌门的丰度随着有机质含量的增加而增加,而且在营养较为丰富的土壤中比例更高[20-21]。酸杆菌门属于嗜酸性细菌门,广泛分布在不同的土壤环境中,酸杆菌门的相对丰度能够表明土壤的酸性条件[22-23]。放线菌是形成孢子的细菌,在恶劣和贫瘠的土壤条件下占主导地位,并且能够通过将其菌丝渗透到庞大的植物组织中来分解更多难分解的有机碳[24-25]。变形菌门被认为与碳利用有关,是世界上最为普遍的菌门。酸杆菌门与土壤营养相关性较大,一般而言,营养贫瘠的土壤中,酸杆菌门丰富度较高。本研究中放线菌门是仅次于酸杆菌门、变形菌门的另一类优势类群,在门水平上,林地和湿地土壤中的酸杆菌门丰度均显著高于农田,而农田土壤中的变形菌门丰度显著高于林地和湿地。相关研究表明,酸杆菌有利于酸性条件,与pH值呈负相关,而变形菌在较高的pH值土壤中占主导地位。研究表明,近中性土壤中更多不稳定的生物可利用有机碳库支持变形菌门等复合营养细菌,而酸性土壤中生物有效性较低的有机碳有利于酸杆菌等细菌。这可能是因为农田受到耕作交替的影响引起土壤结构、养分供给的变化[13],耕作干扰频繁[14],土壤养分充足,部分也更均匀,因此微生物群落多样性高于原始湿地。也有可能是因为原始湿地含水率高,氧气含量低,因此导致湿地的土壤细菌群落多样性较低。与原始湿地相比,农田和林地显著增加了土壤细菌群落的丰度。
3.2 土壤理化性质对土壤微生物群落组成的影响
土地利用方式决定地表的植被类型和土壤的管理方式,进而影响到土壤养分[25-26]。而养分不同程度的变化改变了土壤的理化性质,细菌是土壤中多样性最丰富的微生物类群,对环境的变异极其敏感,所以土壤优势细菌门、属的丰度也会发生改变,说明土壤营养元素含量的变化导致了土壤细菌的组成及群落结构的变化[27-29]。
影响土壤微生物的因素很多,如pH值及土壤全磷、速效磷、硝态氮、铵态氮含量等[28-29]。本研究中,全磷和速效磷的含量是影响细菌群落结构的重要因素[17-18]。土壤养分的变化势必会影响到微生物群落结构,而不同程度的养分添加会增加微生物群落结构和功能多样性[19]。细菌是土壤中多样性最丰富的微生物类群[20],对环境的变异极其敏感。细菌细胞壁含有大量磷壁酸,特别在革兰氏阳性菌中,细胞壁中磷壁酸的含量约占细胞干质量的50%[21]。在本研究中农田和林地的全磷和速效磷含量均显著高于湿地,原因可能是林地冠层对于雨水的拦截使得地表径流变小,土壤表层有机质以及矿质营养得以保留,流失较少,使得林地土壤养分含量均显著高于弃耕地;而耕地后期人为施肥,使得土壤中营养得以补偿[22];但是湿地没有外来营养的补充,植被的生长又吸收了土壤中吸附的磷元素,最终导致土壤中全磷和速效磷的含量均较低。土壤中的磷不仅是土壤细菌群落的能源之一,同时也是植物生长的重要资源[22-24]。虽然三江平原地区黑土的特殊生境使得土壤对磷的吸附量增加[21],但土壤磷主要来源于土壤母质,其来源单一,加之在三江平原地区黑土区植被生长盛期,不同土地利用方式下土壤中的磷可能在“植物—土壤—微生物”系统中重新分配,使得磷含量成为影响土壤细菌群落变异的重要因子之一[25-27]。
随土壤肥力及环境状况的变化,土壤微生物种群数量也会存在不同程度的差别[28-29]。相关研究表明,不同土地利用类型之间土壤有机质、全氮等养分含量不同,土壤优势细菌门、纲的相对丰富度也不同,说明土壤营养元素含量的变化导致土壤细菌的组成及群落结构的变化[23-24]。原始湿地土壤pH值是影响植物、微生物代谢生长的重要条件,土壤pH值的变化必然会导致微生物群落结构的改变。已有研究表明,土壤pH值与微生物群落多样性有极好的相关性[25],因为不同细菌对环境 pH值要求不同,即使是环境pH值的细微变化,也会对微生物群落结构产生显著影响[30]。而土壤养分也是影响土壤微生物群落结构的重要因素之一[23]。相关研究表明,在富营养条件下,磷元素对原有微生物群落的限制作用被大大削弱,微生物的代谢活动发生变化,进而可能会改变微生物的种类组成[22]。由此看来,沼泽湿地土壤开垦为农田改变了土壤pH值、含水率及土壤养分,从而对微生物群落结构产生影响。Fierer等研究发现,在森林土壤中酸杆菌相对丰度与土壤有机质含量、含水率呈显著正相关[31],这与本研究结果一致。
本研究结果显示,湿地转变为林地或农田后,土壤理化性质的改变主要表现为土壤含水率降低,pH值上升,全磷、速效磷含量下降,土壤理化性质的改变对土壤微生物群落结构产生了影响。土壤微生物群落组成明显受到人为活动干扰。相较开垦后土壤微生物组成,原始湿地土壤富含 Rhizomicrobium、Bacillus、Arthrobacter 等种类的根际促生细菌;而改种大豆植物土壤中Gemmatimonas、Staphylococcus 2种致病菌的丰度显著增加。与碳利用有关的变形菌门,在农田土壤中的丰度显著高于林地、湿地,而适应于酸性条件的酸杆菌门在林地、湿地土壤中的丰度均显著高于农田。
参考文献:
[1]孙 瑞,孙本华,高明霞,等. 长期不同土地利用方式下土土壤微生物特性的变化[J]. 植物营养与肥料学报,2015,21(3):655-663.
[2]Guo X P,Chen H Y H,Meng M J,et al. Effects of land use change on the composition of soil microbial communities in a managed subtropical forest[J]. Forest Ecology and Management,2016,373:93-99.
[3]Mganga K Z,Razavi B S,Kuzyakov Y.Land use affects soil biochemical properties in Mt.Kilimanjaro region[J]. Catena,2016,141:22-29.
[4]Hernández ,Arellano E C,Morales-Moraga D,et al. Understanding the effect of three decades of land use change on soil quality and biomass productivity in a Mediterranean landscape in Chile[J]. Catena,2016,140:195-204.
[5]Jangid K,Williams M A,Franzluebbers A J,et al. Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties[J]. Soil Biology and Biochemistry,2011,43(10):2184-2193.
[6]Krashevska V,Klarner B,Widyastuti R,et al. Impact of tropical lowland rainforest conversion into rubber and oil palm plantations on soil microbial communities[J]. Biology and Fertility of Soils,2015,51(6):697-705.
[7]Mendes L W,de Lima Brossi M J,Kuramae E E,et al. Land-use system shapes soil bacterial communities in Southeastern Amazon region[J]. Applied Soil Ecology,2015,95:151-160.
[8]Wood S A,Gilbert J A,Leff J W,et al. Consequences of tropical forest conversion to oil palm on soil bacterial community and network structure[J]. Soil Biology and Biochemistry,2017,112:258-268.
[9]王大偉,王 俊,李 光,等. 粮食总量动态平衡测算分析:黑龙江省西部地区粮食安全发展对策研究[J]. 黑龙江水利科技,2007,35(6):9-10.
[10]李英杰,陈 棣,李连玉.黑龙江省西部地区土地荒漠化发展趋势研究[J]. 防护林科技,2008(5):98-100.
[11]Achard F,Beuchle R,Mayaux P,et al. Determination of tropical deforestation rates and related carbon losses from 1990 to 2010[J]. Global Change Biology,2014,20(8):2540-2554.
[12]Xu X F,Schimel J P,Thornton P E,et al. Substrate and environmental controls on microbial assimilation of soil organic carbon:a framework for Earth system models[J]. Ecology Letters,2014,17(5):547-555.
[13]王丽娟,李 刚,赵建宁,等. 转基因大豆对根际土壤微生物群落功能多样性的影响[J]. 農业环境科学学报,2013,32(2):290-298.
[14]刘岳燕. 水分条件与水稻土壤微生物生物量、活性及多样性的关系研究[D]. 杭州:浙江大学,2009.
[15]刘岳燕,姚槐应,黄昌勇.水分条件对水稻土微生物群落多样性及活性的影响[J]. 土壤学报,2006,43(5):828-834.
[16]Zeng Q C,An S S,Liu Y.Soil bacterial community response to vegetation succession after fencing in the grassland of China[J]. Science of the Total Environment,2017,609:2-10.
[17]Zhang Y,Dong S K,Gao Q Z,et al. Climate change and human activities altered the diversity and composition of soil microbial community in alpine grasslands of the Qinghai-Tibetan Plateau[J]. Science of the Total Environment,2016,562:353-363.
[18]Li X,Sun M L,Zhang H H,et al. Use of mulberry-soybean intercropping in salt-alkali soil impacts the diversity of the soil bacterial community[J]. Microbial Biotechnology,2016,9(3):293-304.
[19]Hartman W H,Richardson C J,Vilgalys R,et al. Environmental and anthropogenic controls over bacterial communities in wetland soils[J]. PNAS,2008,105(46):17842-17847.
[20]McCaig A E,Glover L A,Prosser J I.Molecular analysis of bacterial community structure and diversity in unimproved and improved upland grass pastures[J]. Applied and Environmental Microbiology,1999,65(4):1721-1730.
[21]Bardhan S,Jose S,Jenkins M A,et al. Microbial community diversity and composition across a gradient of soil acidity in spruce-fir forests of the southern Appalachian Mountains[J]. Applied Soil Ecology,2012,61:60-68.
[22]Dang P,Yu X A,Le H,et al. Effects of stand age and soil properties on soil bacterial and fungal community composition in Chinese pine plantations on the Loess Plateau[J]. PLoS One,2017,12(10):e0186501.
[23]冯海玮,王大欣,毛 亮,等. 有机种植对麦田土壤微生物群落影响[J]. 上海交通大学学报(农业科学版),2016,34(5):68-75.
[24]喻 江,于镇华,Makoto I,等. 施用有机肥对侵蚀黑土玉米苗期根内生细菌多样性的影响[J]. 应用生态学报,2016,27(8):2663-2669.
[25]肖文丹. 典型土壤中铬迁移转化规律和污染诊断指标[D].杭州:浙江大学,2014.
[26]Wu M N,Qin H L,Chen Z,et al. Effect of long-term fertilization on bacterial composition in rice paddy soil[J]. Biology and Fertility of Soils,2011,47(4):397-405.
[27]唐 杰,徐青锐,王立明,等. 若尔盖高原湿地不同退化阶段的土壤细菌群落多样性[J]. 微生物学通报,2011,38(5):677-686.
[28]牛 佳,周小奇,蒋 娜,等. 若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J]. 生态学报,2011,31(2):474-482.
[29]Dhal P K,Islam E,Kazy S K,et al. Culture-independent molecular analysis of bacterial diversity in uranium-ore/-mine waste-contaminated and non-contaminated sites from uranium mines[J]. 3 Biotech,2011,1(4):261-272.
[30]Rani A,Sharma A,Rajagopal R,et al. Bacterial diversity analysis of larvae and adult midgut microflora using culture-dependent and culture-independent methods in lab-reared and field-collected Anopheles stephensi-an Asian malarial vector[J]. BMC Microbiology,2009,9:96.
[31]Fierer N,Bradford M A,Jackson R B.Toward an ecological classification of soil bacteria[J]. Ecology,2007,88(6):1354-1364.

