低温胁迫下乙酸叶醇酯对茶树耐寒性生理生化的影响
张续周 李金秋 陈雪津 王雯 李芳 马媛春 房婉萍 朱旭君



摘要:绿叶挥发物(GLVs)作为植物挥发物中的一类化合物,由C18和C16不饱和脂肪酸经酶催化分解形成的C6和C9醛、醇及其相应酯类组成。其中,乙酸叶醇酯是一种主要的GLVs,以Z-3-己烯醛和Z-3-己烯醇经酶作用合成。为了解乙酸叶醇酯在茶树耐寒性状中的作用,以一年生茶树品种中茶108为材料,使用乙酸叶醇酯后短时低温(4 ℃,1.5 h)和低温过夜(4 ℃,16 h)处理茶苗,测定茶树冷诱导基因表达和茶树生理生化特性指标。结果发现,乙酸叶醇酯在短时低温处理时可以提高冷诱导基因CsICE1、CsICE2、CsCBF1-CsCBF5的表达;在过夜低温处理时提高冷诱导基因CsRD1、CsRD2的表达;短时低温和过夜低温处理均能分别显著提高茶树过氧化物酶(POD)、过氧化氢酶(CAT)的酶活性,从而缓解低温胁迫对茶树的伤害。此外,乙酸叶醇酯还诱导自身合成途径关键酶基因CsADH1、CsADH3和CsLOX3的表达,进一步增强茶树耐寒能力。
关键词:茶树;绿叶挥发物;乙酸叶醇酯;低温胁迫;耐寒性
中图分类号:S571.101 文献标志码: A
文章编号:1002-1302(2021)24-0127-06
收稿日期:2021-08-23
基金项目:国家自然科学基金(编号:31800588);青岛农业大学科研启动基金(编号:1118025);山东省良种工程子课题(编号:2321401);青岛职业技术学院重点研发专项(编号:2020ZDYF09);北茶技艺技能传承创新平台资助。
作者简介:张续周(1972—),男,山东菏泽人,硕士,副教授,主要从事茶树育种与生物技术研究。E-mail:jiaonancha@126.com。
通信作者:朱旭君,博士,副教授,研究方向为茶树育种与栽培。E-mail:zhuxujun@njau.edu.cn。
低温是茶树生长发育中遭受的主要非生物胁迫之一,限制了茶树的生长发育[1]。低温会影响细胞膜流动性,破坏细胞骨架,影响自由基产生和清除系统的平衡以及引起酶活性的改变等[2-4]。此外,低温还会引起茶树中儿茶素、维生素和氨基酸等品质成分的变化[5]。茶树受到低温胁迫时,会发生一系列反应以提高自身对低温的抵抗能力,这种现象称为冷驯化[5]。冷驯化过程涉及大量的生理生化变化,其中包括冷誘导基因的表达,调节渗透物质的生成和抗氧化酶系统的作用等途径。
某些冷诱导基因在低温胁迫中的作用已经明确[6-8],如ICE(inducer of CBF expression)在收到冷胁迫信号后,与CBF(C-repeat binding factor)启动子结合诱导CBF基因表达[9],CBF识别CRT/DRE顺式作用元件调控下游COR(cold regulate)基因的转录,编码亲水性多肽增强细胞脂膜稳定性从而提高植物抗寒性[10]。其中,COR基因是一类在低温下可以快速表达的植物抗寒基因,也可以称为LTI(low temperature induced)、KIN(cold induced)、RD(response to dehydration)、ERD(early dehydration induced)基因[11]。
绿叶挥发物(green leaf volatiles,简称GLVs)是植物挥发物中的一类化合物,包括C16和C18不饱和酶和异构酶等作用下生成相应的醇和酯类[12-13]。脂氧合酶(lipoxygenase,简称LOX)和氢过氧化物裂解酶(hydroperoxide yase,简称HPL)作为脂氢过氧化物裂解酶催化形成C6和C9醛,进一步通过脂质代谢途径合成GLVs[12-15]。同时,GLVs含量也对合成酶具有反馈调节作用,如外源施用顺-3-己烯醇能在24 h内显著诱导茶树LOX和ADH基因的表达[16]。GLVs在植物遭受机械损伤,草食性昆虫虫害,病原菌感染[15]时发挥防御作用;干旱、高温、低温[13]、强光和重金属等非生物胁迫[17-19]也会促进GLVs的释放。此外,外源施用生长素和赤霉素也会诱导甜瓜CmLOX09基因的表达[20]。外源Z-3-己烯醇可以通过反向调节自身合成关键酶基因LOXs、ADHs的表达,诱导DREB-2A和RDs基因表达并通过提高抗氧化酶活性等途径提高茶树对干旱胁迫的抗性[18]。乙酸叶醇酯是一种主要的绿叶挥发物,Z-3-己烯醛和Z-3-己烯醇(Z-3-HAC)经乙醇脱氢酶(alcohol dehydrogenase,简称ADH)和酰基转移酶(acyltransferase,AAT)作用最终生成乙酸叶醇酯,乙酸叶醇酯在茶树中的作用研究还未曾见。
本研究通过外源使用乙酸叶醇酯,测定低温处理后茶苗相关的生理特性指标和冷诱导基因表达情况,初步明确了乙酸叶醇酯在茶树抗寒性中的作用,为进一步深入研究乙酸叶醇酯在茶树低温胁迫中的作用机制提供参考。
1 材料与方法
1.1 试验材料
供试材料茶树品种中茶108为一年生扦插茶苗,购于南京雅润茶业有限公司。于2019年在南京农业大学茶学实验室进行试验处理。茶苗处理前在人工气候箱中培养2个星期,培养条件为光照 16 h(25 ℃)/黑暗8 h(20 ℃),光照度3 600 lx,相对湿度60%~70%。
1.2 试验方法
T1(短时低温处理):乙酸叶醇酯(溶剂为二氯甲烷)处理1.5 h,4 ℃低温处理1.5 h;CK1(短时低温对照):二氯甲烷处理1.5 h,室温放置3 h,4 ℃低温处理1.5 h。T2(低温过夜处理):乙酸叶醇酯(溶剂为二氯甲烷)处理1.5 h,室温放置0.5 h,4 ℃低温处理16 h;CK2(低温过夜对照):二氯甲烷处理1.5 h,室温放置0.5 h,4 ℃低温处理16 h。取第1、2叶放入液氮速冻,-80 ℃保存。
1.3 测定指标及方法
参照酸性茚三酮显色法测定游离脯氨酸含量;采用超氧化物歧化酶(SOD)试剂盒、过氧化物酶(POD)试剂盒和过氧化氢酶(CAT)试剂盒测定相应酶活性,试剂盒均购于南京建成生物工程研究所有限公司;高效液相色谱法GB/T 8313—2008测定茶叶中儿茶素各组分含量。
叶片总RNA使用艾德莱 RN5301 EASYspin Plus 多糖多酚/复杂植物RNA快速提取试剂盒提取。RNA 反转录使用PrimeScriptTM RT Reagent Kit with gDNA Eraser(日本 TaKaRa 生物公司)试剂盒进行。利用qRT-PCR反应测定茶树GLVs合成相关基因CsADH和CsLOX,以及抗寒相关基因CsICE、CsCBF和CsRD的相对表达量。基于茶树基因组数据库(http://tpia.teaplant.org/index.html)获得茶树相关基因序列,利用Primer5设计特异性引物(表1)。qRT-PCR反应试验使用SYBR Green PCR master mix试剂盒(日本TaKaRa生物公司),仪器使用Bio-Rad IQ5实时荧光定量仪(Bio-Rad,USA),内参基因为β-actin。定量反应程序为95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环[21]。每个处理试验重复3次,基因相对表达量分析采用2ΔΔCT法计算。
1.4 数据分析
试验数据使用Excel 2010和SPSS Statistic 20.0软件对数据进行分析,方差分析多重比较采用Duncan’s新复极差法,P<0.05表示差异显著。采用Graphpad Prism 5作图。
2 结果与分析
2.1 低温胁迫下乙酸叶醇酯对茶树GLVs合成相关基因表达的影响
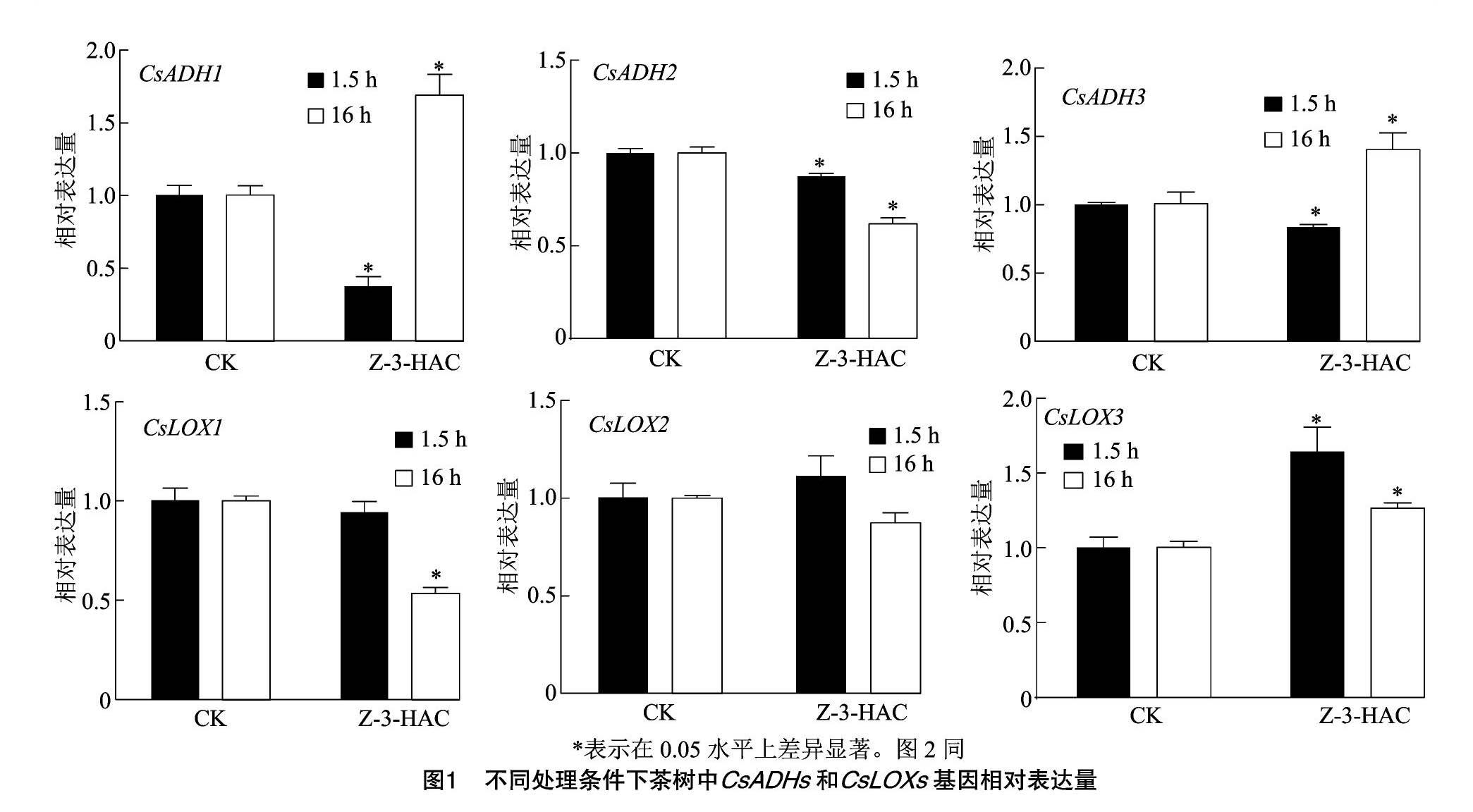
茶树中GLVs主要来源于亚麻酸降解途径,该途径中的关键酶为LOX、HPL和ADH。外源Z-3-己烯醇能在24 h内显著诱导茶树LOXs、ADHs部分基因积累,对HPL无明显效果[18]。为了解低温环境下外源施用乙酸叶醇酯对GLVs合成途径关键酶基因的影响,测定CsADH1、CsADH2、CsADH3和CsLOX1、CsLOX2、CsLOX3的表达情况,结果(图1)表明,短时低温(4 ℃,1.5 h)下外源乙酸叶醇酯显著提高了CsLOX3积累量(P<0.05),显著抑制了CsADH1、CsADH2、CsADH3的表達。 低温过夜处理(4 ℃,16 h)中外源乙酸叶醇酯处理使CsADH1、CsADH3和CsLOX3表达量显著增加,CsADH2和CsLOX1表达量显著降低。
2.2 低温胁迫下乙酸叶醇酯对茶树耐寒相关基因表达的影响
茶树在低温胁迫下,一些冷诱导基因表达会上调,CsICE和CsCBF是低温信号传递中的重要元件,能够感受上游信号并将低温信号向下游传递[22-24]。为明确外源施用乙酸叶醇酯对低温胁迫下冷诱导基因表达的影响,测定了CsICEs、CsCBFs和CsRDs部分基因的表达情况(图2)。短时低温处理(4 ℃,1.5 h)中外源乙酸叶醇酯显著提高了CsICE1、CsICE2和CsCBF1~CsCBF5的表达量;CsRD1-CsRD3表达降低。 低温过夜处理(4 ℃,16 h)中, 外源乙酸叶醇酯处理使CsICE1、CsRD1 和CsRD2积累增加,显著降低了CsCBF1~CsCBF5和 CsRD2的表达量,对CsICE2无显著影响。
2.3 低温胁迫下乙酸叶醇酯对茶树生理指标的影响
2.3.1 茶树保护酶活性 茶树在受到低温胁迫时
产生大量活性氧会使膜脂发生脂质过氧化反应,为保护细胞免受伤害,抗氧化酶系统被激活。通过测定茶树抗氧化酶系统中重要的氧化酶SOD、POD和CAT活性,发现外源乙酸叶醇酯使POD活性在短时低温(T1)和低温过夜处理(T2)时均增加;SOD和CAT活性在施用乙酸叶醇酯后低温过夜处理时表达量增加,但在未施用乙酸叶醇酯的短时低温处理中表达量更高(图3)。
2.3.2 茶树游离脯氨酸含量 脯氨酸是植物细胞抗寒的主要渗透调节物质之一,在低温胁迫下,游离脯氨酸含量会增加,以增加细胞液浓度,增强细胞保水能力,从而增强细胞耐寒性[2]。外源乙酸叶醇酯使短时低温(T1)和过夜低温处理(T2)中茶树叶片游离脯氨酸含量均降低,分别降低了16.76%和69.68%(图4)。
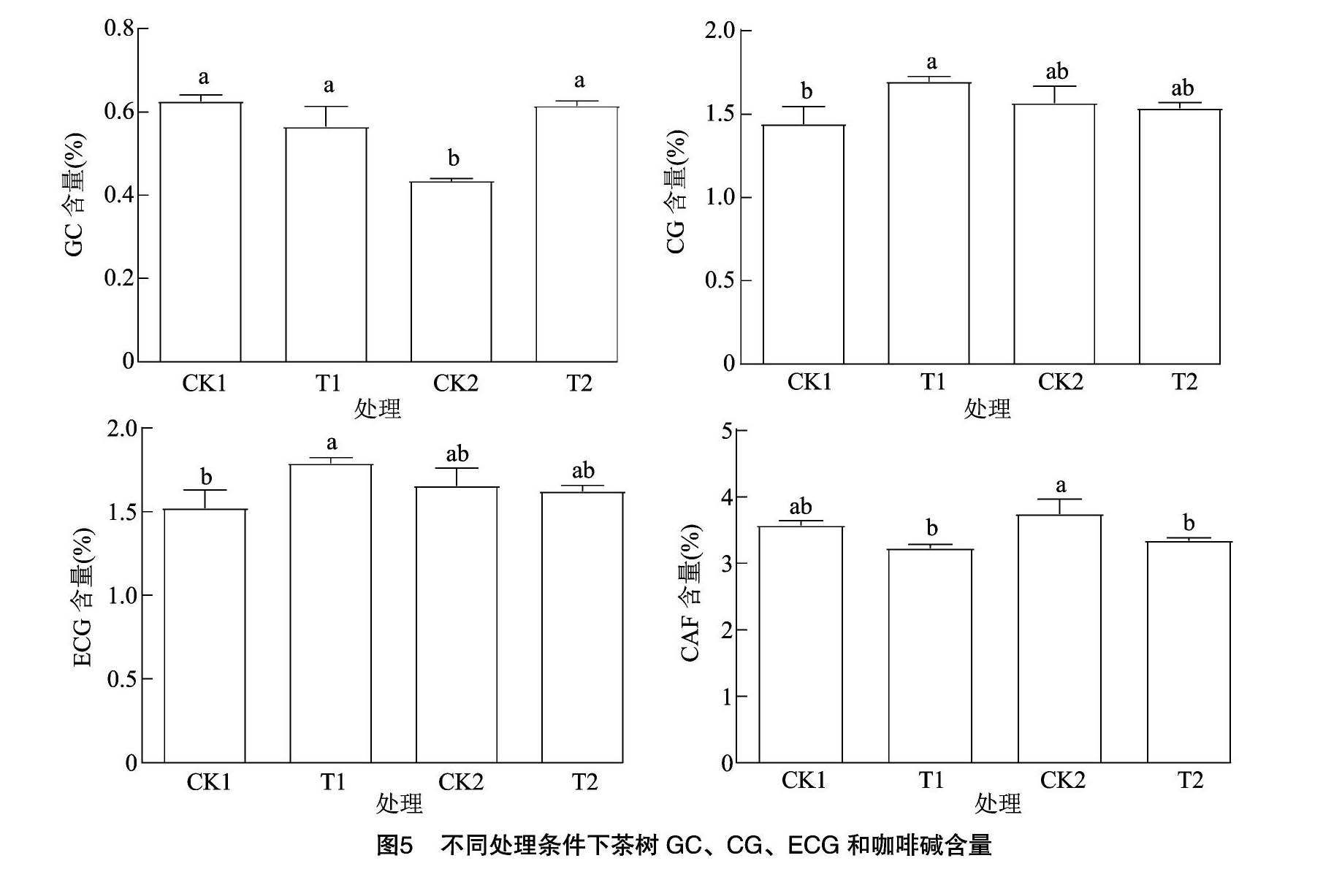
2.3.3 茶树叶片中儿茶素和咖啡碱含量 低温胁迫会影响茶树叶片中理化成分的合成,进而影响茶叶的品质,本试验测定了茶叶中主要儿茶素单体成分和咖啡碱含量(图5),施用外源乙酸叶醇酯,茶树叶片中GC的含量在低温过夜处理(T2)相对更高,茶树叶片中ECG和CG在短时低温处理时(T1)含量均增加。外源乙酸叶醇酯处理在茶树短时和过夜低温处理时,咖啡碱含量均明显减少。
3 讨论与结论
植物正常生长情况下体内只存在极少量的绿叶挥发物,在受到机械损伤、低温、干旱和虫害等外界胁迫时,能迅速释放大量绿叶挥发物来抵抗外界胁迫[25]。本试验在低温胁迫前使用乙酸叶醇酯进行处理,通过研究短时低温处理和过夜低温处理中茶树叶片LOXs、ADHs部分基因和冷胁迫诱导基因ICEs、CBFs和CORs家族部分成员的表达情况,发现乙酸叶醇酯能在短时低温处理时显著诱导CsLOX3的表达;过夜低温处理时CsADH1和CsADH3的相对表达量也增加。GLVs可以通过反向调节自身合成途径关键酶基因的表达,促进绿叶挥发物和茉莉酸等激素的合成,进一步增强茶树抗性[16]。乙酸叶醇酯使短时低温处理时CsICE1、CsICE2、CsCBF1、CsCBF5基因的表达被诱导;低温过夜处理时,CsRD1和CsRD2基因的表达量增加,而CsCBF1~CsCBF5基因的表达量降低。这可能与CBF基因和RD基因响应冷胁迫顺序有关,CBF在低温信号转导过程中位于上游环节,响应冷胁迫迅速;RD基因在下游环节,响应冷胁迫时间较长[26-27]。CBF基因转录产物在低温胁迫下15 min后迅速积累,2 h含量达到最高水平后逐渐下降,而COR(RD)基因转录产物才开始积累[10]。
SOD、POD和CAT是细胞抗氧化酶的重要组成部分,能够在植物受到非生物胁迫时清除细胞内的自由氧,维持植物体内的活性氧代谢平衡,缓解自由氧对细胞的伤害[28]。本试验中外源乙酸叶醇酯的施用显著提高了低温过夜处理下茶树叶片SOD、POD和CAT的酶活性。此外,外源乙酸葉醇酯的施用还会影响茶树叶片的理化成分,增加了低温胁迫下茶树体内GC、ECG和CG的含量,降低了咖啡碱含量。
本试验结果表明,乙酸叶醇酯在短时低温(4 ℃,1.5 h)和低温过夜处理(4 ℃,16 h)中可通过提高自身合成基因CsADH1、CsADH3和CsLOX3的表达量;促进冷诱导基因CsICE1、CsICE2、CsCBF1~CsCBF5、CsRD1和CsRD2按冷信号传导顺序表达;增强SOD、POD和CAT酶活性等方式提高茶树的抗寒性。
参考文献:
[1]尹皓婵,李莉莉,宋宛霖,等. 茶树抗寒机理及其应用的研究进展[J]. 安徽农业科学,2019,47(4):22-25.
[2]时 慧,王 玉,周克福,等. 低温胁迫下茶树叶片活性氧代谢及渗透调节物质含量的变化规律[J]. 山东农业科学,2012,44(7):22-25.
[3]郝心愿,王 璐,曾建明,等. 低温冻害对茶树生理的影响及应对技术[J]. 中国茶叶,2020,42(5):13-16.
[4]林郑和,钟秋生,游小妹,等. 低温胁迫对茶树抗氧化酶活性的影响[J]. 茶叶科学,2018,38(4):363-371.
[5]李叶云,庞 磊,陈启文,等. 低温胁迫对茶树叶片生理特性的影响[J]. 西北农林科技大学学报(自然科学版),2012,40(4):134-138,145.
[6]王 郁. 茶树低温应答相关转录因子CsICE1和CsCBF1的研究[D]. 合肥:安徽农业大学,2011:37-42.
[7]Gong Z Z,Xiong L M,Shi H Z,et al. Plant abiotic stress response and nutrient use efficiency[J]. Science China(Life Sciences),2020,63(5):635-674.
[8]Yin Y,Ma Q P,Zhu Z X,et al. Functional analysis of CsCBF3 transcription factor in tea plant (Camellia sinensis) under cold stress[J]. Plant Growth Regulation,2016,80(3):335-343.
[9]Wang P J,Chen X J,Guo Y C,et al. Identification of CBF transcription factors in tea plants and a survey of potential CBF target genes under low temperature[J]. International Journal of Molecular Sciences,2019,20(20):5137.
[10]刘东晓. 茶树CsCBF2转基因烟草的非生物胁迫耐受性分析[D]. 信阳:信阳师范学院,2017.
[11]黄永会,刘永翔,朱 英,等. COR基因在植物抗寒基因工程中的作用[J]. 贵州农业科学,2014,42(12):37-42.
[12]陈书霞,陈 巧,王聪颖,等. 绿叶挥发物代谢调控及分子机理研究进展[J]. 中国农业科学,2012,45(8):1545-1557.
[13]Bai J H,Baldwin E A,Imahori Y,et al. Chilling and heating may regulate C6 volatile aroma production by different mechanisms in tomato (Solanum lycopersicum) fruit[J]. Postharvest Biology and Technology,2011,60(2):111-120.
[14]谢鑫鑫,林碧英,林忠平.绿叶挥发物合成相关基因及其生理生态功能[J]. 亚热带农业研究,2014,10(4):279-284.
[15]Sun H F,Li Z Y,Wu B,et al. Review of recent advances on the production and eco-physiological roles of green leaf volatiles[J]. Chinese Journal of Plant Ecology,2013,37(3):268-275.
[16]Hu S L,Chen Q H,Guo F,et al. (Z)-3-Hexen-1-ol accumulation enhances hyperosmotic stress tolerance in Camellia sinensis[J]. Plant Molecular Biology,2020,103(3):287-302.
[17]Wang L,Baldwin E,Luo W,et al. Key tomato volatile compounds during postharvest ripening in response to chilling and pre-chilling heat treatments[J]. Postharvest Biology and Technology,2019,154:11-20.
[18]胡双玲.绿叶挥发物和组蛋白H3K4甲基化在茶树干旱胁迫响应中的功能研究[D]. 武汉:华中农业大学,2019:37.
[19]Yamauchi Y,Matsuda A,Matsuura N,et al. Transcriptome analysis of Arabidopsis thaliana treated with green leaf volatiles:possible role of green leaf volatiles as self-made damage-associated molecular patterns[J]. Journal of Pesticide Science,2018,43(3):207-213.
[20]Ju L J,Zhang C,Liao J J,et al. An oriental melon 9-lipoxygenase gene CmLOX09 response to stresses,hormones,and signal substances[J]. Journal of Zhejiang University.Science.B,2018,19(8):596-609.
[21]Shen J Z,Zou Z W,Xing H Q,et al. Genome-wide analysis reveals stress and hormone responsive patterns of JAZ family genes in Camellia sinensis[J]. International Journal of Molecular Sciences,2020,21(7):2433.
[22]朱小佩.茶樹CBF基因的克隆与功能分析[D]. 信阳:信阳师范学院,2011:44.
[23]尹 盈.茶树低温胁迫转录因子CsICE和CsCBF的亚细胞定位、表达分析及功能验证[D]. 南京:南京农业大学,2013:73.
[24]Wang Y,Jiang C J,Li Y Y,et al. CsICE1 and CsCBF1:two transcription factors involved in cold responses in Camellia sinensis[J]. Plant Cell Reports,2012,31(1):27-34.
[25]王智煜,李迎迎,胡雅倩,等. 四分体期低温胁迫对2个小麦品种幼穗结实率及生理特性的影响[J]. 江苏农业科学,2019,47(10):114-116.
[26]Chinnusamy V,Ohta M,Kanrar S,et al. ICE1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes & Development,2003,17(8):1043-1054.
[27]Zhao C Z,Lang Z B,Zhu J K.Cold responsive gene transcription becomes more complex[J]. Trends in Plant Science,2015,20(8):466-468.
[28]Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.

