miR-92a与miR-19b对小鼠胰岛β细胞胰岛素基因表达的影响*
李旭艳,翟文君,付 娜,田 娟
(1岭南师范学院生命科学与技术学院,广东湛江 524000;2东北林业大学生命学院,黑龙江哈尔滨 150040)
糖尿病是一种典型的内分泌代谢疾病,已成为严重威胁人类健康的公共卫生问题。糖尿病可分为Ⅰ型、Ⅱ型、妊娠和特殊类型糖尿病,虽然分型不同,但其发病主要归因于胰腺β 细胞数量减少或功能下降导致的胰岛素分泌相对不足或胰岛素抵抗。胰岛素的表达、合成和分泌受转录因子、微小RNA(mi⁃croRNA,miRNA)、长链非编码RNA(long noncoding RNA,lncRNA)、营养因子和激素等多种因素调控。转录因子胰十二指肠同源框蛋白1(pancreatic and duodenal homeobox protein 1,Pdx1)、肌腱膜纤维肉瘤癌基因同源物A(musculoaponeurotic fibrosarcoma oncogene homolog A,Mafa)、神经源性分化因子1(neurogenic differentiation factor 1,NeuroD1)等可结合胰岛素基因启动子,激活其表达。胰腺内分泌转录因子Pdx1、Mafa、神经元素3(neurogenin 3,Ngn3)等的表达又受GLI 样蛋白3(GLI-similar 3,GLIS3)、鸟嘌呤核苷酸结合蛋白Gsα 亚基短异形体(guanine nucleotide-binding protein Gssubunit alpha isoforms short,GNAS)等调控[1-2]。miRNAs和lncRNAs是一类不具有蛋白编码潜能的非编码RNA,在糖尿病和β细胞中发挥重要作用,如miR-26a[3]、miR-96[4]、miR-770[5]、miR-124a[6]、lncRNA ROIT[7]、环状RNA(circu⁃lar RNA,circRNA)HIPK3[8]等。
miR-92a 和miR-19b 是miR-17-92 家族成员,参与调控神经和骨骼等多种组织器官发育和肿瘤细胞的发生、发展。近年来发现,miR-92a 和miR-19b 在胰腺癌、糖尿病及其并发症患者血清中表达异常,可能参与胰腺疾病发生、发展过程[9-12]。本项工作以小鼠胰岛素瘤细胞为研究对象,分别转染阴性对照miRNA(negative control miRNA,NC)、miR-92a 和miR-19b,检测胰岛素基因表达情况,探究miR-92a和miR-19b 对小鼠胰岛β 细胞胰岛素基因表达的调控作用,将丰富胰岛β细胞功能调控机制。
材料和方法
1 细胞
小鼠胰岛素瘤MIN6 细胞、成体胰腺祖细胞(pancreatic progenitor cells)和小鼠成纤维细胞3T3为东北林业大学发育生物学实验室提供[12]。
2 主要试剂
RPMI-1640 培养液、DMEM 培养液、DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)、新生牛血清(newborn calf serum,NCS)和B27 细胞培养添加剂购自Gibco;青-链霉素、L-谷氨酰胺和胰蛋白酶购自HyClone;重组人胰岛素和表皮生长因子(epider⁃mal growth factor,EGF)购自Becton;细胞转染脂质体Lipofectamine RNAiMAX 和Lipofectamine 2000 购自Invitrogen;总RNA 提取试剂TriPure 和实时荧光定量PCR 试剂购自Roche;E.coliPoly(A)聚合酶和ATP购自NEB;脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseI)和核糖核酸酶抑制剂(ribonuclease inhibi⁃tor,RRI)购自TaKaRa;反转录试剂盒、抗β-肌动蛋白(β-actin)抗体(HC201-02)、羊抗鼠和羊抗兔辣根过氧化物酶标记的II 抗(HS201-01 和HS101-01)购自北京全式金生物技术有限公司;Cell Counting Kit-8(CCK8)购自Dojindo Labratories;BCA 蛋白浓度测定试剂盒、RIPA 蛋白裂解液和Alexa Fluor 555 标记的驴抗兔荧光Ⅱ抗(A0453)购自碧云天生物技术研究所;抗胰岛素抗体(sc-9168)购自Santa Cruz;抗NeuroD1 抗体(ab60704)购自Abcam;高纯度质粒提取试剂盒购自天根生化科技有限公司;双萤光素酶报告基因检测试剂盒购自Promega;β-巯基乙醇、过硫酸铵、丙烯酰胺、甲基双丙烯酰胺和四甲基乙二胺购自Sigma;甲醇和吐温20 等常规生化试剂购自天津天大化学试剂厂。含NeuroD1 3´UTR 的萤火虫萤光素酶报告载体和海肾萤光素酶报告载体由东北林业大学发育生物学实验室提供。NC、miR-92a 和miR-19b 由吉玛基因股份有限公司合成,序列见表1。qPCR引物由金唯智基因公司合成,序列见表2。
3 主要方法
3.1 细胞培养 MIN6 细胞用含10% FBS、1% L-谷氨酰胺、1%青-链霉素和50 μmol/L β-巯基乙醇的RPMI-1640 完全培养液培养。胰腺祖细胞传代后,用10%贴壁培养液过夜培养,次日早更换2%生长培养液。胰腺祖细胞贴壁培养液为含10%FBS、1%青-链霉素和1% L-谷氨酰胺的DMEM/F12 培养液。胰腺祖细胞生长培养液为含2% FBS、1%青-链霉素、1%L-谷氨酰胺、2%B27 细胞培养添加剂、50 μmol/L β-巯基乙醇、10 mg/L 重组人胰岛素和20 μg/L EGF的DMEM/F12 培养液[13]。3T3 细胞用含有10%NCS、1% L-谷氨酰胺和1%青-链霉素的DMEM 高糖培养液培养。细胞放置在37℃、5%CO2、饱和湿度的培养箱中培养,根据生长情况每2~3 d 换液,细胞生长至80%以上汇合时传代。
3.2 细胞转染 24 孔板每孔接种1×105个MIN6 细胞,根据转染miRNAs 的不同,实验分为NC 组、实验I(miR-92a)组和实验II(miR-19b)组。NC 组细胞转染NC,实验I 组细胞转染miR-92a,实验II 组细胞转染miR-19b。细胞转染参照Lipofectamine RNAiMAX说明书操作,每组均设3 个复孔。转染48 h,倒置显微镜采集图像。
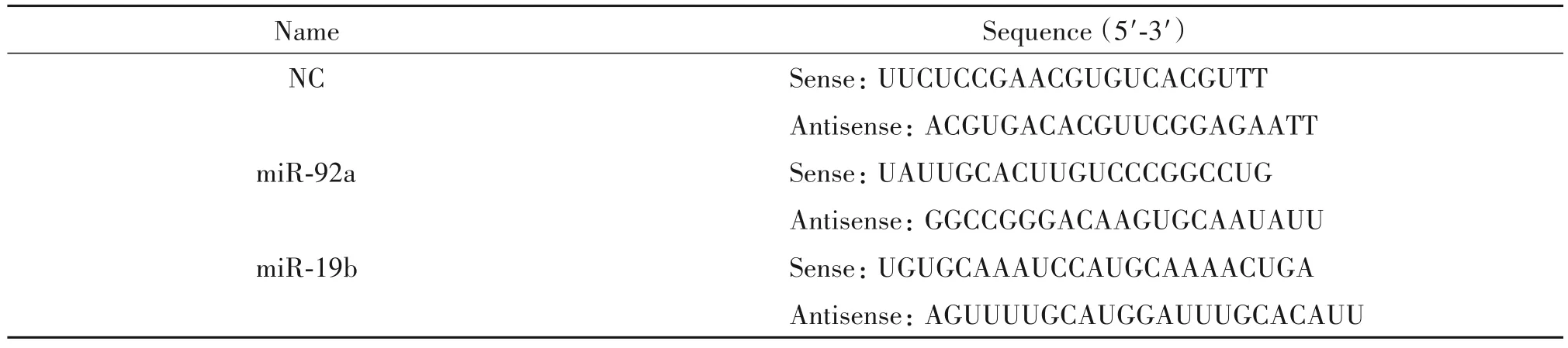
表1 miRNAs序列Table 1.The sequences of the miRNAs

表2 qPCR引物序列Table 2.The sequences of the primers for qPCR
3.3 CCK8 法检测细胞活力 96 孔板接种MIN6 细胞,生长至50%汇合,分别转染50 nmol/L NC、miR-92a 和miR-19b 后48 h,PBS 洗涤细胞,37℃条件下,用含10% CCK8 的RPMI-1640 培养液孵育2 h,酶标仪读取吸光度(A)。每组均设3个复孔。
3.4 qPCR 检测各基因mRNA 的表达 胰腺祖细胞和MIN6 细胞复苏传代培养3 代后,消化、离心、收集细胞,TriPure 裂解细胞,提取总mRNA,消化基因组DNA。1 μg 总mRNA 加polyA 尾,反转录,检测内源性miR-92a 和miR-19b 表达,以U6 为内参照,通过2−ΔΔCt方法计算相对表达量。实验设置3个重复。
MIN6 细胞转染50 nmol/L NC、miR-92a 或miR-19b 后48 h,TriPure 裂解细胞,提取总RNA,检测无基因组污染,取1 μg总mRNA加polyA尾,反转录后,qPCR 验证miR-92a 和miR-19b 过表达,以U6 为内参照。另取1 μg 总mRNA 通过随机引物反转录,获得cDNA,实时定量PCR 检测Ins1 和Ins2 的mRNA 表达,以β-actin为内参照,通过2−ΔΔCt方法计算相对表达量。实验设置3个重复。
3.5 Western blot 检测蛋白的表达 MIN6 细胞转染50 nmol/L NC、miR-92a 或miR-19b 后72 h,PBS 洗涤细胞,RIPA 裂解液裂解,离心取上清,测定蛋白浓度。样品进行SDS-PAGE,转膜,37℃封闭1 h,抗βactin(1∶1 000)、insulin(1∶300)和NeuroD1(1∶100)抗体4℃孵育过夜,TBST洗膜3次,Ⅱ抗(1∶5 000)室温孵育1 h,用Tanon 5200 发光成像系统采集图像。以β-actin为内参照。
3.6 免疫荧光染色 MIN6细胞转染50 nmol/L NC、miR-92a 或miR-19b 后72 h,PBS 洗2 次,4%多聚甲醛室温固定30 min,PBS 洗3 次,0.3% Triton X-100室温孵育30 min,PBS 洗3 次,10%马血清37℃封闭1 h,抗insulin 抗体(兔源,1∶100)4℃孵育过夜,PBS洗3次,驴抗兔FITC 标记的Ⅱ抗(1∶200)室温避光孵育1 h,PBS 洗3 次,DAPI(1∶2 000)室温避光孵育5 min,PBS 洗3 次,封闭液封闭,荧光显微镜采集图像。ImageJ软件统计阳性染色细胞数量。
3.7 双萤光素酶报告基因实验 经质粒高纯提取试剂盒提取含NeuroD1 3´UTR 的萤火虫萤光素酶报告载体和海肾萤光素酶报告载体质粒,乙醇纯化,与50 nmol/L NC、miR-92a 或miR-19b 共转染3T3 细胞。细胞转染参照Lipofectamine 2000说明书操作。转染48 h 后,按照双萤光素酶报告基因检测试剂盒说明书操作,裂解细胞,测定裂解液萤火虫萤光素酶和海肾萤光素酶的活性,并计算比值。
4 统计学处理
用GraphPad Prism 7 软件进行统计学处理。数据采用均数±标准误(mean±SEM)表示。两组间比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
结 果
1 MIN6 细胞中内源miR-92a 和miR-19b 的表达水平
复苏胰腺祖细胞和MIN6 细胞,传代培养3 代后用于实验。光镜下观察到典型的上皮细胞样形态,见图1。

Figure 1.Light microscopic observation of the pancreatic progenitor cells and MIN6 cells.The scale bar=100 μm.图1 胰腺祖细胞和MIN6细胞光镜图
提取细胞RNA,通过qPCR 检测内源miR-92a 和miR-19b 表达。与胰腺祖细胞相比,MIN6 细胞中内源miR-92a和miR-19b表达水平显著降低(P<0.01),见图2。这说明miR-92a和miR-19b在胰岛细胞中低表达。
2 miR-92a和miR-19b在MIN6细胞的过表达
将NC、miR-92a 和miR-19b 分别转染MIN6 细胞48 h后,提取RNA,通过qPCR检测miRNAs过表达情况。与NC 组相比,miR-92a和miR-19b在MIN6细胞的表达量显著升高(P<0.01),见图3。这表明miR-92a和miR-19b在MIN6细胞中被成功过表达。
3 miR-92a和miR-19b对MIN6细胞活力的影响
MIN6 细胞转染48 h 后,倒置显微镜采集细胞图像并通过CCK8 法检测细胞活力。与NC 组相比,转染miR-92a 和miR-19b 的MIN6 细胞形态和活力无显著差异(P>0.05),见图4。
4 miR-92a和miR-19b对胰岛素表达的影响
将NC、miR-92a 和miR-19b 转染MIN6 细胞48 h和72 h 后,通过qPCR、Western blot 和免疫荧光检测胰岛素的表达。qPCR 检测显示,与对照组相比,miR-92a和miR-19b显著抑制Ins1和Ins2的mRNA表达(P<0.01),见图5。Western blot 和免疫荧光检测结果显示,miR-92a 和miR-19b 抑制insulin 蛋白表达(P<0.01),见图6。
5 miR-92a 和miR-19b 对NeuroD1 基因表达的影响
为分析miR-92a 和miR-19b 可能通过调控哪些基因而影响胰岛素表达,我们通过生物信息学预测NeuroD1是miR-92a 和miR-19b 的靶基因,又通过双萤光素酶报告基因实验和Western blot,检测到miR-19b 显著抑制NeuroD1 3´UTR 萤光素酶活性和NeuroD1 蛋白表达(P<0.01),而miR-92a 对NeuroD1 3´UTR 萤光素酶活性和NeuroD1 蛋白表达仅起到微调作用,与NC 组相比抑制作用无显著差异(P>0.05),见图7。
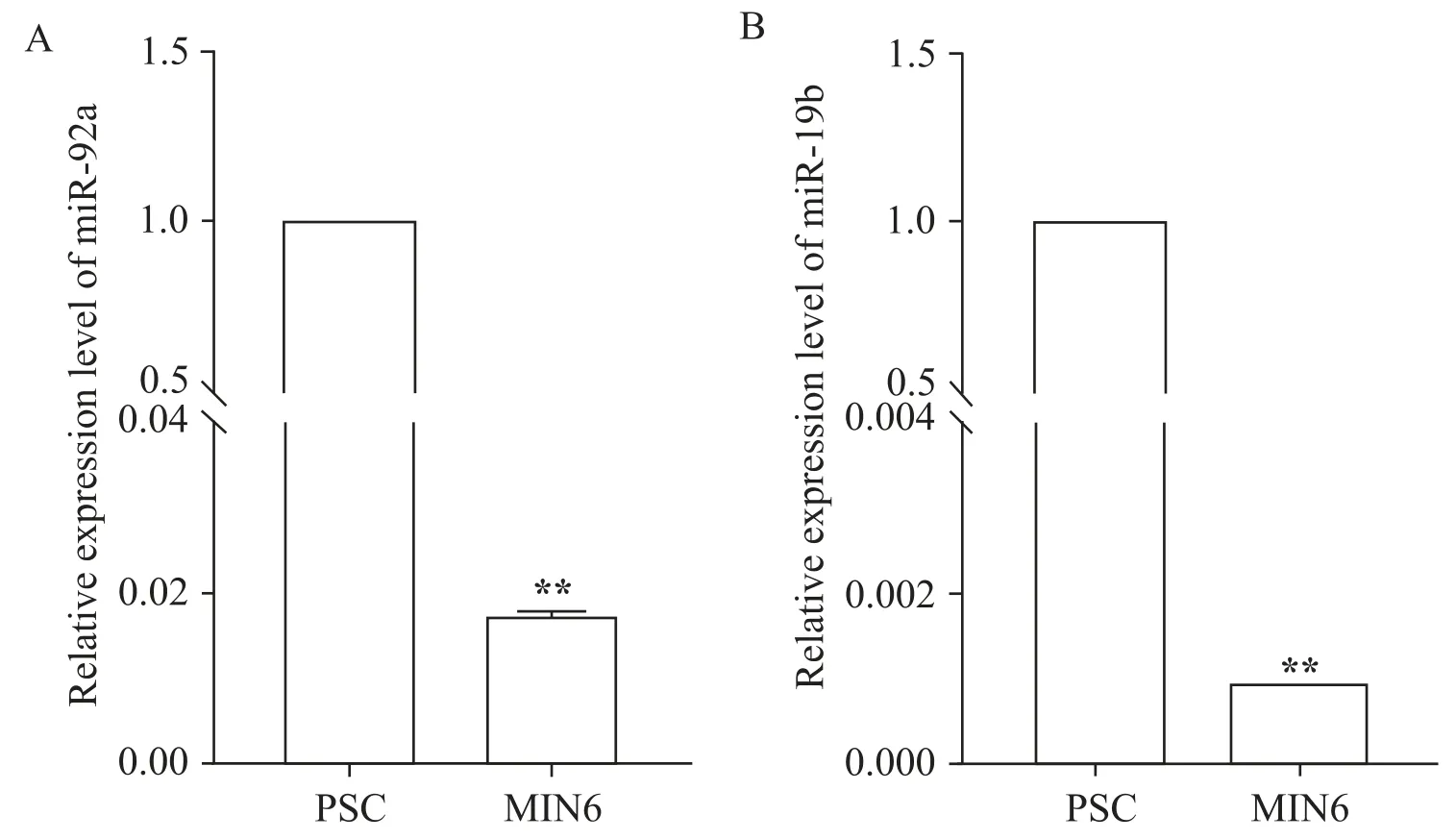
Figure 2.The expression levels of endogenous miR-92a(A)and miR-19b(B)in MIN6 cells and pancreatic progenitor cells(PSC)were detected by qPCR.Mean±SEM. n=3.**P<0.01 vs PSC.图2 内源性miR-92a和miR-19b在MIN6细胞中的相对表达水平

Figure 3.Overexpression of miR-92a and miR-19b in MIN6 cells.A:the expression of miR-92a in the MIN6 cells was detected by qPCR after transfection for 48 h;B:the mRNA expression of miR-19b in the MIN6 cells was detected by qPCR after trans⁃fection for 48 h.Mean±SEM. n=3.**P<0.01 vs NC group.图3 miR-92a和miR-19b在MIN6细胞中的过表达
讨 论
正常胰岛β 细胞功能的维持受一系列基因、非编码RNA 及细胞内信号通路的精确调控[14-15]。小鼠成熟β细胞特异性敲除Dicer后,β细胞面积降低,胰岛素分泌减少,胰岛功能丧失,小鼠呈现糖尿病症状[16-17]。miRNAs 在胰腺β 细胞增殖、发育、胰岛素合成、分泌及糖尿病并发症的发生发展过程中发挥重要作用,如miR-375、miR-26a、miR-124a 等[18-20]。为了探究miR-19b 和miR-92a 在胰岛β 细胞中的功能,本文首先分析了胰岛细胞中内源性miR-19b 和miR-92a 的表达情况。成体胰腺主要由成熟胰腺内分泌细胞、外分泌细胞、导管细胞和少量成体胰腺祖细胞构成。成体胰腺祖细胞具有分化为成熟胰腺细胞的潜能[12]。为分析终末分化细胞中基因相对表达量,我们以基因在成体胰腺祖细胞中的相对表达量为参考,检测结果显示,正常胰岛细胞中内源性miR-19b和miR-92a 相对表达水平低;通过转染外源miR-19b和miR-92a,使其在MIN6 细胞中过表达,结果表明miR-19b 和miR-92a 过表达对MIN6 细胞的活力没有影响,但能抑制胰岛素基因表达,解释了胰岛细胞内源性miR-19b和miR-92a表达水平较低的原因。

Figure 4.The effect of miR-92a and miR-19b on the morphological changes and viability of MIN6 cells.A:the images of the MIN6 cells under inverted optical microscope after transfection for 48 h(scale bar=100 μm);B:the effect of miR-92a and miR-19b on the viability of the MIN6 cells after transfection for 48 h was measured by CCK8 assay.Mean±SEM. n=3.图4 miR-92a和miR-19b对MIN6细胞形态和活力的影响

Figure 5.The effects of miR-92a and miR-19b on the mRNA ex⁃pression levels of Ins1 and Ins2.Mean±SEM. n=3.**P<0.01 vs NC group.图5 miR-92a和miR-19b对胰岛素mRNA表达水平的影响
胰岛素的表达受到胰岛素转录调控因子调控,如胰岛素转录促进因子Pdx1、NeuroD、Ngn3、配对盒蛋白6(paired box 6,Pax6)、NK2 型同源框蛋白2(NK2 homeobox 2,Nkx2.2)、NK6 同源框蛋白1(NK6 homeobox 1,Nkx6.1)等,胰岛素转录抑制因子性别决定区Y 框转录因子6(SRY-box transcription factor 6,Sox6)、Hes 家族bHLH 转录因子1(Hes family bHLH transcription factor 1,Hes1)、INSM 转录抑制因子1(INSM transcriptional repressor 1,In⁃sm1)、Insm2 等,它们相互协调,调控胰岛素表达,维持机体血糖稳态[14]。miRNAs 通过直接或间接调控胰岛素基因、胰岛素转录因子等调控胰岛素表达,如:miR-30a 靶向抑制NeuroD1基因;miR-124a 通过靶向叉头框蛋白A2(forkhead box A2,Foxa2)抑制Pdx1基因,进而抑制胰岛素基因表达;miR-96 靶向沉默Sox6,进而促进β 细胞胰岛素的合成与分泌[4,20-21]。生物信息学预测结果显示,miR-19b 和miR-92a 与Ins1 和Ins2 mRNA 的3′UTR 无直接靶向作用位点,通过筛选,发现NeuroD1可能是miR-92a和miR-19b 的潜在靶基因。NeuroD1 促进胰腺内分泌细胞分化,维持细胞功能特性,是胰岛素基因的关键转录调控因子[22-23]。NeuroD1缺陷小鼠胰腺β细胞大量凋亡,对高糖刺激应答能力降低,表现出糖尿病症状[24]。我们的进一步实验证实,miR-19b 通过直接靶向NeuroD1基因抑制胰岛素基因表达,而miR-92a 可能通过微调NeuroD1或靶向其他功能基因调控胰岛素合成。
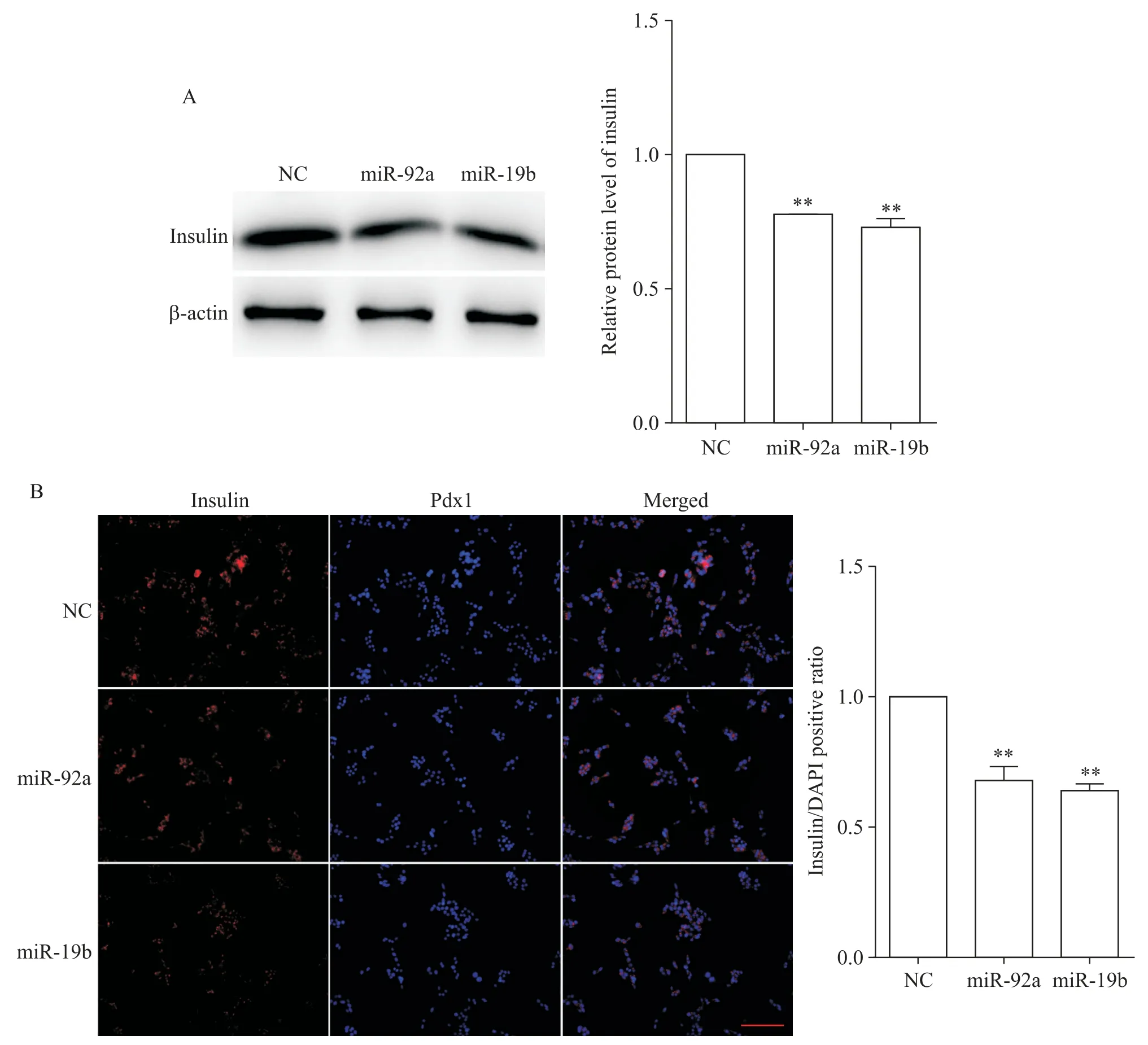
Figure 6.The effects of miR-92a and miR-19b on the protein expression level of insulin.A:the effects of miR-92a and miR-19b on the protein expression level of insulin were detected by Western blot after transfection for 72 h;B:the effects of miR-92a and miR-19b on the protein expression level of insulin were detected by immunofluorescence after transfection for 72 h(scale bar=100 μm).Mean±SEM. n=3.**P<0.01 vs NC group.图6 miR-92a和miR-19b对胰岛素蛋白表达水平的影响
miRNAs 异常表达将导致细胞功能紊乱。文献报道,miR-92a 在2 型糖尿病患者血清中表达升高,且随着病情进展而增高[18];在稳定型冠心病合并糖尿病和慢性稳定性心绞痛合并糖尿病患者外周血清中miR-92a 显著升高[25-26];妊娠糖尿病患者血清miR-19b 和miR-19a 表达水平升高[27],一般在妊娠16~19周降低[28]。已知血液中循环miRNA 可作为疾病诊断和预后评估的良好指标,miR-92a和miR-19b是否能作为糖尿病、肥胖症等代谢疾病诊断和预后评估的指标有待跟踪研究。miRNA 与lncRNA、circRNA、小分子物质、药物等有作用关系,可能是他们调控细胞功能的靶点,例如:黄芪甲苷IV 通过下调miR-23a和miR-92a,激活PI3K/AKT和MAPK/ERK 信号通路,保护心肌细胞免受缺氧损伤。本研究揭示了miR-92a 和miR-19b 对β 细胞胰岛素基因表达的调控,丰富了胰岛β 细胞功能调控机制,为后续筛选调控胰岛细胞功能的药物、机制分析等科研工作奠定了基础。

Figure 7.The effects of miR-92a and miR-19b on the expression of NeuroD1 gene.A:the effects of miR-92a and miR-19b on the lu⁃ciferase activity of NeuroD1 mRNA 3´UTR were detected by dual-luciferase reporter assay;B:the effects of miR-92a and miR-19b on the protein expression of NeuroD1 were detected by Western blot.Mean±SEM. n=3. **P<0.01 vs NC group.图7 miR-92a和miR-19b对NeuroD1基因表达的影响

