组织蛋白酶C和肿瘤坏死因子α在人冠脉组织中的表达及其与冠心病的相关性研究*
张 琼,万昌武,于燕妮,夏 冰,刘江金,张桥军,李 竹,王承飞,戴佳琳,王 杰
(贵州医科大学法医学院,贵州贵阳 550001)
冠状动脉粥样硬化性心脏病(coronary athero⁃sclerotic heart disease,CHD)简称冠心病,是一种受多种复杂因素影响的慢性炎症性疾病,其主要特征是动脉粥样硬化斑块形成,内膜增厚,管腔不同程度狭窄,心肌缺血、缺氧,从而引起心脏结构和功能的紊乱。目前冠心病已成为全球首要的死亡和致残病因[1-2],其病死率高达心血管疾病总死亡率的80%[3],已经严重危害到人类的身心及精神健康。
组织蛋白酶(cathepsin)是在溶酶体中广泛表达的一大类水解蛋白酶,目前已发现20 余种,人类组织蛋白酶共有11 种(组织蛋白酶B、C、F、H、K、L、O、S、V、W 和X)[4],其中,组织蛋白酶C(cathepsin C,CTSC),也称为二肽基肽酶I(dipeptidyl peptidase I,DPPI),属于半胱氨酸类别的组织蛋白酶,主要在髓细胞、细胞毒性T 淋巴细胞、肥大细胞、中性粒细胞和巨噬细胞及其前体细胞等免疫细胞中广泛表达[5-7],其主要的生理功能是通过激活促炎性颗粒相关丝氨酸蛋白酶而促进炎症反应[8]。2015年,Herías等[9]首次提出CTSC 与动脉粥样硬化的关系,在人颈动脉粥样硬化斑块中检测到CTSC 的表达量呈上升趋势。另外,在其小鼠模型中,造血细胞中CTSC 的缺乏可缓解动脉粥样硬化病变的形成进程。同属半胱氨酸家族的组织蛋白酶S、K 和L 等[10-12]在动脉粥样硬化疾病等心血管疾病中的研究已相对比较成熟[13],然而CTSC 在人心血管疾病尤其是在冠心病中的研究目前较为少见。
肿瘤坏死因子α(tumor necrosis factor-α,TNFα)是由活化的单核巨噬胞分泌的一种炎症细胞因子,主要介导人体免疫反应和炎症反应,其血清水平可能反映人动脉粥样硬化斑块的严重程度和稳定性[14]。在刘清霞等[15]的研究中,TNF-α 的阳性表达随斑块不稳定性增加而增强。目前尚未见到关于CTSC 和TNF-α 在冠心病中的相关性研究,因此本研究将检测人冠状动脉组织中CTSC 和TNF-α 的表达,分析两者之间的关系并探讨两者在冠心病中的可能作用,以期为冠心病的预防和治疗提供参考资料。
材料和方法
1 研究对象
收集贵州医科大学法医司法鉴定中心2018 年10 月~2019 年12 月的冠心病死亡案例52 例和无任何心血管疾病的意外死亡案例25 例。严格按照以下纳入标准和排除标准:冠心病组纳入标准:(1)尸体常温保存不超过24 h 或冷冻保存不超过3 d,室温解冻24 h;(2)冠状动脉内膜粥样斑块形成;(3)病理组织学确诊为冠心病的死者;对照组纳入标准:(1)尸体常温保存不超过24 h 或冷冻保存不超过3 d,室温解冻24 h;(2)高坠、交通事故和电击等意外事故造成的死亡;(3)病理组织学检查未发现任何心脏疾病及冠脉狭窄。对照组和冠心病组排除标准:组织自溶、腐败;病理组织学检查显示有高血压性心脏病、肥厚性心肌病等其他心脏疾病死亡案例。本研究所有案例经过贵州医科大学伦理委员会认可(批件号:2018-60-01),并有家属签署知情同意书。
收集的冠状动脉组织均用液氮保存,用冰的PBS 洗净后取斑块最明显且血管内膜最厚的部位将每段冠状动脉组织剪成80~100 g 的若干小段,液氮速冻后立即放入−80℃冰箱保存备用。
2 主要试剂和仪器
CTSC 多克隆抗体(Abcam);TNF-α 多克隆抗体(Immunoway);PV-6000 兔/鼠超敏二步法免疫组织化学检测试剂和DAB 显色试剂盒(中杉金桥公司);鼠抗人β-肌动蛋白(β-actin)单克隆抗体(Abbkine);SDS-PAGE凝胶配制试剂盒(碧云天生物技术)。
3 方法
3.1 冠状动脉组织学形态观察与分析 所收集的冠状动脉组织用4%中性甲醛液固定1 周后进行石蜡包埋、切片(4 μm)并制片,苏木素-伊红(HE)染色后中性树脂封片,用EasyScan 数字切片扫描与应用系统(中国麦克奥迪实业集团有限公司)扫描,并对其进行采图,用Image-Pro Plus 6.0 测量冠状动脉内膜厚度和纤维帽厚度,并计算管腔狭窄程度。
3.2 Western blot 法检测CTSC 和TNF-α 的蛋白表达 −80℃冰箱取出备好的实验样本,加液氮研成粉末匀浆,低温离心机4℃、13 225×g提取蛋白上清液,用紫外分光光度计测量蛋白浓度,10%分离胶和5%浓缩胶进行SDS-PAGE,将蛋白转至PVDF 膜上,5%脱脂牛奶封闭2 h,PBS摇床清洗3次,每次5 min,孵育Ⅰ抗[β-actin 和TNF-α 抗体(1∶2 000),CTSC 抗体(1∶1 000)],4℃冰箱过夜,回收Ⅰ抗,加入辣根过氧化物酶标记的羊抗小鼠IgG(1∶5 000),孵育1 h后经Bio-Rad 凝胶成像系统显色成像,用ImageJ 分析软件测量各条带的灰度值并进行分析。每组数据均为3次独立重复试验结果。
3.3 免疫组织化学染色法检测CTSC 和TNF-α 的表达与细胞定位 4%中性甲醛固定新鲜冠状动脉组织,石蜡包埋并切片(4 μm),60℃烤箱烤片1.5 h,二甲苯脱蜡,梯度乙醇水合后滴加3%过氧化氢封闭抗原,高压修复抗原3 min,孵育Ⅰ抗[CTSC 和TNF-α抗体(1∶100)],滴加PBS 缓冲液作阴性对照,4℃冰箱孵育过夜,室温孵育辣根过氧化物酶标记的羊抗小鼠/兔IgG,滴加DAB 显色液,苏木素复染细胞核,在光学显微镜下观察CTSC 和TNF-α 的阳性表达。阳性染色定位:排除非特异性染色及边缘效应后,光镜下组织以黄色、棕黄色和棕褐色为阳性表达,并观察阳性染色在细胞内的定位和分布特点。400 倍镜下采集图片,Image-Pro Plus 6.0 图像处理软件测量所染组织切片阳性表达的总面积和总吸光度,并根据公式计算平均吸光度。
4 统计学处理
采用SPSS 22.0 软件进行数据统计和分析。计量资料用均数±标准差(mean±SD)表示,两组间比较采用t检验。计数资料用卡方检验。指标间相关性分析采用Pearson 积矩相关系数检验。以P<0.05 为差异有统计学意义。
结 果
1 案例基本资料
本研究收集到因冠心病死亡者52 例,其中男性32 例,女性20 例,年龄32~70 岁,平均年龄(56.9±9.7)岁;因意外事故(如高坠、电击、交通事故等)造成死亡25 例,其中男性15 例,女性10 例,年龄25~59岁,平均年龄(42.3±8.9)岁。
2 冠状动脉组织形态学分析
对照组冠状动脉内膜完整、无增厚,无泡沫细胞堆积,管腔未见狭窄,血管平滑肌细胞排列整齐,中膜未见受压变薄现象;与对照组相比,冠心病组动脉粥样硬化斑块形成,内膜不规则增厚,内膜下可见大量泡沫细胞堆积形成较大的脂质池,纤维帽结构明显,中膜明显受压变薄,血管腔呈不同程度偏心性狭窄,见图1。

Figure 1.Histomorphological changes of the coronary artery tis⁃sues(HE staining,scale bar=300 μm).A:control group;B:CHD group.图1 冠状动脉的组织形态学变化
对两组样本的形态学指标进行测量分析,结果显示,与对照组相比,冠心病组内膜厚度增加,纤维帽变厚,管腔明显狭窄(P<0.05),见表1。

表1 冠状动脉形态学指标的比较Table 1.Comparison of morphological indexes of coronary artery lesion(Mean±SD)
3 冠状动脉组织中CTSC和TNF-α蛋白表达水平
Western blot检测结果显示,与对照组相比,冠心病组中CTSC 和TNF-α 的表达水平均显著升高(P<0.05),见图2。
4 冠状动脉组织中CTSC 和TNF-α 蛋白的细胞定位和吸光度的变化情况
对照组未见CTSC 和TNF-α 阳性表达,冠心病组CTSC 和TNF-α 阳性表达均主要在泡沫细胞胞质中,阳性表达呈棕黄色或棕褐色,见图3。
用Image-Pro Plus 6.0 软件分析检测血管内CTSC 和TNF-α 蛋白表达的平均吸光度,结果显示,与对照组比较,冠心病组CTSC 和TNF-α 阳性表达水平显著增高(P<0.05),见表2。
5 CTSC和TNF-α的相关性分析
用Pearson 积矩相关系数检验法对所测量的CTSC 和TNF-α 的平均吸光度进行相关性分析,结果显示,冠心病组CTSC 和TNF-α 的表达水平呈显著正相关关系(r2=0.743,P<0.05),见图4。
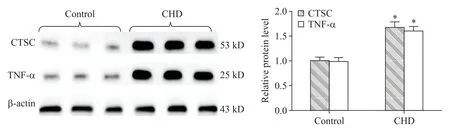
Figure 2.The protein expression levels of CTSC and TNF-α were detected by Western blot.Mean±SD. n=6.*P<0.05 vs control group.图2 CTSC和TNF-α的蛋白表达情况
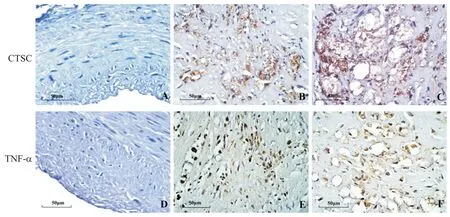
Figure 3.The expression of CTSC and TNF-α in coronary atherosclerotic lesions(immunohistochemical staining,scale bar=50 μm).A,D:control group;B,C,E,F:CHD group.图3 冠状动脉粥样硬化病灶内CTSC和TNF-α的表达

表2 冠状动脉病变中CTSC和TNF-α蛋白表达的平均吸光度Table 2.Mean absorbance of the expression of CTSC and TNF-α proteins in coronary artery lesions(Mean±SD)
讨 论
冠心病是一种发病率和死亡率较高的心血管疾病[16],其主要病理特征是冠状动脉粥样硬化斑块的形成。识别更多的生物标志物,对于了解冠心病的发生发展及诊断治疗具有重要意义。本课题组在前期针对一组冠心病案例的冠状动脉组织进行蛋白质组学定量分析,识别了256 个差异表达蛋白,其中组织蛋白酶家族成员在核心网络中具有关键作用。组织蛋白酶家族多数成员参与了动脉粥样硬化的发生发展[17],但是关于CTSC 与人冠心病冠状动脉粥样硬化的报道较少。CTSC 作为组织蛋白酶家族成员之一也是差异表达蛋白,相较于正常组,其表达量显著升高,提示CTSC 在冠心病的发病机制中可能发挥着一定的作用。CTSC 是一种较保守的四聚体半胱氨酸类蛋白酶,其主要作用是降解细胞内不需要的蛋白质以及激活免疫和炎症细胞内丝氨酸蛋白酶[18]。CTSC 在多种疾病中发挥作用,如常染色体隐性遗传性疾病Papillon-Lefèvre 综合征中CTSC基因位点的突变[19]、神经炎症的反应进程[20]、多种恶性肿瘤细胞的增殖、转移和凋亡等[21]。近年来的研究显示在动脉粥样硬化的血管内存在CTSC 表达异常[9,22],并促进斑块的形成,如在小鼠模型中,CTSC 的缺陷能够减缓动脉粥样硬化的发展进程[22],提示CTSC 可能参与动脉粥样硬化的发生发展过程。但以上研究主要局限于人颈动脉及动物实验,因此本研究进一步检测发生粥样硬化的冠状动脉CTSC 表达水平,结果显示粥样硬化冠状动脉组CTSC 表达显著升高,且CTSC 阳性表达主要分布在泡沫细胞,提示冠状动脉粥样硬化病灶内存在CTSC 表达异常并与泡沫细胞的形成有关,推测CTSC 在冠心病动脉粥样硬化中表达升高可能会影响斑块的形成及其稳定性。一项对神经系统疾病的研究显示,CTSC 通过激活蛋白激酶C/p38-MAPK/NF-κB 信号通路诱导小胶质细胞向M1极化,导致炎症因子释放增加,从而促进神经炎症的发展[20]。Alam 等[23]的一项研究也显示CTSC 在巨噬细胞中的表达上调且可以促进巨噬细胞的M1极化,增加炎症因子的释放,从而增强炎症反应。

Figure 4.Correlation scatter diagram between CTSC and TNFα.The horizontal and vertical axes represent the mean absorbance(MA)of CTSC and TNF-α,respec⁃tively.图4 CTSC和TNF-α的相关性散点图
Zhang 等[24]的一项研究显示,作为CTSC 的下游因子,TNF-α 表达量随CTSC 的增加而增加,即CTSC和TNF-α/MAPK(p38)信号之间可能存在正反馈回路,CTSC 可通过该途径增加肝癌细胞的增殖和迁移。TNF-α 是主要由单核巨噬细胞分泌的一种炎症因子,可介导体内的免疫及炎症反应[25],有研究显示在动脉粥样硬化中,TNF-α 表达上调,尤其在不稳定性斑块组表达上调更明显[14-15],本研究检测粥样硬化冠状动脉TNF-α 水平,同样显示动脉粥样硬化病灶内TNF-α 水平高于对照组。另外,我们通过分析显示CTSC 和TNF-α 之间存在显著正相关关系,TNF-α能刺激炎症因子的生成,直接发挥促炎作用[26],其在动脉粥样硬化病灶内的高表达可能刺激炎症细胞产生炎症介质,导致坏死灶扩大,斑块结构破坏等,从而影响斑块的稳定性,甚至导致急性心血管事件的发生。我们推测TNF-α 可能激活CTSC 表达,而CTSC 表达上调可通过激活蛋白激酶C/p38 MAPK/NF-κB 信号通路诱导促进巨噬细胞M1 极化[20],增加炎症因子的释放,增强炎症反应,导致冠心病动脉粥样硬化的发生。
综上所述,CTSC 和TNF-α 在粥样硬化冠状血管组织中的高表达提示CTSC 和TNF-α 两者的协同作用可能促进粥样硬化病灶内的炎症反应,并与粥样硬化病灶的稳定性下降有关。本研究直接检测人体冠脉组织CTSC 和TNF-α 水平,弥补了动物实验与人类种属差异性的缺陷,但作为一项横断面研究,未探讨其内在作用机制,因此关于粥样硬化病灶内CTSC作用的病理生理机制有待下一步更深入的研究。

