室旁核miR-9-5p通过靶向KCNN3介导T2D大鼠交感神经过度兴奋*
徐佳琪,安美玲,袁 月,郝翊帆,王秀文,张 敏,未晓巍,2,李 华,王仁俊△
(吉林师范大学 1生命科学学院,2植物资源科学与绿色生产吉林省重点实验室,吉林四平 136000)
糖尿病(diabetes mellitus,DM)能够引发多种系统病变,造成极高的致残率和致死率。截止到2013年,我国成人糖尿病患病率已经达到10.4%,预计到2045 年,全球18~99 岁的糖尿病患者将增长至6.93亿[1-2],可见,糖尿病的防控工作迫在眉睫。近年来,关于糖尿病的研究工作大多围绕糖脂代谢通路展开,而在中枢调控机制方面的探索研究则十分匮乏。交感神经过度激活参与多种疾病的发生发展,加速了慢性心衰[3-5]和2 型糖尿病(type 2 diabetes melli⁃tus,T2D)[6-7]的恶化。据报道,γ-氨基丁酸(γ-aminobutyricacid,GABA)[8]和神经型一氧化氮合酶(neuro⁃nal nitric oxide synthase,nNOS)[9]等介导糖尿病状态下对室旁核(paraventricular nucleus,PVN)神经元兴奋性的调节。糖尿病状态下,大鼠PVN 神经元膜功能是否改变及引起膜功能发生变化的相关机制仍不明确。
细胞膜上的小电导钙激活钾通道(small-conduc⁃tance calcium-activated potassium channels,SK chan⁃nels)介导动作电位后超极化的发生,按不同亚基的结构和功能分为SK1~4共4种类型,相应的编码基因为KCNN1(potassium intermediate/small conductance calcium-activated channel,subfamily N,member 1)、KCNN2、KCNN3及KCNN4。研究发现,PVN 和视上核(supraoptic nucleus,SON)内SK3 高丰度表达[10];PVN 内SK 通道参与调控大鼠交感神经活性[11-12]。目前未有研究报道PVN 内SK 通道是否参与糖尿病的发生发展。
近期研究显示,微小RNA(microRNA,miRNA,miR)参与T2D中胰岛素信号转导和血糖水平的调节等过程,T2D 患者外周血中多种miRNA 的表达水平随疾病发展而改变[13],但miRNA 是否参与T2D 的中枢发病机制还未见研究报道。本课题组利用Tar⁃getScan 生物信息学软件预测miR-9-5p 与KCNN3 mRNA 的3´UTR 具有结合位点。miRNA 表达谱分析显示大鼠PVN 内miR-9 表达颇丰[14],且T2D 患者血浆miR-9 表达显著上调[13]。然而,T2D 大鼠PVN 内miR-9是否同样存在差异表达,进一步失衡的miR-9-5p 能否影响SK3 蛋白水平,并引发交感神经兴奋亢进和血糖调节紊乱,仍不明确。故本实验以T2D 大鼠为研究对象,观察PVN 内miR-9-5p 和SK3 表达水平,并进一步阐明二者参与T2D 大鼠中枢交感神经活动的调控机制。
材料和方法
1 动物
Wistar 大鼠,雄性,180~220 g,由长春市亿斯实验动物技术有限责任公司提供,许可证号为SCXK(吉)2011-0004。置于恒温(23±2)℃,12 h/12 h 明暗周期的环境中喂养。
2 仪器及试剂
miR-9-5p和KCNN3基因过表达和敲减腺相关病毒均由上海汉恒生物科技有限公司构建和包装;血浆甘油三酯ELISA试剂盒(Abcam);瘦素及去甲肾上腺素(norepinephrine,NE)ELISA 试剂盒(IBL);胰岛素(insulin)ELISA 试剂盒(北京索莱宝);Trizol 试剂盒(北京鼎国)。血糖仪(Invitrogen);脑立体定位仪(Narishige,SR-5M-HT)等。
3 主要方法
3.1 构建T2D 大鼠模型 将大鼠随机分为2 组,2型糖尿病模型(DM)组给予高脂饮食(high-fat diet,HFD),4周后腹腔注射低剂量(30 mg/kg)链脲佐菌素(streptozotocin,STZ),诱导其产生高血糖症状,予以HFD 继续饲养8 周;糖尿病对照(diabetes control,DC)组始终饲以正常饮食。喂养期间对大鼠体重及食物摄入量进行监测。
3.2 血浆葡萄糖和胰岛素水平的检测 对待测大鼠禁食12 h,将断尾法获取的血液置于含EDTA 的EP 管中,用血糖仪快速检测大鼠空腹血糖浓度,空腹胰岛素水平则按照ELISA 试剂盒说明进行测定。采血完毕进行糖耐量实验,按2 g/kg体重给予大鼠口服葡萄糖,给药2 h后按相同方法检测上述两种指标水平。计算胰岛素抵抗指数:胰岛素抵抗指数=空腹血糖×空腹血胰岛素/22.5。
3.3 PVN 微量注射 STZ 注射8周后,通过脑立体定位仪将麻醉大鼠头部固定,参照Paxinos&Watson大鼠脑图谱定位下丘脑PVN(前囟向后1.8 mm,旁开0.5 mm,深7.2 mm),使用牙科钻钻开颅骨,将连接微量注射器的导管以1 mm/min 的速度插入PVN内,按每30 s 0.2 μL 的速度连续推注5 min,每侧导管内共装有2 μL 的rAAV2/9-hSyn-EGFP-miR-9-5p(1.5×1013vg/L),和/或rAAV2/9-hSyn-EGFP-sponge(miR-9-5p)(1.5×1013vg/L),或rAAV2/9-hSyn-EGFP-(NC miR-9-5p)(1.5×1013vg/L),或rAAV2/9-hSyn-EGFP-(NC sponge-miR-9-5p)(1.5×1013vg/L),和/或rAAV2/9-hSyn-EGFP-KCNN3 shRNA (siKCNN3)(1.5×1013vg/L),或 rAAV2/9-hSyn-EGFP-KCNN3 shRNA(NC siKCNN3)(1.5×1013vg/L),和/或2.5 μL的 rAAV2/9-hSyn-siKCNN3-P2A-EGFP (9×109vg/side),或rAAV2/9-hSyn-(NC siKCNN3)-P2A-EGFP(9×109vg/side),注射结束后留针10 min,避免病毒随导管抽离流出,抽离速度同样按1 mm/min进行,注射完毕封闭钻孔,缝合皮肤,注射抗生素避免感染。需要对同1只大鼠PVN内注射2种重组腺相关病毒时,两次输注间隔2 h 进行。病毒注射4 周后检测各干预组结果。
3.4 尿NE 排出量的测量 STZ 干预8 周后,将全部大鼠分别置于代谢笼内,24 h后收集排出的尿液,装入含有矿物油的收集管中防止蒸发,尿液离心后,将上清液转移到含有HCl 的离心管中,置于−80℃条件下储存。使用NE ELISA 检测试剂盒测定解冻后尿液内NE浓度。尿NE排出量=尿NE浓度×尿流量。
3.5 交感驱动指标的检测 实验前各组大鼠需禁食12 h,腹腔注射α-氯醛糖(70 mg/kg)和乌拉坦(0.75 g/kg)进行麻醉,仰卧位固定,分离出股动脉进行插管,连接压力换能器,再将麻醉大鼠俯卧于手术台上,固定后分离其肾交感神经,经多道生理记录仪同步获取大鼠标Ⅱ导联心电图、平均动脉压(mean arterial pressure,MAP)和肾交感神经放电(renal sympathetic nerve discharge,RSND)活动。
3.6 血液采集及生化指标检测 暴露麻醉大鼠心脏,于右心耳处剪一小口,迅速采集血液,将收集到的血液装入离心管内,室温静置30 min 后,3 000 r/min 离心15 min,留取血清样本,将样本分装并保存于−80℃条件下待测,避免反复冻融。血浆甘油三酯、NE 及瘦素水平均通过ELISA 法进行测定,操作流程严格遵照ELISA试剂盒说明书进行。
3.7 PVN 组织的提取 对含PVN 组织的连续6 张脑片进行取样,每侧PVN 打孔6 次,即每张切片取样12次,得到PVN组织准备待测。
3.8 免疫荧光检测目标蛋白的表达 取血完毕在大鼠心尖处入针,插入左心室,先后使用肝素盐水(约250 mL)和4%多聚甲醛(约250 mL)对大鼠进行灌流,观察大鼠尾部及四肢僵硬程度,判断灌流是否成功。灌流完毕取出大脑,置于装有4%多聚甲醛的15 mL 离心管内,4℃条件下固定4 h,然后将大脑依次转移到含20%和30%的蔗糖溶液中梯度脱水,待沉降后取出,用吸水纸小心吸干大脑表面水分,经包埋剂包埋,置于−80℃冰箱冷冻。使用冰冻切片机切片,得到厚度为35 μm 的切片,收集含有PVN 组织的冠状切片,确定PVN 区域及注射位点。将得到的脑切片在PBS 溶液中展开,挑取带有PVN 组织的切片置于含PBS 的24 孔板中,洗片后转移到含封闭液(PBS+10%羊血清)的EP 管内,37℃封闭1.5 h;冲洗切片,加入I抗,置于37℃培养箱孵育2 h;取出切片,冲洗后避光孵育荧光II 抗,此后操作均在暗环境下进行,同样在37℃条件下孵育2 h。取出的脑片采用PBS 溶液清洗,冲洗3 次,每次5 min,冲洗后贴片,封片完毕用锡纸包裹,准备转移至荧光显微镜下检测目标蛋白的表达。
3.9 real-time PCR 检 测miR-9-5p 和KCNN3 mRNA的表达水平 Trizol 法对待测组织内总RNA 进行抽提,逆转录得到cDNA,以U6 和GAPDH 分别作为miR-9-5p 和KCNN3 的内参照进行real-time PCR,引物序列见表1。检测miR-9-5p 的扩增条件为:95℃预变性5 min;95℃变性12 s,62℃退火40 s,40 个循环。检测KCNN3 mRNA 的扩增条件为:94℃预变性4 min;94℃变性15 s,58℃退火30 s,72℃延伸30 s,40个循环。
3.10 TargetScan 软件预测KCNN3 mRNA 与miR-9-5p 的相互作用 通过TargetScan 生物信息学软件预测可能影响KCNN3 mRNA 转录后翻译的miRNA,分析KCNN3 mRNA与miR-9-5p是否具有靶标关系。
3.11 原代培养乳鼠下丘脑神经细胞和NG108 细胞 培养过程在无菌条件下进行,从新生Wistar 鼠(24 h 内)下丘脑分离出神经细胞,采用MEM 培养液进行体外原代培养。将NG108细胞接种到含10%胎牛血清的高糖DMEM 培养基中,培养基内补充有HAT(hypoxanthine-aminopterin-thymidine;1%)、链霉素(100 mg/L)及青霉素(1×105U/L),接种后置于含5% CO2的培养箱中,保证箱内气体环境湿润,在37℃条件下培养。当细胞融合率大于85%时加入胰酶传代。
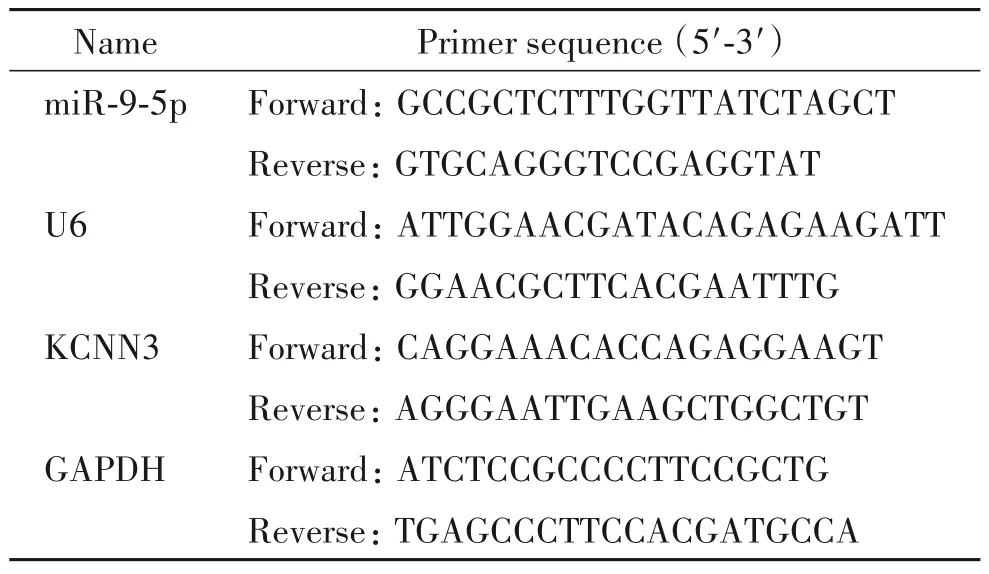
表1 用于real-time PCR的引物序列Table 1.The sequences of the primers used for real-time PCR
3.12 细胞转染miR-9-5p 将待转染的原代神经细胞和NG108 细胞分别置于6 孔板培养,并随机分组,包括空白对照组、miR-9-5p 转染组、miR-9-5p+antimiR-9-5p转染组和NC miR-9-5p阴性对照组,在细胞融合率达70%时,使用agomiR-9-5p(50 nmol),和/或antagomiR-9-5p(100 nmol),或NC agomiR-9-5p(50 nmol)对NG108 细胞进行转染,继续培养72 h 后,检测各转染组SK3蛋白的表达水平。
3.13 Western blot 检测SK3 的蛋白水平 将蛋白提取缓冲液分别与PVN 组织、原代神经细胞和NG108细胞混合,超声破碎后置于离心机内,离心8 min(4℃、12 000 r/min),取上清。BCA 法确定总蛋白浓度。调整合适蛋白浓度,加入等量的2×4%SDS样品缓冲液。将蛋白样本注入SDS-PAGE 凝胶中进行电泳。电泳结束后,获取胶板上的目的蛋白,采用“三明治法”将其转移到PVDF 膜上,5%脱脂奶粉封闭,4℃过夜。加入I抗4℃孵育过夜,经TBS洗涤3次,每次10 min 后,于暗室中使用荧光素标记的Ⅱ抗进行孵育,1 h 后洗膜TBS 洗涤(3 次,每次10 min),最后对膜进行扫描拍照和分析。蛋白表达量通过目标蛋白强度与GAPDH强度的比值来计算、统计及分析。
3.14 双萤光素酶报告基因实验 用real-time PCR扩增miR-9-5p 与KCNN3 序列上的结合片段,将该片段插入到pMIR-REPORT 萤光素酶载体中,构建KCNN3 野生质粒;用KCNN3 野生质粒,分别与agomiR-9-5p,和/或antagomiR-9-5p,或NC agomiR-9-5p 共转染HEK293 细胞。48 h 后,根据Dual-Luci⁃ferase®报告基因试剂盒说明书检测各组萤光素酶活性,验证miR-9-5p与KCNN3 mRNA的靶向关系。
4 统计学处理
采用SPSS 20.0软件对所得数据进行统计分析。数据以均数±标准误(mean±SEM)的形式表示。两组间均数比较采用独立样本t检验;多组间均数比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05表明差异有统计学意义。
结 果
1 T2D大鼠模型的鉴定
将HFD 联合STZ 诱导12 周的DM 组大鼠生理指标与DC组大鼠进行比较。与DC组相比,DM 大鼠的体重、腹膜后脂肪垫和肾脏重量均显著增加(P<0.05);棕色脂肪组织含量明显降低(P<0.05)。DM大鼠血浆甘油三酯、瘦素及空腹血糖水平明显上调(P<0.05),并出现糖耐量异常,DM 大鼠胰岛素敏感性指数有所降低,但差异无统计学显著性(P>0.05)。DM 大鼠的RSND 和尿NE 水平显著增加(P<0.05),见表2。以上结果表明DM 大鼠表现出高血糖、高血脂症、胰岛素抵抗和交感神经活动亢进状态,证明T2D模型构建成功。
2 TargetScan 软件预测miR-9-5p 与KCNN3 存在靶向调节关系
TargetScan 软件预测KCNN3 mRNA 的3´UTR 上存在两段miR-9-5p 的靶序列,具有多个碱基互补位点,表明miR-9-5p 可能参与调控KCNN3 mRNA 的转录后翻译,且在人类、大鼠和小鼠间高度保守,见表3。
3 Real-time PCR结果
与DC 组相比,DM 大鼠PVN 内miR-9-5p 的表达水平显著上调(P<0.05),见图1A,而KCNN3 mRNA水平的差异无统计学显著性(P>0.05),见图1B。
4 PVN 内微量注射miR-9-5p、anti-miR-9-5p、NC miR-9-5p 和NC anti-miR-9-5p 对2 型糖尿病大鼠交感驱动指标和空腹血糖的影响
微量注射rAAV-miR-9-5p 至DC 和DM 大鼠PVN内,导致RSND、NE 及血糖水平明显增加(P<0.05);微量注射anti-miR-9-5p 则得到完全相反的结果,使交感活动受到抑制,下调NE 及血糖水平(P<0.05),见图2。与DC 组相比,DM 组大鼠对病毒干预的反应更为强烈,呈现出增敏状态,提示miR-9-5p水平升高可能参与T2D发病过程。
5 PVN 内微量注射KCNN3、siKCNN3、NC KCNN3和NC siKCNN3 对2 型糖尿病大鼠交感驱动指标和空腹血糖的影响
微注射rAAV-KCNN3 至DC 和DM 大鼠PVN 内,可以显著抑制交感活动、降低大鼠血糖水平(P<0.05);rAAV 敲减PVN 内KCNN3则会引起交感激活及血糖增高(P<0.05),见图3。与DC组相比,DM 大鼠对微量注射的反应更为敏感,提示KCNN3 水平上调有助于改善T2D的血糖和交感神经兴奋状态。

表2 DM组与DC组大鼠解剖学和交感驱动生理学指标的检测结果Table 2.The indexes of anatomy and sympathetic drive in the DM and DC rats(Mean±SEM)

表3 miR-9-5p与KCNN3 mRNA 3´UTR的互补序列Table 3.The complementary sequences between miR-9-5p and the 3´UTR of KCNN3 mRNA

Figure 1.Up-regulated miR-9-5p inhibited KCNN3 expression in PVN of the rats with T2D.A:relative expression of miR-9-5p in PVN of DC and DM rats;B:the mRNA expression of KCNN3 in PVN of DC and DM rats;C:the protein expression of SK3 in PVN and SON of DC and DM rats;D:verification of interaction between miR-9-5p and the 3´-UTR of rat KCNN3 gene in HEK293 cells was determined by luciferase reporter assay.Mean±SEM. n=6.*P<0.05 vs DC group;†P<0.05 vs null group.图1 T2D大鼠PVN中上调的miR-9-5p抑制KCNN3表达
6 免疫荧光检测FosB和SK3阳性神经元的数量
微量注射miR-9-5p 至DC 组和DM 组大鼠PVN内,导致FosB 阳性神经元数量显著增加(P<0.05),见图4A、C;SK3 阳性神经元数量明显减少(P<0.05),见图4B、D;与DC组相比,miR-9-5p干预诱发DM 大鼠PVN 内FosB 和SK3 阳性神经元数量变化的幅度更大,见图4。
7 Western blot检测SK3蛋白的表达水平
与DC 组相比,DM 组大鼠PVN 内SK3 蛋白的表达量显著下调(P<0.05),然而SON 内未见SK3 的差异表达(P>0.05),见图1C。细胞转染实验结果表明,转染miR-9-5p 至原代神经细胞或NG108 细胞均能够显著抑制细胞内SK3 蛋白的表达(P<0.05);加入anti-miR-9-5p 后能够有效解除miR-9-5p 对KCNN3 mRNA 表达的阻遏,提升SK3 蛋白水平,NC miR-9-5p 孵育对SK3 蛋白表达无显著影响(P>0.05),见图5。
8 萤光素酶报告基因实验验证miR-9-5p 和KCNN3的靶向关系
miR-9-5p 显著降低KCNN3 mRNA 3´UTR 的萤光素酶活性(P<0.05),见图1D。结果显示miR-9-5p靶向调控KCNN3的mRNA表达。
9 注射位点的鉴定
本文仅展示DM 和DC 大鼠PVN 注射miR-9-5p及KCNN3 mRNA 的位点鉴定结果。切片的组织学数据显示,切片内共有56 次注射,其中48 次注射到PVN 内,8 次偏离PVN,见图6。注射偏离所得实验结果作为解剖学阴性对照。
讨 论
本研究在体实验研究发现,T2D 大鼠PVN 内miR-9-5p 的表达显著上调、SK3 蛋白表达水平显著下调;PVN 内过表达miR-9-5p 明显下调SK3 的蛋白水平、增加FosB 阳性神经元数量,引起交感神经兴奋性亢进,升高血糖水平;PVN 过表达KCNN3 或转染anti-miR-9-5p 均能有效抑制交感兴奋并降低血糖水平,DM 组对干预的反应强于DC 组。本研究离体实验研究发现:在原代脑神经细胞或NG108 细胞转染miR-9-5p 可显著抑制SK3 蛋白的表达,转染antimiR-9-5p 可有效降低miR-9-5p 对SK3 蛋白表达的抑制作用。结果提示miR-9-5p 很可能通过抑制KCNN3 mRNA 的转录后翻译,进一步下调PVN 内SK3 蛋白水平,最终导致T2D 大鼠交感神经过度激活和血糖水平升高。本研究为糖尿病的防治工作提供了新的靶点和新策略。

Figure 2.The effects of microinjection of miR-9-5p,anti-miR-9-5p,NC miR-9-5p and NC anti-miR-9-5p in PVN of rats with T2D on the sympathetic drive indexes and fasting plasma glucose.A:mean arterial pressure(MAP);B:heart rate(HR);C:re⁃nal sympathetic nerve diacharge(RSND);D:plasma norepinephrine(NE);E:original tracings of MAP and RSND;F:fasting plasma glucose.Mean±SEM. n=6.*P<0.05 vs null group;†P<0.05 vs miR-9-5p group;‡P<0.05 vs miR-9-5p+antimiR-9-5p group;#P<0.05 vs DC+null group.图2 PVN 内微量注射miR-9-5p、anti-miR-9-5p、NC miR-9-5p 和NC anti-miR-9-5p 对2 型糖尿病大鼠交感驱动指标和空腹血糖的影响

Figure 3.The effects of microinjection of KCNN3,siKCNN3,NC KCNN3 and NC siKCNN3 in PVN in rats with T2D on the sympathetic drive indexes and fasting plasma glucose.A:mean arterial pressure(MAP);B:heart rate(HR);C:renal sympathetic nerve diacharge(RSND);D:plasma norepinephrine(NE);E:original tracings of MAP and RSND;F:fasting plasma glucose.Mean±SEM. n=6.*P<0.05 vs null group;†P<0.05 vs KCNN3 group;‡P<0.05 vs KCNN3+siKCNN3 group;#P<0.05 vs DC+null group.图3 PVN内微量注射KCNN3、siKCNN3、NC KCNN3和NC siKCNN3对2型糖尿病大鼠交感驱动指标和空腹血糖的影响

Figure 4.Effects of microinjection of miR-9-5p,anti-miR-9-5p,NC miR-9-5p and NC anti-miR-9-5p on the number of FosB and SK3 positive cells in PVN in rats with T2D.A:the number of FosB positive cells in the PVN;B:the number of SK3 posi⁃tive cells in the PVN;C:the immunofluorescence photomicrographs from the sections of the PVN region stained for FosB in DC and DM rats;D:the immunofluorescence photomicrographs from the sections of the PVN region stained for SK3 in DC and DM rats.The scale bar=50 μm.Mean±SEM. n=6.*P<0.05 vs null group;†P<0.05 vs miR-9-5p group;‡P<0.05 vs miR-9-5p+anti-miR-9-5p group;#P<0.05 vs DC+null group.图4 微量注射miR-9-5p、anti-miR-9-5p、NC miR-9-5p和NC anti-miR-9-5p对2型糖尿病大鼠PVN 内FosB 及SK3阳性神经元数量的影响
近年来,大量研究发现机体内miRNA 水平的改变是影响糖尿病发生发展的重要因素[15]。然而,就中枢miRNA 参与心血管疾病自主神经调控的相关探索十分匮乏,即心衰大鼠PVN 内miR-133a 下调会使血管紧张素原和血管紧张素II 型1 型受体表达增加,引起交感兴奋[16];我们前期研究发现慢性心衰大鼠PVN 内miR-7b 抑制PVN 内GABBR1 表达,从而促使交感过度激活[17]。值得注意的是,近期有研究表明T2D患者外周血浆miR-9水平升高,本研究观察到的PVN内升高的miR-9-5p是内源性的还是由外周血穿过血脑屏障引起的还未可知。由此,升高的miR-9-5p 的来源还有待进一步研究。另外,本实验模型表现出高血脂症、β细胞功能损害及胰岛素抵抗等特征,将来可以将检测miR-9-5p 水平对几种特征的直接影响作为研究目的,探索miR-9-5p 水平失衡与T2D发病机制间的更多关联。
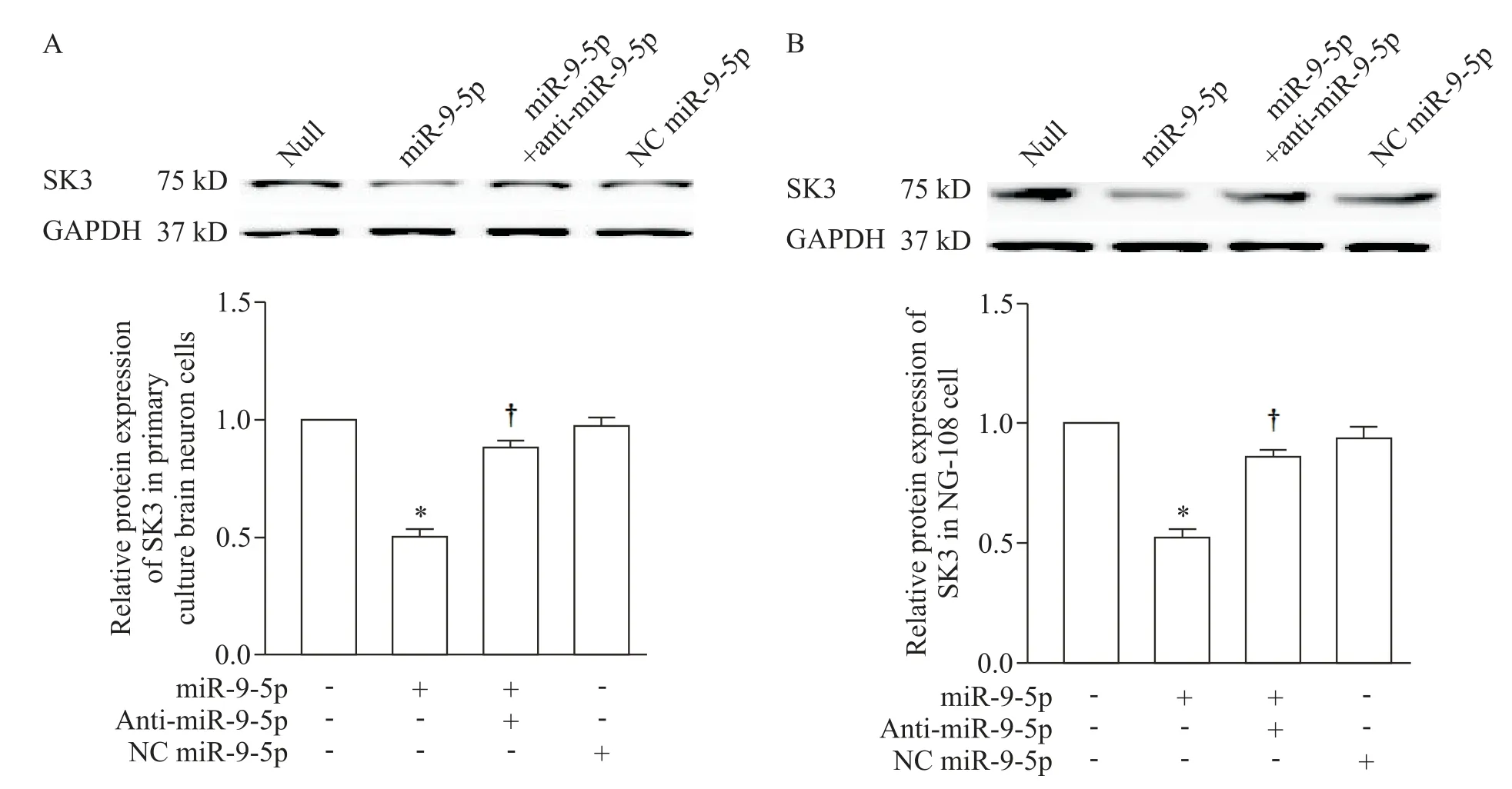
Figure 5.The effect of miR-9-5p,anti-miR-9-5p and NC miR-9-5p on the protein expression of SK3 in primarily cultured neonatal rat hypothalamus neurons and NG108 cells.A:the protein expression of SK3 in the primarily cultured neonatal rat hypothala⁃mus neurons;B:the protein expression of SK3 in the NG108 cells.Mean±SEM. n=6. *P<0.05 vs null group;†P<0.05 vs miR-9-5p group.图5 miR-9-5p转染对原代培养新生大鼠下丘脑神经细胞和NG108细胞内SK3蛋白表达量的影响

Figure 6.Schematic drawings of rat hypothalamus PVN in coronal section.The distance(in mm)posterior to bregma is shown for each section.“●”represent the sites of termination of an injection that is within the PVN region in DC group;“+”repre⁃sent that in DM group.3V:the third cerebral ventricle;AHP:anterior hypothalamic area,posterior part;AHC:anterior hypothalamic area,central part.图6 大鼠下丘脑PVN微量注射位点鉴定示意图
交感神经兴奋亢进是T2D 患者的一项重要病理特征,PVN 是下丘脑内控制交感传出的关键核团,免疫荧光检测结果显示,DM 组大鼠PVN 内FosB 阳性神经元数量较DC 组明显增加,表明中枢神经被慢性激活[18]。微量注射miR-9-5p到PVN显著上调两组大鼠的FosB 水平,引起血浆NE 和RSND 升高,提示miR-9-5p 过表达可促进中枢交感神经系统慢性激活。SK 通道作为调控交感神经活动的重要功能蛋白在PVN 和SON 内高度表达,本研究结果显示DM大鼠PVN 内SK3 水平显著低于DC 组,提示PVN 内SK3 表达下调可能在T2D 大鼠交感激活中发挥作用。在体实验和离体实验均表明过表达或敲减miR-9-5p分别降低或增加SK3 蛋白水平,同时改变大鼠交感神经兴奋状态,证实PVN 内miR-9-5p 与糖尿病的发生发展关系密切。另有研究表明,部分miRNA在T2D 和运动训练后的表达图谱相反,例如具有抗炎作用的miR-192 和miR-24 等[13],表明运动的抗炎特性可能对T2D 患者有益,而运动训练是否能够调节miR-9-5p 水平,能否对miR-9-5p 的中枢作用产生影响,这将是我们后续的研究课题。
综上所述,我们的研究发现HFD 联合STZ 诱导T2D 大鼠PVN 内miR-9-5p 和SK3 蛋白表达失衡可诱发交感神经过度激活和血糖水平升高,这种作用可能与miR-9-5p 通过抑制KCNN3 mRNA 的转录后翻译,进一步下调PVN 内SK3 蛋白水平有关。本研究为糖尿病的防控和治疗提供了全新的干预靶点、途径和策略。

