低体温脓毒症小鼠模型建立及体温变化在急性感染中的意义
李艳萍,黄坤,吕宇飞,黄竞,于久飞
1.民航总医院(北京大学民航临床医学院)消化肿瘤科,北京 100123;2.军事医学研究院 生物工程研究所,北京 100071
脓毒症是临床常见症状,主要是由感染引起的机体反应失调,最终导致器官功能障碍,常发展为脓毒症休克,病情凶险,即使经医疗干预,死亡率依然高达35%~40%[1]。任何部位感染均可引发脓毒症,临床上常见于腹膜炎、胆管炎、肺炎以及泌尿系统感染等。其中消化系统中多种原因可致病,如消化道急性穿孔或穿孔后保守治疗、急性化脓性梗阻性胆管炎、急性胰腺炎,并常常导致脓毒性休克。此外,肝硬化患者由于免疫力低下,很容易发生细菌感染、脓毒症和脓毒症所致器官功能衰竭,死亡率可高达65%[2-3]。
脓毒症致病机理目前被认为是一种复杂的炎症调节失调,当宿主不能成功地控制感染时,这种炎症调节失调最终通过影响内皮细胞、上皮细胞和免疫细胞等影响多个器官,从而导致不可逆转的机体损害[4-7]。脓毒症炎症反应可涉及2个不同但并非相互排斥的阶段,即全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS),而二者的平衡,以及这些炎症反应的强度,极大地影响宿主的存活[8-9]。
发热和体温过低都是脓毒症的特征[10],虽然发热对机体有一定的损伤,但可帮助机体清除入侵病原体[11-12]。然而,一些严重感染的患者在入院时常出现体温过低(<36℃)。研究发现体温过低是死亡率增加的独立危险因素[12],因此,临床上脓毒症患者体温过低较发热更加凶险。一些观察性研究和随机对照试验的数据也表明,10%~20%的脓毒症患者出现低温,死亡率约为发热患者的2倍[12-14]。对于低体温的原因有多种观点,一些研究认为是由于体内抑炎因子如IL-10、IL-4等过多表达引起,还有部分研究认为感染可导致中枢体温调节紊乱。然而,脓毒症期间体温过低的机制依然不清楚。为了对低温脓毒症进行研究,须建立稳定的动物模型。由于脓毒症腹部感染率高达72.3%,为最常见的感染部位,同时在国内脓毒症主要以革兰阴性菌感染为主[15-16],因此,我们用常见的肠道致病菌福氏志贺菌,通过腹部感染小鼠,建立了低温脓毒症模型,并在感染后进行不同干预,研究感染强度与体温变化的关系,为脓毒症导致体温过低的机制研究提供了思路和方向,也为体温作为简单便捷的监测指标提供依据。
1 材料和方法
1.1 材料
BALB/c小鼠(雌性,16~18 g)购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006];福氏志贺菌301株保存于军事医学研究院生物工程研究所;福氏志贺菌多糖结合疫苗由军事医学研究院生物工程研究所制备;胰蛋白胨和酵母提取物购自Oxoid公司;细胞因子检测试剂盒和HE染色试剂盒购自索莱宝公司;卡那霉素购自Sigma公司。
1.2 脓毒症模型的建立
将福氏志贺菌培养用液体LB培养基于37℃、220 r/min培养过夜,之后按照体积比1∶100转接于新的LB培养基中并培养至菌液D600nm值达到2.0。取100 μL菌液经系列梯度稀释后涂板计数,计算D600nm值为2.0时每100 μL菌液的菌落形成单位(CFU),之后按照计数浓度,在D600nm至2.0时按照所需剂量以及每只小鼠200 μL的体积,将原菌液稀释至不同浓度。将50只小鼠随机分为5组,每组10只,按照不同菌液浓度进行小鼠腹腔注射。
1.3 小鼠体温测定
以小鼠肠温作为小鼠体温。抓取小鼠后腹部朝上,打开小鼠专用体温计并将检测探头前端蘸取少量甘油,将探头轻轻缓慢插入小鼠肛门约5 cm,静置5~10 s,待温度稳定后读取体温数值。
1.4 感染后细胞因子检测
BALB/c小鼠20只,随机分为正常组和感染组,每组10只,其中感染组按照2×107CFU/只的剂量进行腹腔感染,并于感染后8 h取眼球血,血样于37℃孵育1 h后4℃过夜,离心收集血清,采用相应的试剂盒检测血清中各细胞因子浓度。首先将预包被不同细胞因子的板子用洗液洗3次,分别加入100 μL稀释的不同浓度的标准品和待测样品,各样本设置复孔,37℃孵育1 h后洗3次,加入生物素化抗小鼠细胞因子抗体,37℃孵育1 h后洗板3次,加入辣根过氧化物酶(HRP)标记的链霉亲和素,37℃孵育30 min后再洗3次,加入显色液避光反应10 min后加入终止液,酶标仪测定D450nm值,绘制标准曲线,计算各细胞因子浓度。
1.5 小鼠免疫
将30只BALB/c小鼠随机分为正常组、未免疫组和免疫组,每组10只。免疫组用制备的多糖结合疫苗分别于第0、14、28 d按每只小鼠2.5 μg多糖剂量进行皮下免疫,注射体积为100 μL。末次免疫后14 d按不同剂量对未免疫组和免疫组进行腹腔感染,并测量体温,观察小鼠存活情况。
1.6 小鼠感染后治疗性干预
将40只BALB/c小鼠按照抗生素使用剂量随机分为4组(0、5、10、20 mg/kg组)。小鼠以2×107CFU/只的剂量进行腹腔感染,感染后1 h将志贺菌敏感的卡那霉素按照0、5、10、20 mg/kg体重的剂量分别经肌肉注射,测量注射后7 h的小鼠体温,并连续观察计算存活率。
1.7 统计学分析
数据采用x±s表示,统计分析利用GraphPad Prism 8软件完成,计量资料2组之间比较采用t检验,多组比较采用单因素方差分析,同时以P<0.05认为差异具有统计学意义。
2 结果
2.1 不同感染后小鼠体温变化
脓毒症主要由细菌感染引起,导致全身免疫系统失衡,其中感染剂量与症状的严重程度具有相关性。为了研究感染剂量与体温的关系,我们将不同剂量的福氏志贺菌301株经腹腔注射后感染小鼠,评价不同剂量下小鼠体温变化,定义体温≤35℃为低体温。结果发现,在腹腔感染前,小鼠体温主要为36~37℃,而最高剂量组(2×107CFU/只)在感染后6 h全部为低体温,低体温率为100%,其中9只体温低于30℃,最低达24.2℃,而其余剂量组均正常。随着时间的推移,其余剂量组小鼠体温也逐渐降低,其中 1×107、0.5×107和0.25×107CFU/只剂量组的低体温发生率分别为60%、20%和10%(图1A)。这一结果表明感染剂量越大越容易出现低体温。此外,小鼠死亡率随着感染剂量的提高而提高,同时死亡小鼠几乎均在每组中体温最低,提示低体温与感染程度的相关性(图1B)。

图1 不同剂量感染后小鼠体温及存活情况
2.2 低体温下机体炎症反应及脏器损伤
以上结果表明高剂量感染下小鼠体温显著降低,死亡率升高,而这种急性条件下高死亡率往往与感染后血管通透性增加、血容量降低导致的低血容量性休克有关。为了证明这一点,我们以2×107CFU/只的剂量进行腹腔感染,在感染后第8 h通过眼球取全血,可以看到与之前结果一致,感染组体温显著降低,均低于30℃,最低可低至24.5℃(图2A)。此外,尽管2组小鼠体重没有明显变化(图2B),但取血过程中未感染组血液流出顺畅,平均取血量为722 μL,而感染组血液流出缓慢,平均每只小鼠只获得131 μL血液(图2C),证实了这种急性感染可明显降低血容量。
一般情况下革兰阴性菌感染机体后,由于内毒素的作用,常伴随着机体发热,而本研究所有小鼠在感染后均出现低体温。为了进一步分析这种感染所引起的炎症类型,我们检测了血清中的炎症因子。结果显示,感染后8 h机体处于严重的细胞因子风暴,IL-1β、IL-6、IFN-γ及TNF-α等促炎因子均具有较高浓度,其中IFN-γ浓度最高,其平均值约18 000 pg/mL,尽管抗炎因子IL-10浓度也有所升高,但相对于促炎因子依然处于劣势(图3)。这表明在感染早期,尽管机体体温降低,但依然以促炎为主。
为了评价这种急性期感染是否会对脏器造成损伤,我们对感染后不同脏器(心、肝、脾、肺、肾)进行了HE染色。可以看到,与正常组织相比,心、肝、脾和肺在急性感染早期均未出现明显异常,但肾小管上皮细胞明显水肿(图4),提示肾脏可能是细菌感染的靶器官。
2.3 感染不同干预后体温变化分析
以上结果表明严重的感染可导致低体温脓毒症,而在感染的几小时内机体即可出现血液灌注严重不足,同时处于严重的细胞因子风暴,并累及肾脏。那么这种急性感染通过干预而改善后,体温是否也会随之恢复?为了验证这一点,我们采用预防性干预措施,首先对小鼠进行免疫,分别于第0、14、28 d免疫志贺菌多糖结合疫苗,同时以未免疫小鼠作为对照,末次免疫后14 d按2×107CFU/只的剂量进行腹腔感染,感染后8 h检测小鼠体温,同时连续观察7 d,计算各组存活率。结果表明免疫组小鼠低体温症状显著改善(图5A),之后连续观察7 d,免疫组小鼠存活率为100%,未免疫组小鼠全部死亡(图5B)。进一步,对免疫后小鼠以不同剂量(4×107、3×107、2×107和1×107CFU/只)进行腹腔感染,并测定体温动态变化,可以看到在不同剂量感染下,免疫后小鼠均100%存活,且随着感染剂量的降低,体温下降程度越小(图5C),提示疫苗在提供保护的基础上,体温的降低程度在一定程度上反映出感染的严重程度。
之后,我们评价了治疗性干预对体温的影响。小鼠以2×107CFU/只的剂量进行腹腔感染,感染后1 h经肌肉注射,分别给予0、5、10及20 mg/kg体重的卡那霉素,测量抗生素治疗7 h后的小鼠体温。结果表明,随着抗生素浓度的升高,小鼠存活率随之提升(图6A),体温降低程度也逐渐减小(图6B),进一步证明感染程度与体温的相关性。
3 讨论
脓毒症的宿主免疫反应被认为是不同免疫反应的重叠。脓毒症在早期表现为SIRS,其特征是释放许多促炎介质,包括早期反应细胞因子,如TNF-α、IL-1、IL-6、IL-12、趋化因子、黏附分子和白三烯等[17]。此外,SIRS可通过释放抑制性分子,如IL-10、病原体识别信号级联抑制因子和激素等进行反调节,这种调节也被称为CARS,从而对过度的炎症反应起到抑制作用[8,18]。研究发现,在实际病程发展中SIRS和CARS有相当大的重叠,因此患者的整体免疫状态取决于哪个反应占主导地位[19]。我们的研究结果表明促炎因子IL-6和IFN-γ在血清中的浓度最高,尽管抑炎因子IL-10也有所升高,但远远低于促炎因子水平,因此可以判断感染后小鼠处于SIRS,而此时虽然小鼠体重未发生明显改变,但血容量显著降低,提示炎症导致血管通透性增加,循环血容量降低并累及脏器,成为小鼠死亡的重要原因之一。

图2 小鼠感染后机体一般情况
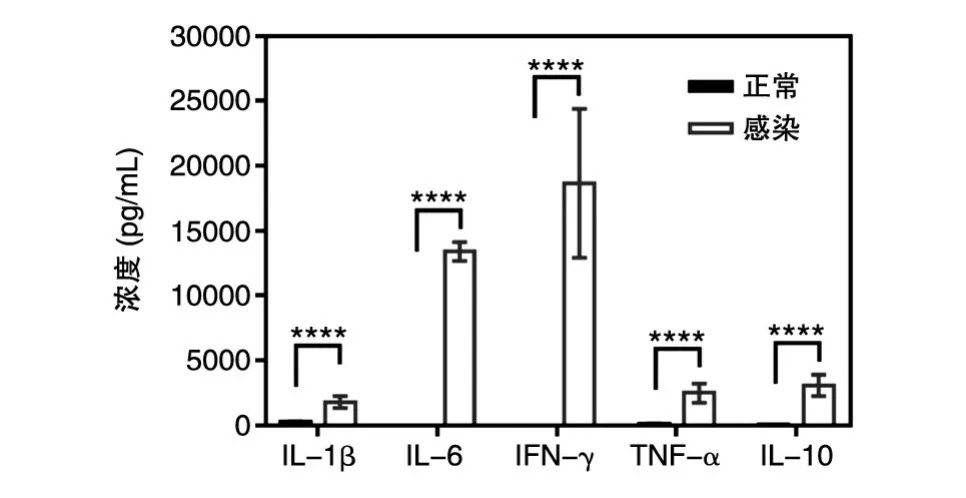
图3 低体温下小鼠血清中细胞因子浓度
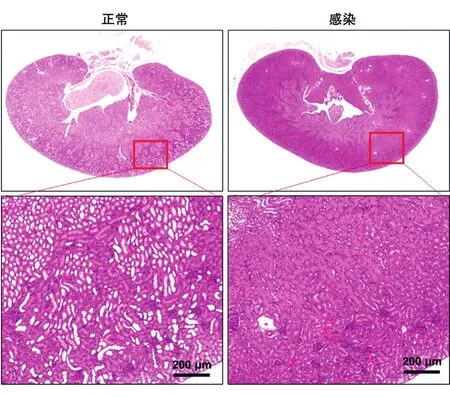
图4 小鼠感染后肾脏病理变化

图5 预防性干预后感染小鼠的存活及体温变化
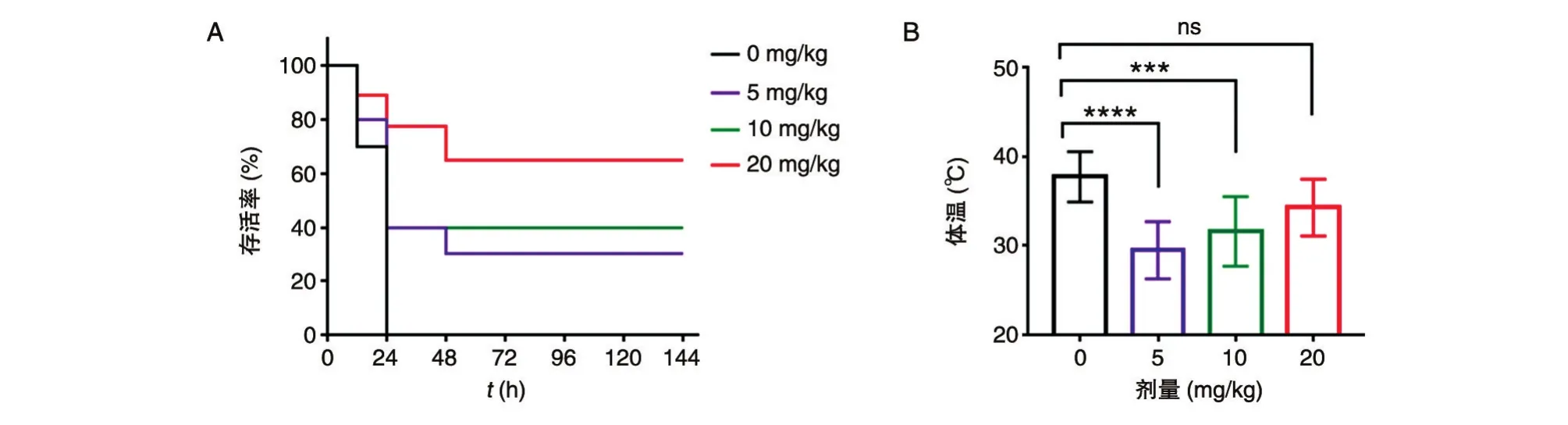
图6 治疗性干预后小鼠体温变化
目前,脓毒症期间体温过低的病因尚未确定。一些研究发现促炎细胞因子在发热反应的产生中起重要作用,这些细胞因子或者与位于下丘脑前部视前区附近的特定受体结合[20-21],或者直接增加环氧合酶的表达,导致前列腺素e2的释放,通过这些小的脂质介质扩散到血脑屏障,刺激中枢从而引起发热[20,22-23]。然而多项研究也发现,在临床上发热和低体温病人血液中促炎细胞因子如IL-6、TNF-α等均没有显著差别,发热和低体温与感染的细菌类型也没有相关性,目前不能完全证明促炎反应的抑制与脓毒症中的低温有关[13-14]。而抗炎细胞因子,如IL-10,在人和动物中具有解热作用[24-25],因此,过度的抗炎反应有可能解释低温症[26]。然而,我们的结果也表明,尽管血液中炎症因子以促炎因子为主导,但小鼠体温依然显著下降,甚至低于25℃,进一步佐证了促炎因子与低体温之间无直接联系。此外有研究发现低温患者的精神状态变化发生率较高[27],提示低温可能与下丘脑温度中枢紊乱以及大脑神经递质活性改变导致中枢神经系统功能障碍有关。还有研究发现,内皮细胞活化标志物CX3C趋化因子(fractalkine)在低温下升高,提示血管功能障碍在低温败血症中起作用[28],这些线索为脓毒症低体温的机制研究提供了思路。
在本研究中,我们用不同剂量的细菌感染小鼠,发现小鼠低体温率和死亡率随感染剂量增加而增加。此外,我们分别采用预防和治疗措施对小鼠脓毒症进行干预,并检测体温变化和存活情况,发现体温变化与小鼠存活率具有相关性,体温回升时小鼠存活率也随之升高。这一结果不仅进一步证明低体温是死亡的危险因素,同时也表明体温的动态变化可以作为脓毒症改善的一个指标,由于体温检测简便易行,有助于临床快速判断疾病发展及治疗效果,为脓毒症的及时诊治提供时间。

