WCX-MB联合MALDI-TOF MS技术建立宫颈癌诊断预测模型及初步验证
孙克娜,许小雨,朱小双,宋御繁,刘晓斐
1.潍坊医学院 医学检验学院,山东潍坊 261053;2.联勤保障部队第九六〇医院 检验科,山东济南 250031;3.哈尔滨医科大学附属肿瘤医院 检验科,黑龙江 哈尔滨 150000
宫颈癌是最常见的妇科恶性肿瘤之一,居女性生殖系统恶性肿瘤的首位,严重威胁妇女健康及生命安全[1-2]。随着疫苗接种和筛查的普及,宫颈癌的发病率和死亡率在发达国家显著降低,而在发展中国家仍处于较高水平,占全球患病总人数的85%以上[3]。目前细胞学检查与人乳头瘤病毒(human papillomavirus,HPV)DNA检测是我国宫颈癌主要的筛查手段,但女性月经经期会延误取材时间[4],特异性较低,假阴性率可达40%[5],临床应用受到限制。鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)、癌抗原CA-125和CA-153等血清学标志物已被广泛用于临床,但在早期患者中升高并不明显[6-7],会造成部分患者的漏诊。宫颈癌的疗效取决于临床分期[8],早期患者经及时手术治疗后生存率较高,甚至可以完全治愈。中晚期患者以同步放化疗为主要治疗方式,半数以上患者死于局部复发或转移[9]。因此,早期诊断是提高患者生存率和生活质量的关键。
蛋白质组学的概念最早由Wilkins[10]提出,是对细胞整体水平蛋白质属性的研究(表达水平、转录后修饰、翻译后加工、相互作用等),在蛋白质水平上获得关于疾病发生、细胞代谢等过程整体而全面的认识。研究表明,弱阳离子交换磁珠(magnetic bead-weak cation exchange,WCX-MB)对低丰度蛋白质具有较好的富集能力[11],与蛋白质组学研究中的基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)技术联合可用于肿瘤相关蛋白的检测和鉴定[12],从而为研究疾病的发病机制、寻找肿瘤标志物和药物治疗靶点提供线索。我们应用MALDI-TOF MS技术联合WCX-MB对宫颈癌患者组与健康组血清蛋白质图谱的变化进行对比分析,筛选出血清差异表达蛋白/多肽,建立宫颈癌诊断预测模型并纳入子宫良性病变组进行验证,寻找可用于诊断宫颈癌的潜在标志物,旨在提高宫颈癌早期诊断水平,改善患者预后。
1 资料与方法
1.1 一般资料
收集联勤保障部队第九六〇医院2019年7月至2020年1月确诊的34例宫颈癌患者血清标本作为癌症组,年龄53.53±13.17岁,中位年龄51.5岁。纳入标准:①未经过手术、放化疗及抗癌药物治疗;②经病理组织学确诊;③具有完整的临床资料;④在收集血清前1个月患者未接受过输血。排除标准:①合并有其他恶性肿瘤;②患有免疫系统疾病及传染性疾病;③肝肾功能不全。选取同期来院做健康查体的各项指标均正常且无既往史的女健康人群26例作为健康组,年龄55.78±11.69岁,中位年龄53岁。2组年龄无统计学差异(P>0.05)。收集27例子宫良性病变(息肉、增厚)患者血清用于后续模型验证,与癌症组年龄无统计学差异。此前瞻性试验方案获第九六〇医院科研伦理委员会批准。
1.2 材料
Autoflex Speed MALDI-TOF-MS、FlexControl软件、ClinPro Tools软件、MTP An-chorip 384 BC靶板、WCX-MB试剂盒、蛋白多肽标准品(Bruker公司);低温高速离心机(Eppendorf公司);磁珠分离器(LiferTechnologies公司);α-氰基-4羟基肉桂酸(HCCA)、三氟乙酸(TFA)、乙腈(ACN)、色谱级无水乙醇、丙酮(Sigma-Aldrich公司)。
1.3 标本采集和预处理
采集初诊宫颈癌患者、子宫良性病变患者和健康者空腹静脉血5 mL置于含惰性分离胶的真空采血管中,避免标本溶血。室温静置30 min,3000 r/min离心5 min,将分离的血清样品分装在0.5 mL EP管中,-80℃冰箱储存,避免标本反复冻融。处理和储存步骤均在抽血后3 h内完成。
1.4 WCX-MB提取提取血清蛋白质/肽
从-80℃冰箱中取出收集的血清,在-20℃冰箱中解冻8 h,再于4℃冰箱中直至血清全融,低温高速离心机9848 r/min离心5 min,取上清。以下操作均于冰上进行。0.5 mL EP管中分别加入10 μL结合缓冲液(BB)和 10 μL WCX-MB,用微量移液器上下吸打混匀;将5 μL离心后的血清加入EP管,混匀,静置5 min;将EP管放于磁珠分离器上分离磁珠1 min,弃上清;加入100 μL洗涤缓冲液(WB),于磁珠分离器上将前后相邻两样品管交换移动,反复10次,静置1 min,弃上清,然后重复洗涤步骤2次,最后一次应完全去除上清液;加入5 μL洗脱缓冲液(EB),混匀,避免产生气泡,磁珠分离器上静置2 min;取上清于新的0.5 mL EP管中,加入5 μL稳定缓冲液(SB),混匀后用于质谱分析。
1.5 仪器校准与质量控制
用制备好的蛋白质/多肽标准品混合液校准仪器,确保实验结果的可靠性。随机选取20例体检健康者,各取5 μL血清混匀,制成质量控制标本,用于评估质谱仪检测结果的稳定性。通过磁珠提取混合血清中的蛋白/多肽,检测时每15个样本点1次靶,得到4个质控样本质谱图,选取4个稳定质谱峰,各个多肽峰的变异系数(CV)平均值为16.94%(12.32%~20.61%),说明本试验方法重复稳定性较好。
1.6 质谱检测样本
取1 μL蛋白质/多肽样本点样于Anchor-Chip 384 BC靶板上,自然干燥,每份样本点靶3次,评估方法的稳定性;将1 μL基质(50%乙腈和2%三氟乙酸配制的3 mg/mL的HCCA)点样于已干燥的样本点上,室温干燥后上机检测,采集质谱图并分析。参数设置:采用阳离子线性模式,在相对分子质量1000~15 000范围内采集数据,激光强度70%,每个样品点累积轰击100×20次。
1.7 统计学分析
所有样本采用盲法检测和分析。用FlexControl软件采集数据,标准参照为相对分子质量1000~10 000的多肽和蛋白混合物。用ClinPro Tools 3.0软件处理数据(基线去除、平滑、归一化),选取信噪比≥5的多肽峰做统计分析。将癌症组和健康组样本按3∶1随机分组,训练组44例(宫颈癌患者25例、健康者19例),验证组16例(宫颈癌患者9例、健康者7例)。分别采用遗传算法(genetic algorithm,GA)、监督神经网络(supervised neural network,SNN)算法和快速分类(quick classification,QC)算法等3种方法建立模型,并于验证组验证模型的敏感性、特异性及准确性,选择最佳诊断预测模型。应用良性对照组对最佳诊断模型进行进一步效能验证。
2 结果
2.1 血清差异蛋白/多肽分析
为了初步了解宫颈癌患者与健康组的血清蛋白/多肽平均质谱图之间的差异,采用FlexControl 3.4和ClinPro Tools 3.0软件对癌症组和健康组的图谱进行分析,相对分子质量范围为1000~10 000,发现2组间蛋白/多肽指纹图谱存在明显差异(图1),共找到差异多肽峰114个,其中61个具有显著性差异(P<0.05),且有12个多肽峰ROC曲线下面积大于0.70(表1)。选取多肽峰差异最显著的m/z 4210.90和4645.11做叠加质谱图及ROC曲线分析,2个峰的AUC值分别为0.97、0.85(图2),其三维峰堆叠谱图见图3。
2.2 诊断预测模型的建立及验证
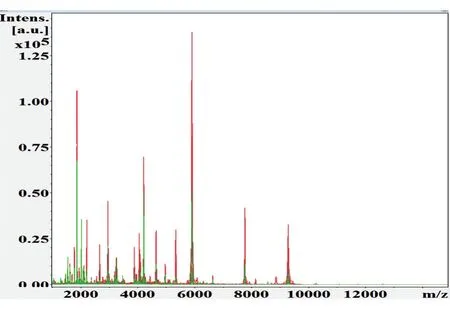
图1 癌症组和健康组的血清蛋白质/肽指纹图谱
用ClinPro Tools 3.0软件分析2组质谱图,应用宫颈癌患者和健康者的训练组(44例)对3种不同算法分别建立模型,并于验证组(16例)进行外部验证。交叉验证的主要思想是将数据分成两部分,一部分用于模型的训练,另一部分用于对训练好的模型进行预测误差估计,客观判断这些参数对训练集之外数据的符合程度[13]。识别能力是判断数据性质、价值和水平的能力。通过综合分析3种模型的交叉验证和识别能力,发现QC模型的诊断表现最佳(表2)。随后通过盲样验证QC模型,在该模型9例宫颈癌患者中的8例被正确识别,1例被排除;7例健康体检者均被正确分类。其诊断准确性为93.75%,特异性为100%,敏感性为88.89%。以差异最显著的2个峰m/z 4210.90和4645.11分别为x、y轴对训练组血清样本做聚类分析,结果显示癌症组和健康组间样本基本无交叉,可被显著区分(图4)。
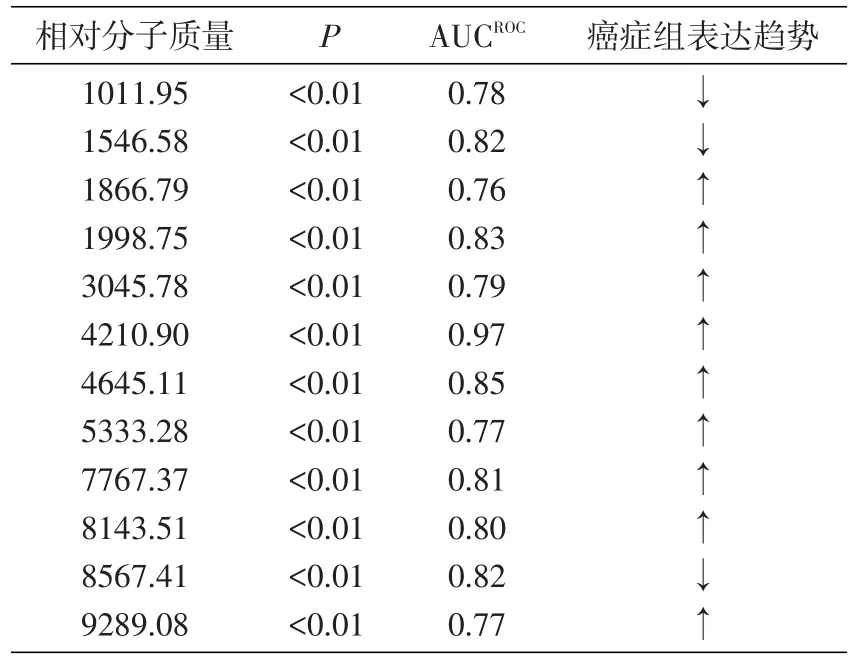
表1 癌症组与健康组的差异蛋白/多肽
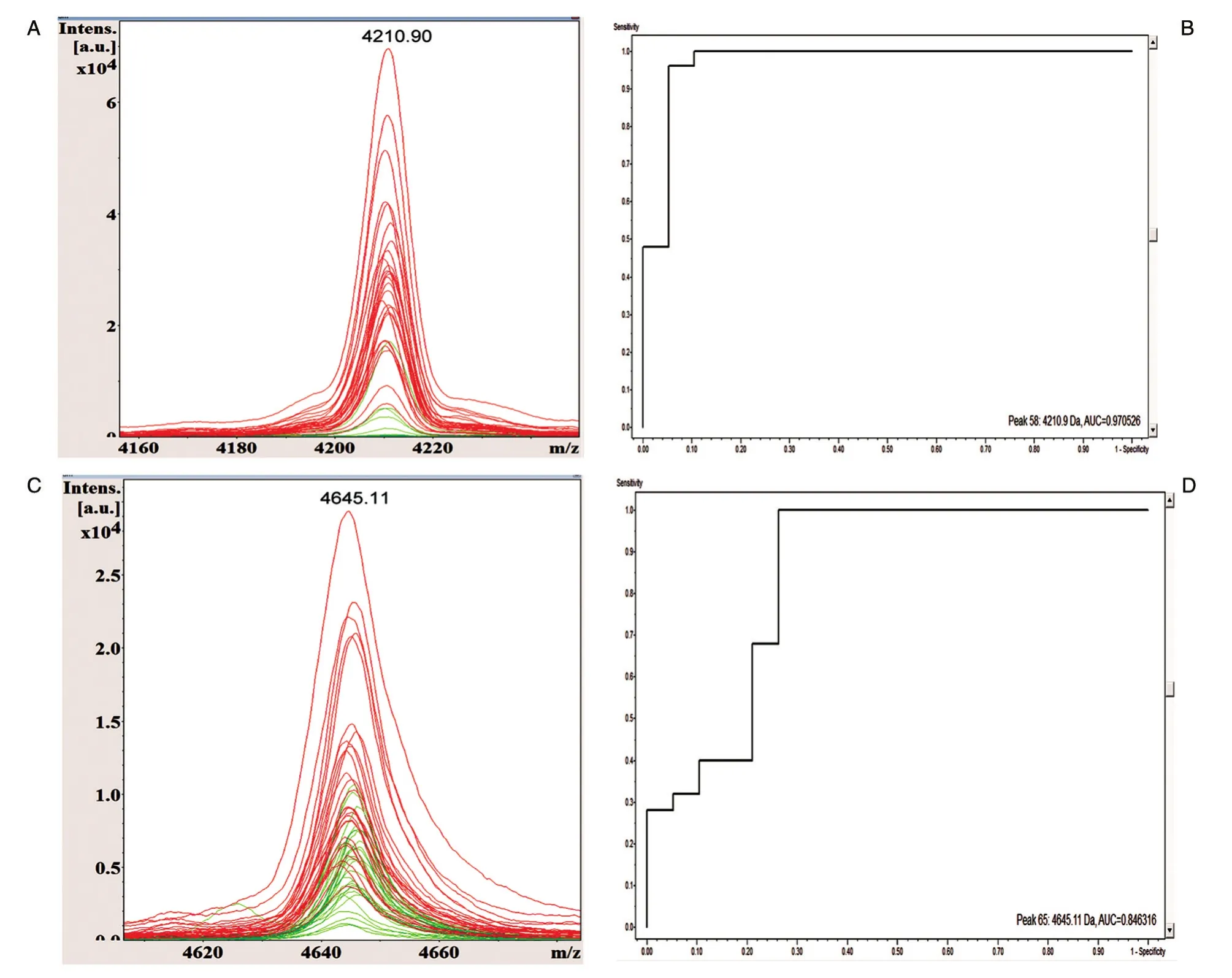
图2 叠加谱峰图与ROC曲线
2.3 QC模型性能验证
为了进一步验证QC模型的诊断效能,对良性病变患者和癌症患者的验证组(17例)进行盲样验证。结果发现,QC模型中9例宫颈癌患者均被正确分类;8例良性对照患者有6例被正确识别,2例被排除。其诊断准确性为88.24%,特异性为75%,敏感性为100%。以差异最显著的2个峰m/z 4210.84和1779.84分别为x、y轴对训练组(44例)血清样本做聚类分析,结果显示宫颈癌患者组和良性对照组间样本基本无交叉,可被显著区分(图5)。由此可见,QC模型对于宫颈癌患者的诊断具有充分可行性。
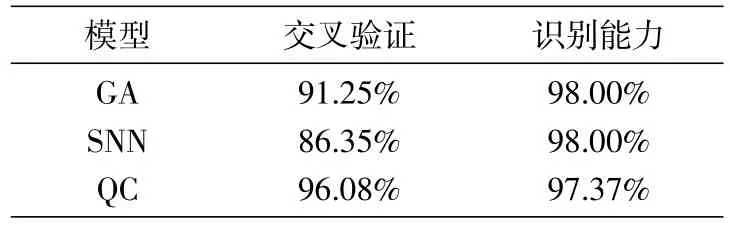
表2 3种诊断预测模型的诊断表现
3 讨论
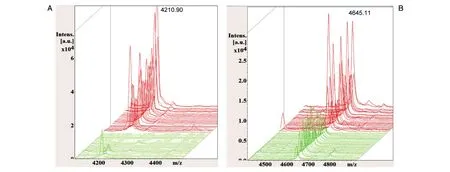
图3 三维堆叠谱图
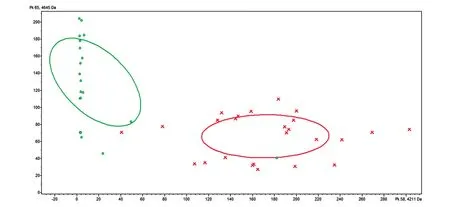
图4 癌症组和健康组的聚类分析
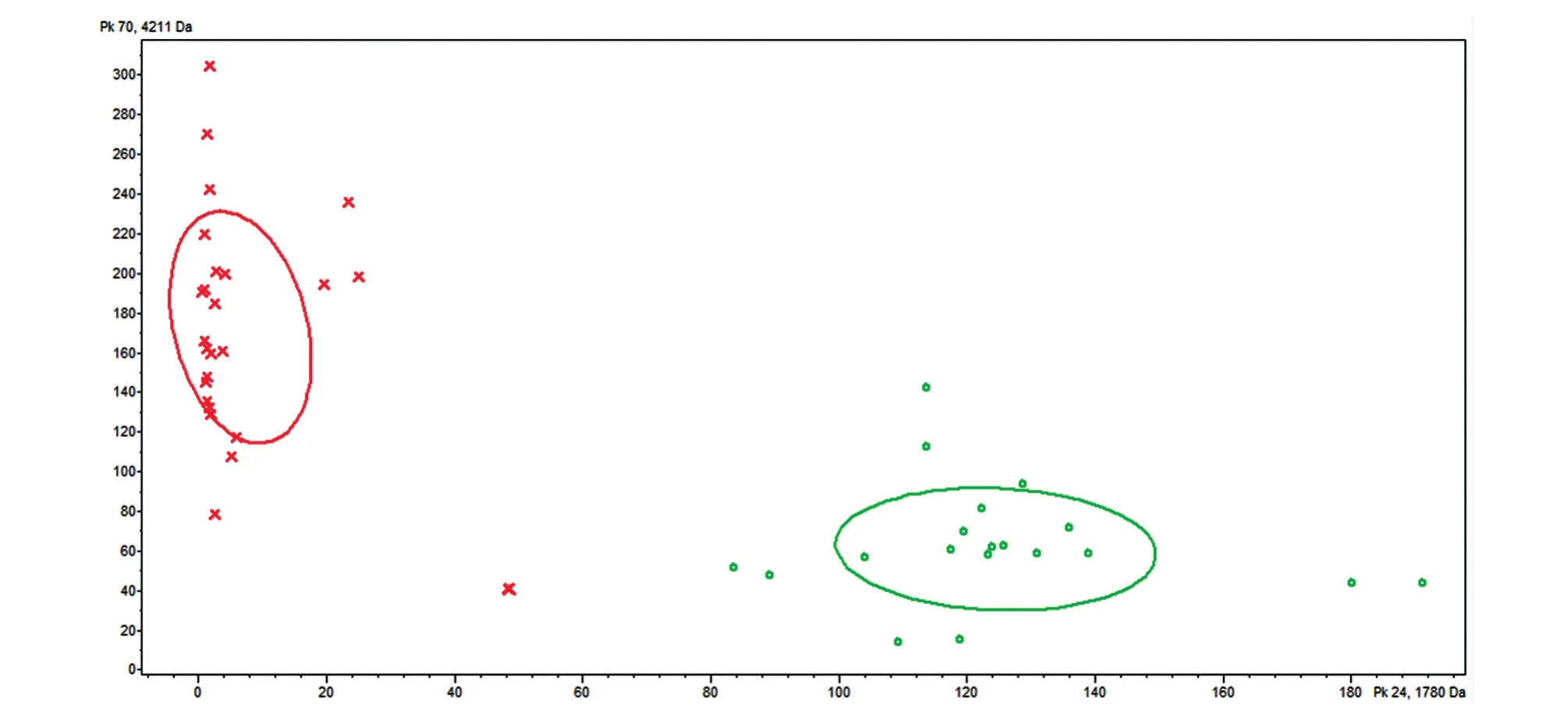
图5 癌症组和良性对照组的聚类分析
MALDI-TOF MS是精准医学发展的新技术,因高准确度、高灵敏度和高通量等优点,在蛋白质组学研究中的应用越来越广泛[14]。传统的二维凝胶电泳(2D-PAGE)技术操作复杂,重复稳定性差,对小分子、低丰度蛋白质的分离效果较差[15]。而WCX-MB对血清中低丰度蛋白/多肽的富集能力强[16],可消除大分子多肽的干扰,具有简单快速和高敏感性等优点,已成为研究蛋白质组学的强有力方法。此外,该方法只需要5 μL血清即可快速获得患者的血清蛋白图谱,无须多次测量,可节约医疗资源,帮助临床医生及时做出诊断,减轻患者的痛苦和经济负担。
目前,WCX-MB联合MALDI-TOF MS技术在胃癌[17]、非小细胞肺癌[18]和食管癌[19]等多种恶性肿瘤中已广泛应用,具有充分的可行性。在宫颈癌中也发现了具有早期诊断价值的蛋白,如载脂蛋白CⅡ[20]等。但目前尚未发现可用于临床宫颈癌诊断的特异血清标志物,分析其原因可能在于癌症患者的异质性、质谱技术的灵敏性和特异性、缺乏有效的验证策略[21]。在本研究中,我们采用同样方法,筛选出12个具有显著统计学差异的多肽峰,其中m/z 4210.90和4645.11的差异最显著,二者的AUC值分别为0.97和0.85,有望成为诊断宫颈癌的潜在肿瘤标志物。分别建立GA、SNN和QC算法诊断预测模型,经过综合比较分析,发现QC算法对癌症组和健康组的诊断准确性为93.75%,特异性为100%,敏感性为88.89%,该模型效能最佳。为了进一步验证QC模型的诊断效能,我们对癌症组和良性对照组进行外部盲样验证,发现其对癌症组和良性对照组的诊断准确性为88.24%,特异性为75%,敏感性为100%。Ziqi等[22]对3985例宫颈癌患者进行Meta分析,发现SCCA诊断的敏感性为0.70,特异性为0.63,AUC值为0.73。由此可见,本研究建立的QC模型具有较高的诊断敏感性和特异性,提示该模型可用于宫颈癌辅助诊断的进一步研究。
Chen等[23]采用同样方法对宫颈癌患者血清进行分析,但结果与本试验中获得的峰大有不同,只有m/z 1998.48与本试验中m/z 1998.75的质谱峰大致相同。分析其原因,可能在于本研究标本量来源于单中心,可能存在选择偏倚。后续我们将进一步扩大样本量,对各年龄、各民族进行充分验证。此外,本研究所筛选出的差异多肽/蛋白质谱峰,有待于对其进行二级质谱鉴定和ELISA验证。
综上所述,本研究建立的宫颈癌QC算法诊断预测模型具有较高的诊断效能,可用于宫颈癌高危人群的筛查及辅助诊断。m/z 4210.90和4645.11可能是潜在的宫颈癌标志物,有待于进一步地鉴定和分析。

