5754例临床标本CYP2C19、ALDH2、MTHFR基因检测结果分析
赵婧,岳鹏,邢国征,于洪远
1.北京航天总医院 检验科,北京 100076;2.解放军总医院 京北医疗区阳坊门诊部,北京 102205
临床精准用药、个体化制定用药方案已被广泛应用于临床实践[1]。对于相关用药的患者群体,基因检测时机当如何选择将成为越来越有意义的课题。细胞色素P450是人体代谢外源性化学物质的关键酶[2],CYP2C19作为其家族成员,是人体重要的药物代谢酶[3],该酶基因多态性与酶活性密切相关[4],许多内源性底物、污染物以及大约2%的药物都由CYP2C19催化代谢,亚洲人群中CYP2C19基因*2和*3是最主要的2个功能缺失型等位基因[5]。线粒体乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是体内参与酒精代谢过程中的关键酶,也是硝酸甘油代谢中的关键酶[6],该基因点突变后可分为野生型(GG型)和突变型(GA或AA型)。研究表明,ALDH2突变是中国人高血压的易感因素[7-8],并且会加速冠心病的病程进展[9]。亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢的关键酶,也是同型半胱氨酸(homocysteine,Hcy)代谢途径中的关键酶,其中以C677T位碱基突变最为常见[10]。
生物芯片识读法检测药物基因是在临床中广泛应用,特异性高于实时荧光定量PCR技术。自2019年6月15日北京市医改政策执行后,药物基因检测收费大幅降低,为有需要检测的患者提供了福利。我院地处北京城南地区,相对人口流动较小。本研究对2016~2019年本院所有检测结果进行了整理分析,对比全国其他地区统计结论,以进一步了解北京市南城地区就诊人群中药物基因分型的分布情况,探讨其与临床用药及疾病的治疗关系,以期为临床医师提供用药参考。
1 资料与方法
1.1 一般资料
通过实验室信息系统(LIS)统计出自2016年3月至2019年4月行药物基因检测标本共计5754例,其中男性患者3350例、女性患者2419例,年龄16~107岁,平均年龄67.85岁。
1.2 材料
DNA提取纯化试剂盒、CYP2C19基因检测试剂盒(DNA微阵列芯片法)、BR-526-24全自动杂交仪、BE-3.0生物芯片识读仪、基因芯片图像分析软件(上海百傲科技股份有限公司);SLAN-96P型PCR仪(上海宏石医疗科技有限公司)。
1.3 基因扩增及杂交
EDTA抗凝管采集外周静脉血全血标本,吸附柱法提取基因组DNA,配置PCR反应体系,于PCR仪上进行基因扩增,扩增出含有目的基因的大量单链DNA,在联排管内建立杂交体系,与基因芯片共同置于全自动杂交仪中进行杂交,杂交结束后用生物芯片识读仪读取基因分型结果。
1.4 CYP2C19、ALDH2、MTHFR基因型判定
应用CYP2C19基因图像分析软件行数据分析,对送检标本基因型进行判定。CYP2C19基因的DNA序列差异主要是外显子4上由*1(636)变成*3(636)和外显子5上由*1(681)变成*2(681),共6种基因型,分为快代谢型、中间代谢型和慢代谢型(表1)。
应用ALDH2、MTHFR基因图像分析软件行数据分析,对送检标本基因型进行判定。ALDH2、MTHFR各分为3种基因型,各基因型的酶活性有较大差异(表2)。

表1 CYP2C19基因分型

表2 ALDH2、MTHFR基因分型
1.5 统计学处理
用SPSS 19.0软件进行统计学处理,组间基因型频率及等位基因频率的差异用χ2检验,P<0.05认为差异有统计学意义。
2 结果
2.1 CYP2C19、ALDH2、MTHFR基因型测定结果
CYP2C19基因扫描结果显示为6种基因型,即*1/*1、*1/*2、*1/*3、*2/*2、*2/*3、*3/*3;ALDH2基因扫描结果显示3种基因型,即Glu504Glu(*1/*1)、Glu504Lys(*1/*2)、Lys504Lys(*2/*2);MTHFR显示为3种基因型,即CC、CT、TT(图1)。
2.2 5754例药物基因检验结果统计
将5754例临床检验样本结果进行回顾性分析(表3)。行CYP2C19基因检测4692例、ALDH2基因检测1006例、MTHFR基因检测2139例,543例标本为3种基因共检。3种基因野生纯合型分别检出41.6%、71.1%、18.9%。
CYP2C19基因快代谢型、中间代谢型和慢代谢型检出率分别为41.6%、45.9%和12.5%。
ALDH2中GG、GA、AA型分别检出715、264、27例,检出率分别为71.1%、26.2%、2.7%,提示其中26.2%不可用或慎用硝酸甘油,并且这类人群对酒精的解毒能力差[11];2.7%的AA型对硝酸甘油无效,且对酒精的解毒能力很差。
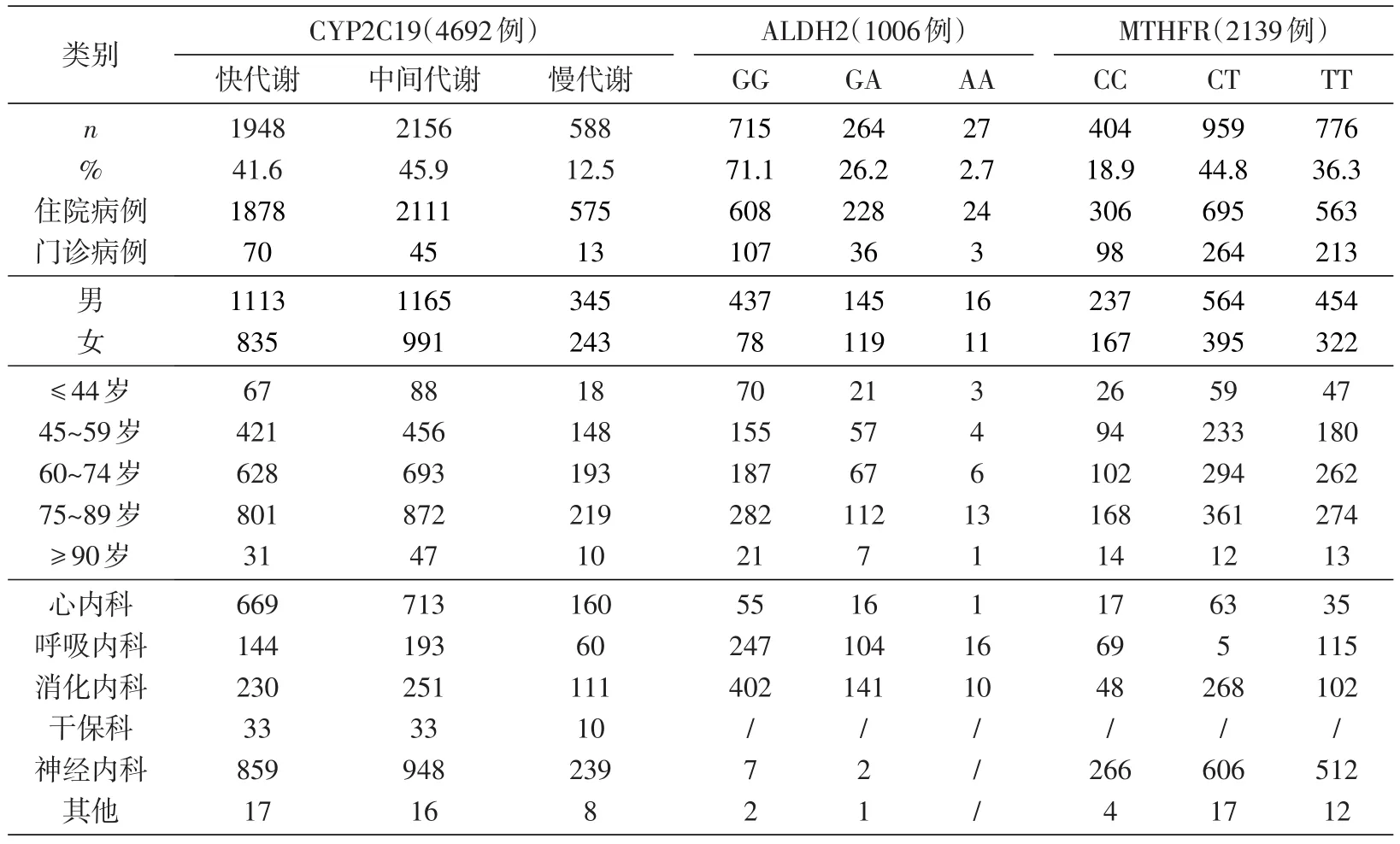
表3 5747例药物基因结果回顾

图l CYP2C19、ALDH2和MTHFR基因型扫描结果
MTHFR送检的2139例标本中,CC、CT、TT型分别检出404、959、776例,分别占18.9%、44.8%、36.3%。36.3%的TT型患高Hcy血症的风险高,叶酸治疗时应增加剂量。
根据送检标本类别分析,病房送检例数明显高于门诊,考虑与基因检测项目收费较高有关,门诊患者的接受能力低于住院患者,但并不提示门诊患者的需求低于住院患者,比较病房和门诊检出各基因型检出频率,两者差异无统计学意义(P>0.05)。
根据送检标本性别分析,CYP2C19基因送检标本中女性患者占比44.1%,男性占比55.9%;ALDH2送检标本中女性患者占比40.6%,男性占比59.4%;MTHFR送检标本中女性患者占比41.3%,男性占比58.7%。3个基因送检标本男性均多于女性,但不同性别间各基因型频率差异无统计学意义(P>0.05)。
按照世界卫生组织以全球人体素质和平均寿命的测定对年龄进行划分,可将人的一生分为5个年龄段,即青年(≤44岁)、中老年(45~59岁)、年轻的老人(60~74岁)、老年人(75~89岁)、长寿老年人(≥90岁)。将送检的5747例标本按如上规则进行统计,可以清楚地看到各个基因型以老年人即75~89岁年龄段就诊人群临床送检率较高。各年龄段3种基因分型的检出频率无统计学差异(P>0.05)。因此,建议早期确定基因型制定个体化用药剂量,减少药物不良后果的发生,对疾病治疗及预后有积极意义。
2.3 根据临床诊断结果统计
通过单因素方差分析,临床送检的5747例药物基因检测给出的诊断主要包括头晕(1437例)、(急性)脑梗死(1444例)、高血压(629例)、脑血管病(133例)、心绞痛(336例)、冠状动脉粥样硬化性心脏病(718例)、急性心肌梗死(54例)、胸痛(142例)、心悸/胸闷(97例)、支架术后(39例)、高脂血症(108例)、糖尿病(511例)、肺部感染/肺炎(373例)、胃炎(244例)、消化性溃疡(197例)、消化道出血(106例)、反酸(102例)等,部分标本同时包含如上2个以上诊断,表明目前进行药物基因检测的临床应用较广。以脑梗和冠心病的患者送检率最高。
2.4 CYP2C19基因科室分布及各基因多态性
3个基因检测中以CYP2C19收集数据最多(4692例),送检标本主要来自神经内科和心内科(表4、5),心内科、神经内科慢代谢型检出率分别为10.4%、11.6%,差异无统计学意义(P>0.05)。消化科快代谢型、中间代谢性检出率分别为38.9%、42.4%,差异无统计学意义(P>0.05)。心内科慢代谢基因型检出160例,占比3.41%,CYP2C19是导致氯吡格雷疗效减弱甚至治疗失败的主要影响因素之一[12],提示这类人群在使用新型抗凝药物氯吡格雷时治疗效果差,需要加大剂量或选择其他抗凝药物治疗。神经内科检出239例,慢代谢型检出率为13.23%,抗癫痫药物丙戊酸治疗窗窄,代谢产物有肝毒性,这类人群使用较小剂量或正常剂量可达到理想的治疗效果。CYP2C19的基因多态性影响质子泵抑制剂(proton pump inhibitor,PPI)类相关药物奥美拉唑在不同患者中的清除率[13],4692例标本中快代谢型及中等代谢型分别检出1948和2156例,分别占比41.5%和46.0%。其中消化科送检标本中快代谢型及中等代谢型共检出481例,占81.3%,提示这类人群在使用奥美拉唑等药物治疗时疗效差,需要增加药物剂量或者换药;而ALDH2突变型人群应避免饮酒,调整生活方式降低卒中风险[11]。CYP2C19基因型是影响伏立康唑药代动力学的主要因素[14],对于呼吸科、皮肤科等快代谢型(41.6%)使用抗真菌药物伏立康唑的患者需要增加药物使用剂量,或者调整抗真菌药物。
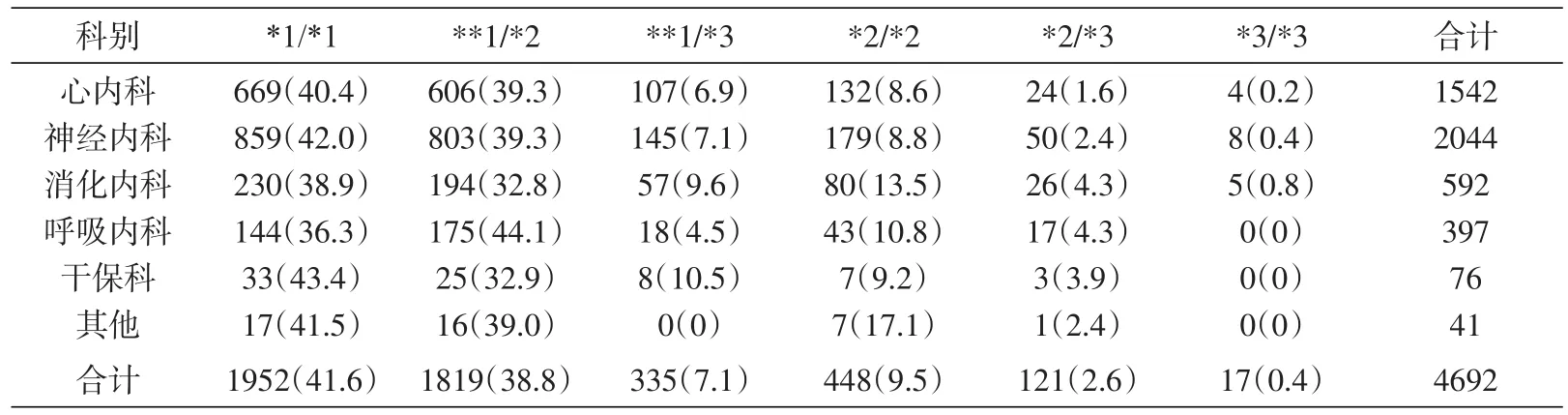
表4 CYP2C19基因检测结果科室分布[n(%)]
单核苷酸多态性分布显示,CYP2C19基因681位点G>A碱基突变率(30.2%)明显高于636位点的G>A碱基突变率(5.2%),差异有统计学意义(P<0.01)(表 6)。ALDH2(Glu504Lys)基因位点G>A(1694>318)突变率为15.8%,MTHFR(C677T)基因位点C<T(1767<2511)突变率为58.7%。
3 讨论
据世界卫生组织公布的数据,各国住院患者发生药物不良反应的比例为10%~20%,约5%的患者死于严重药物不良反应。个体化医疗最大的好处就是节约医保费用。随着基因研究的不断深入,单核苷酸多态性逐渐能更好地对个体表型差异、疾病易感性、药物代谢能力做出解释[8]。
CYP2C19是人体中重要的药物代谢酶,亚洲人CYP2C19变异率明显高于欧洲人[15],CYP2C19*2等位基因在高加索白人中约占12%,美国黑人中约占15%,亚洲人占29%~35%[16]。本研究表明,北京南城地区CYP2C19*2等位基因占30.2%。CYP2C19*3亚洲人比例为2%~9%,其他种族人群约为1%以下,所占比例较低,关注该功能缺失基因对于亚洲人群的意义更大[17]。本研究结果显示,北京南城地区CYP2C19*3比例为5.1%,提示携带该功能缺失的基因较多。
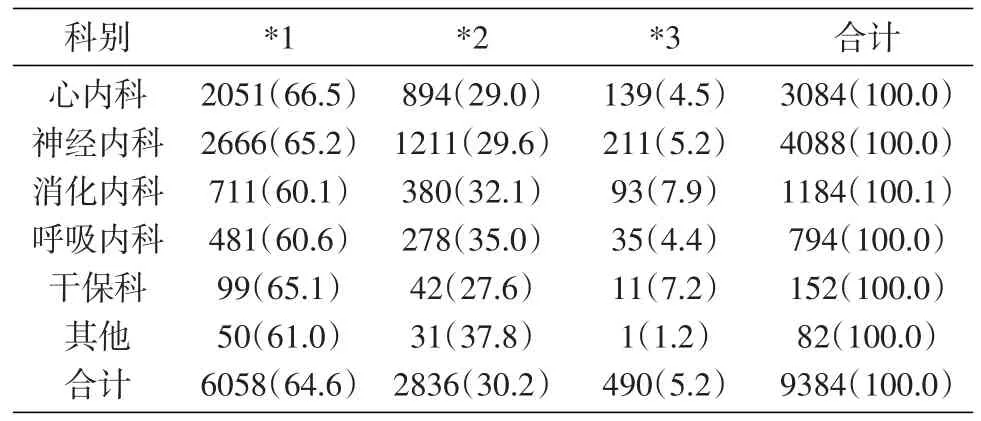
表5 CYP2C19基因型别科室分布频率[n(%)]
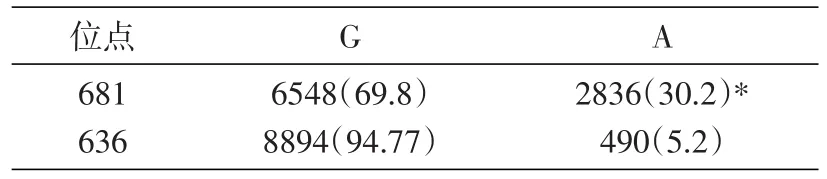
表6 CYP2C19基因多态性分布[n(%)]
乙醛脱氢酶2是重要的乙醇代谢酶,可参与醛类物质的清除、能量代谢、脂质代谢、氧化应激和细胞凋亡等多种生理病理过程[18]。ALDH2基因多态性存在种族差异,白人罕见突变者,东亚人群突变者常见[19]。中国人群中,61%为GG型,32%为GA型,7%为AA型[20]。本研究显示,1006例ALDH2中检出GG型715例占71.1%、GA型264例占26.2%、AA型27例占2.7%,Glu504Lys位点G>A(1694>318)碱基突变率为15.8%。表明北京南城地区ALDH2基因突变率较低。
MTHFR与甲硫氨酸合成还原酶(MTRR)一起维持机体内叶酸正常代谢[21]。MTHFR基因异常的人酶活性明显降低,造成叶酸代谢障碍,导致新生儿神经管畸形、唐氏综合征、唇腭裂及心血管等疾病[22]的发病风险明显增高[22]。C677T位点突变是目前发现的该基因中最常见的不耐热错义突变[23]。据报道,MTHFR基因C677T突变与缺血性脑血管病密切相关[24]。MTHFR C677T基因突变率在不同人种中不同,我国C677T基因型约占25%,明显高于欧美国家[25];Yang等[26]研究表明我国汉族人TT基因型为23.2%,且北方人群高于南方。本研究发现,我院MTHFR送检的2139例标本中,TT型776例占36.3%,明显高于我国平均检出率,差异有统计学意义(P<0.05)。MTHFR(C677T)基因位点C<T(1767<2511)碱基突变率为58.7%,提示北京南城地区该基因突变率高,对于高危人群或使用经该途径代谢的药物应积极检测该基因,明确疾病风险,实现精准用药。
本研究是对临床送检样本进行整理回顾分析,由于信息采集来自临床标本,非随机对照研究,未系统调查研究对象饮酒史、吸烟史及药物治疗史等,存在设计缺陷,结论有一定的偏倚,还应增加信息量,扩充临床资料以备进一步研究。

