姜黄素生物粘附微球的制备工艺及体外性质研究
安芸,贾莉,李蕾,张兰英
(1菏泽医学专科学校;2山东丹红制药有限公司,山东 菏泽 274000)
生物粘附微球是通过将药物分散或吸附于具有生物粘附作用的高分子材料制备成的微球表面,利用材料的粘附作用,延长和增加与人体粘膜的接触时间和面积,从而达到缓定位、缓释、提高生物利用度的目的[1-2]。姜黄素(Curcumin)是从姜科姜黄属植物姜黄(Curcuma longae L)的干燥根茎中提取的具有β-二酮结构的多酚类化合物。姜黄素虽具有抗肿瘤、抗炎、抗氧化、降血脂等广泛的药理作用,但因其水溶性差,体外易氧化、直接口服生物利用度低(约89%以原形药物排除)等原因,极大地限制了其在临床中的广泛应用[3-6]。本研究选用卡波姆934P为粘附材料,乙基纤维素为缓释材料,采用乳化-溶剂挥发法制备姜黄素-卡波姆-乙基纤维素生物粘附微球(Cur-Cb-EC),单因素考察制备工艺,评价其体外释放度、生物粘附性等,为姜黄素生物粘附微球的开发和应用奠定坚实的基础。
1 仪器与试药
1.1 仪器 DF-101S恒温加热磁力搅拌器(巩义市英峪高科仪器厂);ZRS-8智能溶出试验仪(天津市天大天发科技有限公司);TU-1900紫外-可见分光光度计(北京普析通用仪器有限责任公司);SHZ-CB型循环水式多用真空泵(河南巩义市英峪予华仪器厂);超声波分散仪(昆山市超声仪器有限公司);电子天平(北京赛多利斯仪器系统有限公司);微孔滤膜(上海兴亚净化材料厂)
1.2 试药和动物 姜黄素对照品(上海阿拉丁生化科技股份有限公司);姜黄素(济南圣和化工有限公司);卡波姆934P(武汉市合中生化制造有限公司);乙基纤维素(泰安瑞泰纤维素有限公司);液体石蜡(天津市大茂化学试剂厂);Span-85(天津希恩思生化科技有限公司);石油醚(上海麦克林生化科技有限公司);无水乙醇及其他分析纯试剂(天津市大茂化学试剂厂);SD大鼠(济南金丰实验动物有限公司)。
2 方法
2.1 姜黄素体外分析方法建立(1)确定最大吸收波长:称取适量姜黄素对照品,溶于无水乙醇,配制姜黄素标准溶液,采用紫外可见分光光度法,在200~800 nm内,扫描姜黄素、卡波姆和乙基纤维素的紫外吸收光谱。姜黄素在423 nm处有最大吸收。因此确定测定波长为423 nm。(2)标准曲线测定:精密称取姜黄素对照品10.0 mg置于10 ml容量瓶中,加入无水乙醇定容,得姜黄素母液(1.0 mg/ml)。取姜黄素母液,配制成浓度分别为 1.0、2.0、4.0、8.0、10.0、12.0、15.0 μg/ml的7份姜黄素溶液,在423 nm处测定吸光度值A。以吸光度值对姜黄素浓度(C)绘制标准曲线,并回归方程。
取高中低三个浓度的溶液,连续3天,每天分别平行测定3次,计算日内和日间精密度。精密量取姜黄素母液,与卡波姆934P、乙基纤维素适量混合于100 ml容量瓶中,超声溶液,定容,0.45 μm滤膜过滤后,于423 nm处测定吸光度值,计算回收率。
2.2 姜黄素生物粘附微球制备 取一定比例混合的卡波姆934P与乙基纤维素2 g,分散于无水乙醇50 ml中,静置,待溶液出现半透明状后搅拌均匀,加入姜黄素适量。在室温、搅拌条件下,将上述混悬液缓慢滴加至含有Span-85的液体石蜡中进行乳化。室温搅拌至有机溶剂挥干,抽滤,石油醚洗涤3次,室温真空干燥24 h,筛分,即得姜黄素生物粘附微球。
2.3 载药量及包封率测定 取姜黄素生物粘附微球,研细,精密称取20 mg,置于50 ml容量瓶中,无水乙醇溶解并定容,得样品溶液。样品溶液过0.45 μm滤膜过滤后,测定吸光度值,带入标准曲线,计算得到质量。按下列公示计算载药量和包封率。
载药量=生物粘附微球中所含姜黄素的量/微球总重量×100%
包封率=生物粘附微球中所含姜黄素的量/制备时投入姜黄素的量×100%
2.4 单因素实验考察姜黄素生物粘附微球的制备工艺(1)姜黄素加入量:固定其他因素,考察姜黄素加入量分别为0.1、0.2、0.4、0.6、0.8、1.0 g时,对包封率和载药量及球形的影响。(2)卡波姆934P和乙基纤维素比例:固定其他因素,考察卡波姆934P和乙基纤维素质量比分别为3∶1、2∶1、1∶1、1∶2和1∶3时,对生物粘附微球载药量、包封率和成球效果的影响。(3)Span85浓度的影响:固定其他因素,考察Span 85浓度分别为1%、2%、4%、6%、8%时,对生物粘附微球载药量、包封率和成球效果的影响。
2.5 姜黄素生物粘附微球理化性质和体外释药曲线测定 按照单因素考察最佳制备工艺制备姜黄素生物粘附微球,测定粒径分布、松密度和休止角。
按照单因素考察最佳制备工艺制备A、B、C三批姜黄素生物粘附微球,参照《中国药典》(2015年版)释放度测定第二法“浆法”测定姜黄素生物粘附微球的释放度:测定温度为(37±0.5)℃,转速为75 r/min,溶出介质为人工胃液(0.1 mol/L盐酸溶液,含0.4%吐温80)900 ml,取样时间为0.5、1、2、3、4、6、8、12 h,取样量为5 ml,取样同时补充相同体积溶出介质,样品过滤膜过滤后于423 nm处测定吸光度值,计算药物累计释放度,绘制体外释药曲线,与零级动力学方程,一级动力学方程和Higuchi方程拟合。
2.6 生物粘附微球粘附性测定 采用胃黏膜冲洗法[7-8]离体测定生物粘附微球粘附性。取SD大鼠10只,禁食24 h,处死取胃,自胃小弯处剪开,用pH 1.3的盐酸-氯化钠溶液(盐酸7 ml与氯化钠2.0 g,加水至1000 ml)冲洗胃内容物,剪成1 cm×2 cm,铺于载玻片上。取最优工艺制备的姜黄素生物粘附微球30 mg,均匀铺在固定好的胃粘膜上,生理盐水润湿后,置于装有饱和硝酸钾(相对湿度为92.5%)的密封容器内,使微球充分水化。保湿20 min后,将其45°倾斜,用pH 1.3的盐酸-氯化钠溶液冲洗胃粘膜表面5 min,收集冲洗液,定容后测定冲洗液中姜黄素的量,即可计算得到胃粘膜上姜黄素滞留率。以相同量的姜黄素原料药为对照实验。
3 结果
3.1 姜黄素体外分析方法建立 通过扫描紫外吸收光谱,确定姜黄素在423 nm处有最大吸收。因此确定测定波长为423 nm。结果表明姜黄素在1.0~15.0 μg/ml的范围内,回归方程为:A=0.124C+0.0622,R2=0.9995,线性关系良好,见图1。考察姜黄素体外分析方法日内和日间精密度,分别为(1.02±0.56)%和(1.67±0.55)%,均符合要求;计算回收率,符合测定要求。
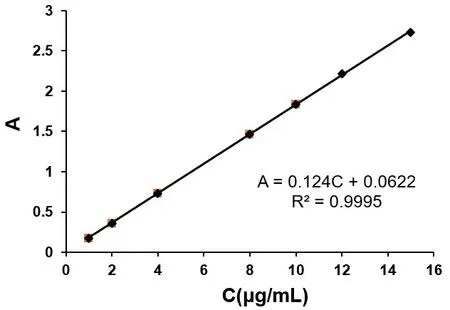
图1 姜黄素标准曲线及线性回归方程
3.2 考察姜黄素生物粘附微球的制备工艺考察 见表1、2、3。
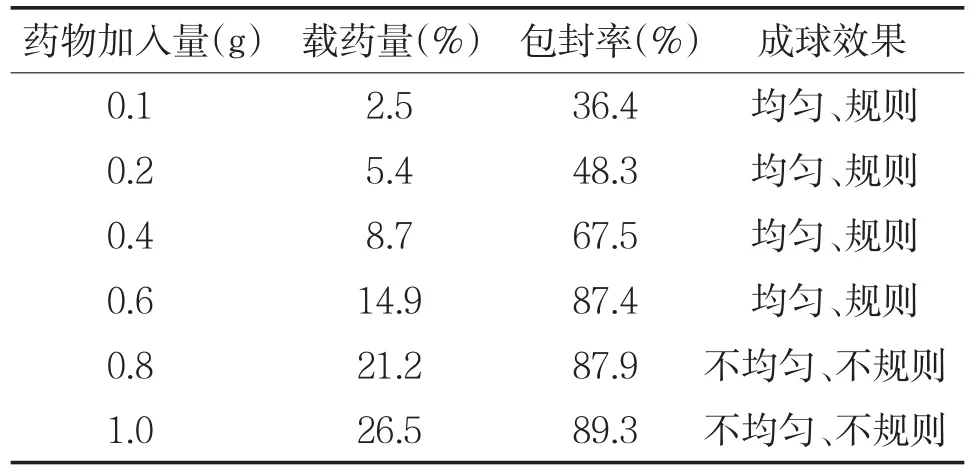
表1 姜黄素加入量对载药量、包封率和成球效果的影响
随着姜黄素加入量增加,载药量和包封率均升高,当姜黄素的加入量大于0.8 g时,成球效果降低,因此确定姜黄素加入量为0.6 g。
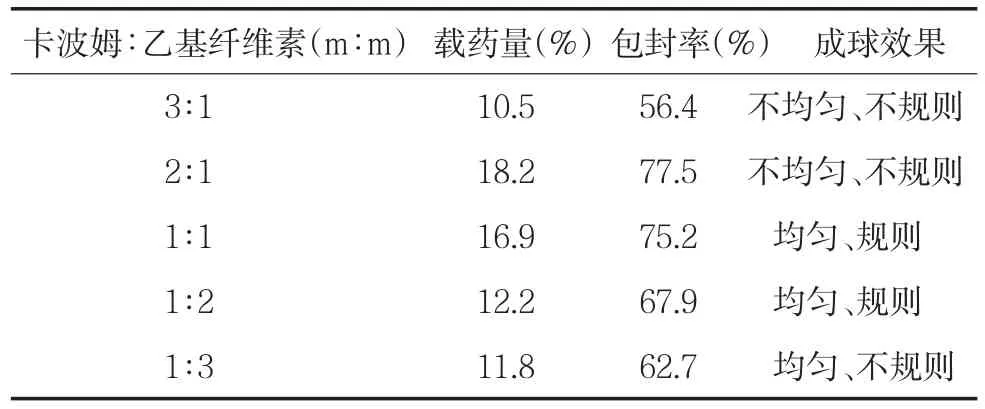
表2 卡波姆和乙基纤维素的比例对载药量、包封率和成球效果的影响
卡波姆∶乙基纤维素加入比例对生物粘附微球的载药量、包封率和成球效果影响较大,当两者质量比为1∶1时,载药量、包封率及成球效率均较理想。
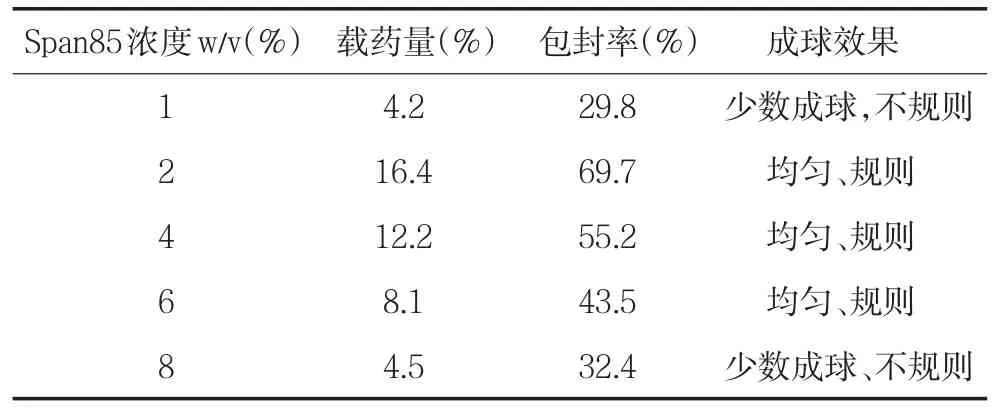
表3 Span85的浓度对载药量、包封率和成球效果的影响
Span85作为乳化剂,其用量对载药量和包封率就有较大影响,当Span 85浓度为2%时,载药量、包封率及成球效率均较理想。
3.3 姜黄素生物粘附微球的理化性质考察 采用筛分法测定粒径分布为335~920 μm的微球占89.92%;光学显微镜计算平均算术径为658.78 μm;量筒法测定松密度为(0.564±0.003)g/ml;漏斗法测定休止角为(16.53±0.08)°。
A、B、C三批姜黄素生物粘附微球在人工胃液中12 h累积释放度为(92.97±2.31)%。姜黄素生物粘附微球体外释药行与Higuchi方程拟合结果为Q=84.234+5.2344 t1/2,r=0.8945,说明姜黄素生物粘附微球具有缓释特征。见如图2。
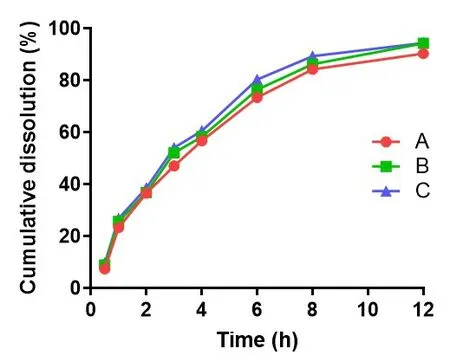
图2 姜黄素生物粘附微球的溶出曲线
3.4 生物粘附微球粘附性测定 生物粘附微球粘附性测定结果如图3所示。姜黄素生物粘附微球滞留率为(86.34±9.85)%,与姜黄素原料药的滞留率(32.3±10.92)%相比,具有显著性差异(P<0.0001)。
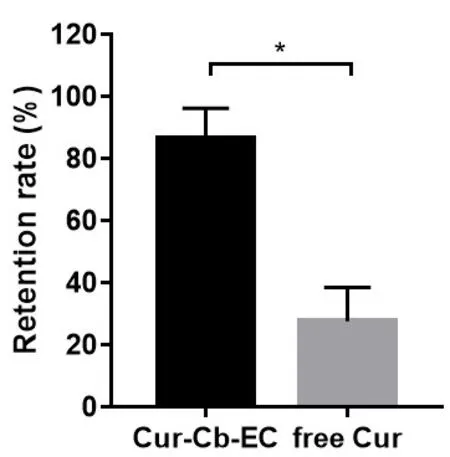
图3 姜黄素生物粘附微球粘附性测定
4 讨论
生物粘附微球是通过生物粘附性粘附于黏膜表面而发挥疗效的药物制剂,具有定位、缓释、提高生物利用度等独特的优势[9]。随着高分子药用辅料的不断发展,生物粘附性材料的不断涌现,进一步促进了生物粘附给药系统的深入发展[10]。生物粘附微球是一种兼顾生物粘附特征的微球,具有独特优势,但其制备方法和工艺对载药量、包封率及成球效果影响较大。
本研究采用乳化-溶剂挥发法,单因素实验考察了姜黄素生物粘附微球制备过程中姜黄素加入量、卡波姆和乙基纤维素及乳化剂Span85浓度3个因素,得到最佳制备工艺;所得姜黄素生物粘附微球载药量和包封率较高,成球效果较好,相应理化性质符合生物粘附性给药系统的要求,具有缓释效果,累积释放度符合要求;与姜黄素原料药相比,姜黄素生物粘附微球的胃内滞留率显著提高,具有生物粘附性特征。本研究为姜黄素及生物粘附微球的进一步开发应用奠定了基础。

