直肠腔内剪切波弹性成像对局部进展期直肠癌新辅助放化疗后T分期的价值
崔宁宜 王勇 唐源 张蕊 刘孟嘉
直肠癌是我国常见的消化道恶性肿瘤,其发生率逐年增高[1]。不同分期的直肠癌应用不同治疗方案,早期病例可行局部切除术,局部进展期直肠癌需选择新辅助放化疗联合根治性手术标准治疗模式。新辅助放化疗可以缩小肿瘤体积、降低肿瘤分期、提高保肛率,降低局部复发率和延长患者的生存期。新辅助放化疗后,达到临床完全缓解的患者可采取等待观察的策略[2-4]。因此,新辅助治疗后需要对肿瘤进行准确的再分期。目前,评价直肠癌新辅助治疗疗效的影像学方法主要为磁共振成像(magnetic resonance,MR)和经直肠腔内超声(endorectal ultrasound,ERUS)。ERUS为直肠癌术前分期常用方法,可显示直肠壁的5层结构,能够准确地反映直肠肿瘤的浸润深度,大量研究证实ERUS术前分期准确性较高[5-6]。然而,由于新辅助放化疗导致直肠肿瘤和周围结构发生水肿、炎症或纤维化、坏死,MR和ERUS对放化疗后肿瘤再分期的准确率均不高[7-9],因此,需要探索新的检查方式和诊断方法。
弹性成像是近年来发展的超声技术,可以反映病变和组织硬度,已在临床中得到广泛应用。其中,剪切波弹性成像(shear wave elastography,SWE)作为一种新型的弹性成像技术,具有不需手动施加压力、可实时定量测量病变硬度的优点,在评估乳腺癌新辅助疗效中已获得了满意的结果[10]。但目前SWE在直肠癌新辅助治疗疗效评估方面尚处于初步应用阶段,相关报道不多[11]。放化疗后,肿瘤坏死、炎细胞浸润和纤维组织增生,可导致肿瘤病灶硬度发生变化。通过比较放化疗前后病灶硬度变化,或可提供新维度的超声信息,进而评估放化疗疗效。本研究在直肠癌新辅助放化疗前后,应用经直肠腔内SWE对直肠癌病灶进行检查,并与术后病理分期结果对照,探讨其对评估直肠癌新辅助治疗疗效的价值。
资料与方法
一、一般资料
收集2018年1月1日~2020年1月1日就诊于中国医学科学院肿瘤医院,临床诊断为直肠癌的患者。纳入标准:(1)病理证实的直肠癌;(2)肿瘤下缘距离肛缘15 cm以内;(3)经直肠腔内超声或直肠MRI分期为T≥3;(4)接受新辅助放化疗加手术治疗。排除标准:(1)同时存在多原发恶性肿瘤;(2)患者于新辅助治疗前后未按时进行经直肠超声检查或未行手术切除;(3)患者自身客观因素不能接受此检查。本研究共收集76名接受术前新辅助放化疗的直肠癌患者。男性41例,女性35例。年龄34~78岁,平均年龄为(57±12.7)岁。其中57例进行了根治性手术,获得病理分期结果。另外19例中,3例因放疗后疼痛无法耐受ERUS检查,4例因临床判断为完全缓解未行手术,12例因治疗过程中出现远处转移未行手术。
二、仪器与方法
使用法国Supersonic Imaging公司的AixPlorer超声诊断仪,SE12-3经直肠腔内探头,频率3~12 MHz。检查前患者口服泻药或清洁灌肠,检查时嘱患者左侧卧位,先行直肠指检,了解肿瘤位置,然后将直肠腔内探头缓缓插入肛门初步观察肿瘤情况。退出探头,向肠腔注入100 mL~150 mL耦合剂充盈直肠,如存在肠腔狭窄时,等待耦合剂通过狭窄部位充盈肿瘤上段肠管后检查。检查时缓慢转动探头并调节深度与方向,多切面反复扫查,扫描病灶全貌动态图像及静态图像储存于工作站,观察并记录肿瘤的部位、大小、边界、形态、内部回声、血流情况、肿瘤浸润肠壁深度、有无浸润周围组织及脏器。直肠肿瘤浸润深度超声分期(uT,u代表超声分期)采用Hildebrandt分期标准[12]。常规ERUS检查后,切换至实时SWE模式,屏幕为灰阶与弹性成像双幅显示,弹性成像图像上的色彩编码反映了硬度,蓝色代表低硬度,红色代表高硬度。选取感兴趣区(region of interest,ROI),将病灶全部包括,然后利用超声仪器内置的定量测量工具Q-Box测量弹性值即杨氏模量值。Q-box选择病灶中硬度较高的部分,避开液性区及肿瘤周围正常组织。探头不施压,静置6 s,待图像稳定后冻结图像。Q-Box默认为圆形,直径调节为5 mm。重复测量3次并记录,取平均值。分别于新辅助放化疗前、治疗后4~6周进行以上检查。常规ERUS及腔内弹性成像图像评估及弹性值测量均由两位有经验的超声科医师共同完成。
三、统计学方法
数据分析采用SPSS 19.0统计软件进行资料录入及统计分析,分类数据应用频数分析进行描述,定量数据记录为平均值±标准差(±s)。两组间定量资料比较采用t检验,多组间定量资料比较采用单因素方差分析。以P<0.05为差异有统计学意义。以病理结果为金标准,评估ERUS及SWE对新辅助放化疗后直肠癌肿瘤浸润深度的诊断效能。
结 果
一、病理结果
获得手术病理的57例中,降期者32例(56.1%),未降期者25例(43.9%)。新辅助放化疗后达ypT0期13例(22.8%),ypT1期4例(7.0%),ypT2期11例(19.3%),ypT3期26例(45.6%),ypT4期3例(5.3%)。新辅助治疗后,病变局限于肠壁内(ypT0-2期)28例(49.1%),病变累及肠壁外(ypT3-4期)29例(50.9%)。
二、ERUS评估新辅助放化疗后肿瘤病灶浸润深度
新辅助放化疗后,ERUS分期与病理分期对照见表1。ERUS正确T分期34例,分期过高16例(16/57,28.1%),主要发生于uT3期。分期过低7例(7/57,12.3%)。6/13例(46.2%)ypT0期患者被过高分期。常规ERUS判断肿瘤局限于肠壁(ypT0-2)的准确率为39.3%(11/28)。
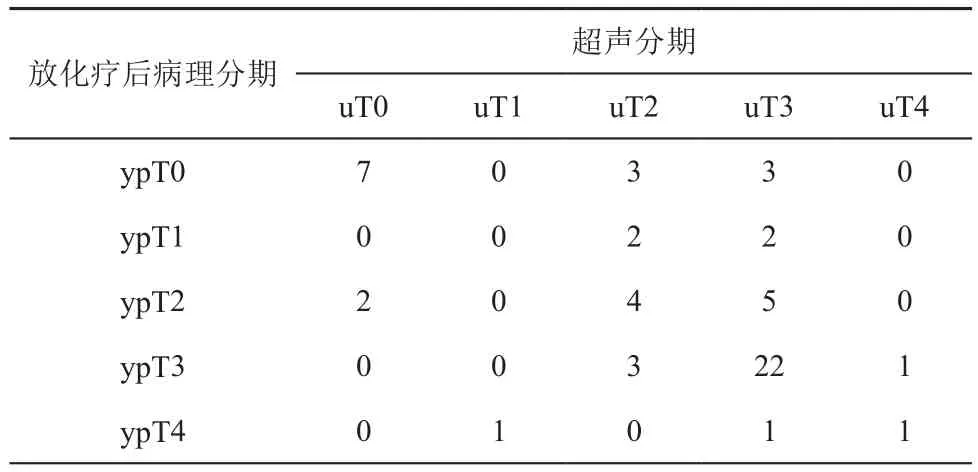
表1 新辅助放化疗后超声T分期与病理T分期
三、SWE评估新辅助放化疗后肿瘤病灶浸润深度
新辅助放化疗前后,杨氏模量Emax平均值分别为(103.27±29.23)kPa、(49.91±32.67)kPa,差异有统计学意义(t=6.236,P<0.001)。放化疗后,51例患者Emax值降低(图1),6例患者Emax值轻度升高(图2)。
新辅助放化疗后,ypT0、ypT1、ypT2、ypT3组Emax平均值分别为(20.28±11.4)kPa、(30.2±11.3)kPa、(48.35±27.6)kPa、(72.84±28.0)kPa、(103.8±52.4)kPa,差异有统计学意义(F=5.227,P=0.006)。其中,ypT0与ypT3、ypT0与ypT4、ypT1和ypT4组间差异有统计学意义(t=-3.943,-3.522,-3.374;P=0.002,0.01,0.01),余各组间差异无统计学意义。
以新辅助放化疗后病灶Emax值构建ROC曲线,经计算确定以43 kPa作为诊断ypT0期的最佳诊断临界点,曲线下面积为0.964(95%CI:0.911~1),应用Emax<43 kPa判断肠壁内无残余肿瘤的敏感性100%,特异性84.6%,准确性89.7%。以58 kPa作为诊断ypT0-2期的最佳诊断临界点,曲线下面积为0.884(95%CI:0.765~0.998),应用Emax<58 kPa判断肿瘤局限于肠壁内的敏感性76.2%,特异性86.4%,准确性为78.9%。
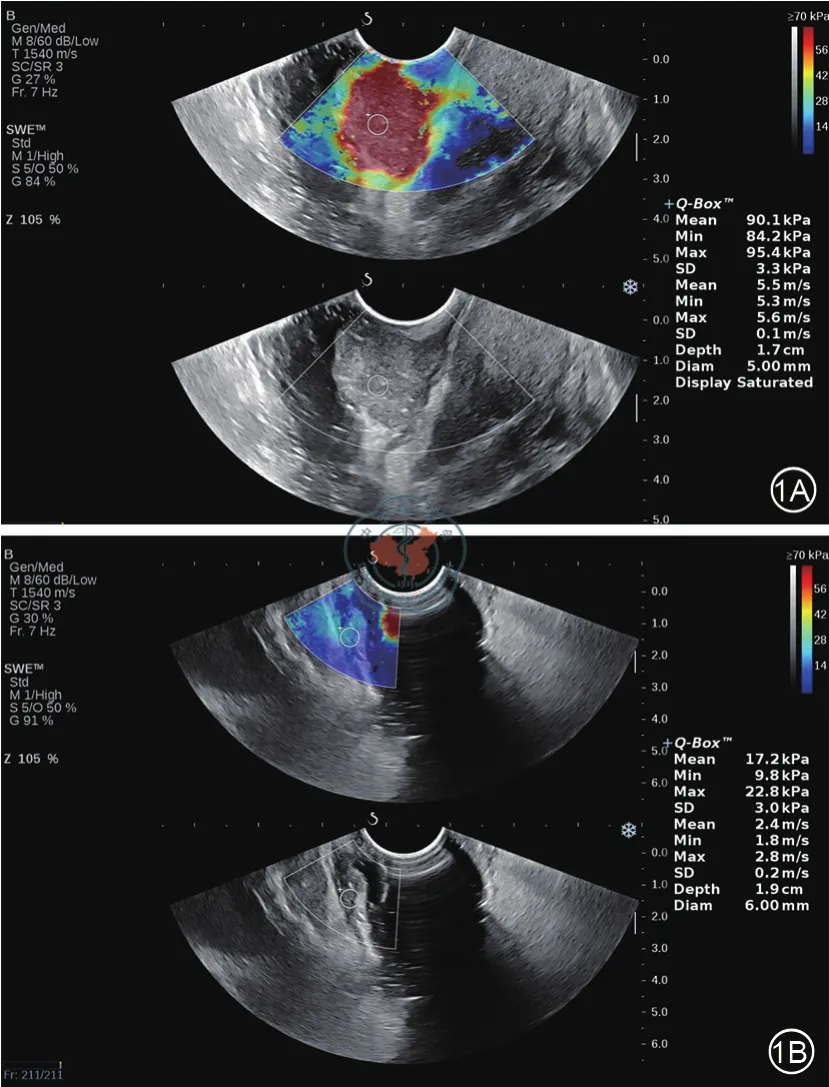
图1 经直肠腔内剪切波弹性成像。1A:54岁男性,放化疗前经MR、ERUS诊断为T3期直肠癌。经直肠腔内超声显示直肠下段肿物,大小约3.8 cm×1.5 cm。剪切波弹性成像测量杨氏模量Emax值为95.4 kPa。1B:新辅助放化疗后,ERUS显示病灶明显缩小,仅局部肠壁增厚,约1.1 cm,可见肌层不均匀增厚。剪切波弹性成像测量杨氏模量Emax值为22.8 kPa。手术病理分期为ypT0N0
讨 论
术前新辅助放化疗已成为局部进展期直肠癌的标准治疗方案。新辅助放化疗后,直肠癌可有不同程度降期,临床完全缓解病例可采取等待观察的治疗策略。因此,新辅助治疗后,影像学对直肠癌进行准确的再分期至关重要。本研究显示,经直肠腔内SWE通过Emax值判断新辅助治疗后直肠癌T分期的准确性较常规ERUS有所改善,有助于为临床治疗方案制定提供依据。
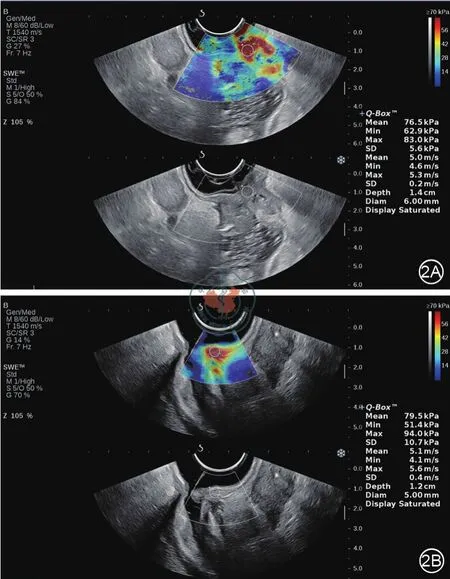
图2 经直肠腔内剪切波弹性成像。2A:62岁男性,疗前经ERUS和MR诊断为T3期直肠癌。经直肠腔内超声示直肠中下段全周增厚,病变长4.8 cm,厚1.3 cm,剪切波弹性成像测量杨氏模量Emax值为83.0 kPa。2B:新辅助放化疗后,病灶较前缩小,ERUS示直肠中下段肠壁局限性增厚,病变长1.7 cm,厚1.1 cm,剪切波弹性成像测量杨氏模量Emax值为94.0 kPa。手术病理分期为ypT3N0
SWE已成功应用于肝脏、乳腺、甲状腺、肌骨和前列腺,但是目前SWE在直肠癌诊断及疗效评估方面尚处于初步应用阶段,相关报道不多。有文献报道,放化疗后直肠癌病灶的硬度较放化疗前降低,且放化疗后病理分期为T3~4期的病灶硬度高于T1~2期的病灶[13]。丛悦等[14]、仲光熙等[15]对新辅助放化疗后直肠癌进行压迫式弹性成像,以应变比值或应变比值降幅判断放化疗后病灶局限于肠壁内(T0-2期)的准确性为69.0%~70.1%。而常规ERUS准确性仅为45%~58.5%。但压迫式弹性成像只能通过计算病灶与周围组织的应变比值来反映病灶的相对硬度,放疗后病灶周围组织硬度增加,会影响对病灶硬度的判断;同时,测量时需手动施压也会带来一定误差。经直肠腔内剪切波成像是一种新型弹性成像技术,通过直接测量剪切波速度获得病灶的弹性绝对值。同时,它不需操作者手动加压,本研究通过耦合剂充盈法经直肠超声检查保证了这一点,避免了人为影响带来的伪像和误差。
本组病例中,新辅助放化疗后的病灶Emax平均值较治疗前显著下降,放化疗后大部分病灶的硬度降低,与既往研究结果一致[13-15]。直肠癌病灶经过放化疗后,其病理镜下改变主要为肿瘤细胞的坏死,伴有淋巴细胞、巨核细胞的浸润和病灶周围的结缔组织增生[16]。这一病灶内部结构的变化可引起病灶物理特性变化,导致硬度发生明显改变。10.5%的患者Emax值较疗前轻度升高,手术病理显示病灶浸润至肠壁外,与疗前相比T分期未降期,推测Emax值轻度升高可能和病灶内部纤维化有关。
在本研究中,ERUS判断新辅助放化疗后肿瘤浸润深度的准确性较低,为59.6%(34/57),和既往研究相符[5-7]。新辅助放化疗后,肿瘤局限于肠壁内者(ypT0-2)28例,常规ERUS准确分期仅11例,过高分期15例,其中10例误判为uT3期。其原因可能是放化疗后纤维组织取代肿瘤,突破肌层或浆膜层,而灰阶超声不能分辨纤维组织和肿瘤病灶,因而误诊为残余肿瘤浸润至肠周脂肪[17]。过低分期则是因为放化疗后部分病例只有极少的残余肿瘤浸润至肌层或黏膜层,在灰阶超声上难以发现。
在本组病例中,新辅助放化疗后病理T分期越高,Emax值均值随之升高。病灶的绝对弹性值增加可以反映残余病变浸润深度的增加,这为评估肿瘤浸润深度上提供了新的维度上的信息。文献报道,ERUS对新辅助治疗后直肠癌进行再分期时,尤以T1~T2期误诊率为高[2,18]。在本研究中,以放化疗后病灶Emax值<58 kPa诊断放化疗后残余病变局限于肠壁内的敏感性为76.2%,特异性为86.4%,准确性为78.9%,较ERUS有所改善。
新辅助放化疗后,约15%~30%的患者可达到病理完全缓解。有学者建议对于达到病理完全缓解的患者,可以进入随访监测期,而暂时不行直肠癌根治性手术。因此,评估有无完全缓解对于制定并及时调整治疗方案具有重要的临床意义。本组患者中,有13例新辅助放化疗后达到完全缓解(ypT0N0),但ERUS仅准确诊断7例,各有3例被误判为T2期和T3期,正确率较低,与既往研究一致[19-20]。以放化疗病灶Emax<43 kPa诊断ypT0期的敏感性为100%,特异性为84.6%,准确性为89.7%,提示弹性成像可以提高ERUS对新辅助治疗后达到ypT0期的诊断准确性,有助于为患者制定更精准的治疗方案。
本研究尚存在一定的局限性:第一,样本量较小,还需在大样本人群中进一步验证。第二,ERUS扫查范围有限,无法显示直肠上段肿瘤,患者选择可能存在一定的偏倚。第三,对于紧邻肛门的直肠癌,ERUS显示欠佳,尤其对于新辅助放疗后的患者,由于黏膜受损,可能会因疼痛而无法耐受检查。
总之,本研究通过经直肠腔内SWE对直肠癌放化疗后病灶硬度变化的评估,提示经直肠腔内SWE可提高常规ERUS对直肠癌新辅助放化疗后T分期的准确性,为临床决策提供更多信息。

