2018 年大庆市某规模化猪场PEDV 检测及S1 基因遗传变异分析
张金悦,陈文文,高飞,苏明俊,孙东波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的高度接触性猪肠道传染性疾病[1]。全年均有发病,冬、春季多次发生[2]。在1971 年,英格兰地区首次暴发该病,直到1978 年,该病大规模流行才被证实是由PEDV 引起的[3]。20 世纪70 年代,PED 疫情首次在我国上海地区得以证实[4]。2010 年,我国十几个地区大规模地暴发了PED[5],使得大量新生仔猪死亡,对我国养猪业造成沉重的打击[6-7]。美洲于2013 年首次暴发PED[8],该病毒在不到一年的时间内发生了突变,造成巨大的经济损失[9]。PEDV 主要感染新生仔猪,特别是7 天内未断奶仔猪,其死亡率高达90%~100%[10]。感染猪临床表现为:萎靡不振、食欲下降、被毛粗乱,突发呕吐和水样腹泻,粪稀如水呈喷射状、颜色呈灰黄色或灰色,最终严重脱水而死[11]。病理变化主要表现为小肠变薄而透明,肠管膨胀,充满浅黄色液体,肠黏膜充血出血,肠系膜淋巴结肿大,小肠绒毛变短,重症者绒毛萎缩甚至消失[12]。粪-口传播是PEDV 的主要传播途径,易感猪接触到病猪或带毒猪的粪便,从而通过口、消化道感染PED。该病毒也通过运输潜伏期的猪或受污染的饲料来感染健康的猪。有研究表明乳汁与精液也可以传播PEDV[13]。最近几年,PEDV 在世界范围内广泛迅速传播,我国也出现越来越多的疑似病例,给养猪业带来了巨大的挑战。
PEDV 是一种单链RNA 病毒,属于尼多病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、α 冠状病毒属(Alpha-Coronavirus)的I 群成员[14-17]。根据冠状病毒的遗传和抗原特征的不同,将冠状病毒分为三组:第一组成员包括猪流行性腹泻病毒(PEDV)、猫冠状病毒(FCoV)、猪呼吸道冠状病毒(PRCoV)等;第二组成员包括牛冠状病毒(BCoV)、猪血凝性脑脊髓炎病毒(PHEV)等;第三组成员包括火鸡冠状病毒(TCoV)、雉冠状病毒(PhCoV)、传染性支气管炎病毒(IBV)等[18]。PEDV 病毒的纤突蛋白(S 蛋白)、膜糖蛋白(M 蛋白)和小包膜糖蛋白(E 蛋白)位于病毒粒子的外表面,核衣壳蛋白(N 蛋白)位于病毒内部,N 蛋白与病毒基因组RNA 交织在一起形成病毒的核衣壳。粪便检测到的病毒粒子是多形的,大多数是球形的,病毒粒子直径在95 nm 与190 nm 之间,其平均直径(包括纤突在内)约为130 nm[19]。PEDV 基因组是单链的RNA,在5′端具有帽子(cap)结构,3′端有一个poly(A)尾,基因组全长约27 000~31 000 nt[14]。PEDV 全基因组是由5′非编码区(UTR)、3′非编码区(UTR)和7 个开放阅读框(ORF)构成的[20]。
PEDV S 基因编码的S 蛋白是以三聚体的方式存在的I 型糖蛋白。在病毒的细胞膜融合以及介导中和抗体产生的过程中起着重要的作用[21]。PEDV S 蛋白由1 383 个氨基酸组成,胞外区人为划分为S1 区(1-789 aa)和S2 区(790-1 383 aa)[22]。S1 结构域主要识别细胞受体并与之结合,S2 结构域主要在病毒膜融合时发挥重要作用[23]。S1 区相对S2 区承受更大的免疫压力,具有更高的遗传变异性[24-25]。因此,S1 基因常被作为分析PEDV 遗传变异情况的靶向基因。
研究通过RT-PCR 技术对2018 年大庆市某规模化猪场两个分场的仔猪腹泻样品进行PEDV 病原检测,并对PEDV S1 基因变异情况进行分析,旨为该场PED 的防控提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品采集
采集2018 年大庆市某规模化猪场腹泻仔猪的小肠组织及内容物(来源于大庆市不同地区的两个分场),每个猪场分别混合为一个样品,共两份样品,储存在-80 ℃冰箱中。
1.1.2 仪器设备(见表1)

表1 仪器设备Table 1 The instrument and equipment
1.1.3 主要试剂(见表2)
1.1.4 引物
参考PEDV CV777 毒株(GenBank 登录号为AF353511)S1 基因保守区设计PCR 扩增引物。引物由哈尔滨博仕生物技术有限公司合成,引物信息见表3。

表2 主要试剂Table 2 The main reagents

表3 PEDV S1 基因扩增引物Table 3 Primers for the amplification of S1 genes of PEDV
1.2 方法
1.2.1 样品处理
称取1 g 小肠组织及内容物,加适量的液氮研磨,并将组织粉末倒入离心管中,加入3 mL PBS,涡旋5 min,6 000×g 4 ℃离心15 min,将上清移到新的离心管中并储存于-80 ℃冰箱备用。
1.2.2 病毒RNA 的提取
(1)将560 μL Carrier RNA 工作液加入一个干净的RNase-Free 1.5 mL 离心管中;(2)将140 μL 组织上清液转移至离心管内,涡旋振荡15 s,并短暂离心;(3)室温静置10 min;(4)将560 μL 4 ℃无水乙醇加入EP 管中,涡旋振荡15 s,短暂离心;(5)将前一步中获得的630 μL 液体加到置于收集管里的吸附柱CR2 中,盖上管盖,以8 000×g 离心1 min,倒出废液,将吸附柱放回收集管中;(6)将离心管中剩余的所有液体加入吸附柱,盖上管盖,以8 000×g 离心1 min;(7)倒出废液,将吸附柱放回收集管中,打开吸附柱盖,向柱子中加入500 μL GD 溶液,以8 000×g离心1 min;(8)倒掉废液,将吸附柱放回收集管,小心打开盖子,向吸附柱中加入500 μL RW 溶液,以8 000×g 离心1 min。重复该步骤一次;(9)倒出液体,将吸附柱放回收集管,以12 000×g 空离5 min,弃去收集管中的液体;(10)将吸附柱放入收集管中,打开盖子,在室温放置3~5 min,让吸附膜干燥;(11)将吸附柱放入一个RNase-Free 1.5 mL 离心管中,将50 μL RNase-Free ddH2O 加入到吸附膜中央并覆盖住吸附膜,室温放置3~6 min,以8 000×g 离心1 min。标记含有病毒RNA 的离心管,并储存在-40 ℃冰箱备用。
1.2.3 cDNA 合成
根据表4 加入反转录试剂进行反转录,轻轻混匀,短暂离心,25 ℃孵育5 min,42 ℃孵育1 h,70 ℃孵育5 min 终止。

表4 cDNA 反应体系Table 4 cDNA reaction system
1.2.4 S1 基因扩增
以合成的cDNA 作为模板进行PEDV S1 基因的扩增,目的片段扩增大小约为2 396 bp。PCR 反应体系见表5,反应条件见表6。取3 μL PCR 扩增产物通过1.0%琼脂糖凝胶电泳进行鉴定。

表5 PCR 反应体系Table 5 PCR reaction system

表6 PCR 反应条件Table 6 PCR reaction condition
1.2.5 S1 基因的克隆和测序
参照凝胶回收纯化试剂盒说明书,回收并纯化鉴定为阳性的PCR 产物,将回收产物连接到pGM-T载体上,然后进行转化。步骤如下:(1)按照连接体系中的顺序将试剂加入到1.5 mL 离心管中(连接体系见表7);(2)轻弹离心管,混匀内容物,并短暂离心,放入16 ℃金属浴中连接16 h;(3)将50 μL TOP10 感受态细胞加入到连接产物中,轻轻混合,冰浴30 min;(4)将离心管置于42 ℃水浴90 s,取出离心管立即冰浴2~3 min;(5)向离心管中加入500 μL 预热的SOB 培养基,置于37 ℃摇床,以150×g 培养45 min;(6)将菌液在离心管中混合后,将100 μL 菌液接种到Amp+抗性的LB 固体培养基,用无菌的玻璃涂布器涂开细胞,在培养箱中孵育12~16 h;(7)从每个平板上挑取单个菌落放入含有50 μL SOB 液体培养基的离心管中,将其作为模板进行菌落PCR(同1.2.4),并通过1.0%琼脂糖凝胶电泳进行鉴定。向摇菌管中加入5 mL Amp+抗性LB 液体培养基,再加入鉴定为阳性的50 μL 菌液,170 rpm 振荡培养10~14 h,于EP 管中加入50 μL 甘油,再加入1 mL 阳性菌液混合均匀,送由哈尔滨博仕生物技术有限公司测序。
1.2.6 同源性及系统进化树构建分析
使用Lasergene DNASTARTM5.06 软件对测序成功的S1 基因进行序列比对和同源性分析。使用MEGA 6.06 软件中Phylogeny 功能采用NJ 法构建系统进化树,采用自展值为1 000 的p-distance 模型构建进化树。

表7 连接反应体系Table 7 Connection reaction system
2 结果
2.1 RT-PCR 扩增结果
通过RT-PCR 对两个分场样品进行PEDV S1 基因检测,结果显示,获得大小为2 396 bp 的目的片段,与预期大小一致,如图1 所示,2 份样品均为PEDV 阳性。

图1 PEDV S1 基因PCR 鉴定图Fig.1 The identification of PEDV S1 gene by PCR
2.2 胶回收鉴定结果
通过DNA 凝胶回收纯化试剂盒,纯化PEDV S1基因PCR 阳性产物,获得与预期大小相符的单一目的条带,如图2 所示。
2.3 菌落PCR 扩增结果
对挑取的单菌落进行菌落PCR 鉴定,琼脂糖凝胶电泳结果显示,扩增目的片段与预期的大小相符,获得阳性菌落,如图3 所示。

图2 PEDV S1 基因PCR 产物纯化鉴定图Fig.2 Product purification of PEDV S1 gene by PCR
2.4 PEDV S1 基因序列同源性分析
研究成功获得了2 株PEDV S1 基因序列,将成功克隆并测序的基因序列递交NCBI 的GenBank 数据库,获得GenBank 编号为MK395356 和MK395357,同源性分析显示鉴定毒株S1 基因的核苷酸同源性为98.3%,推导的氨基酸同源性为97.7%,与经典毒株CV777 相比,核苷酸序列同源性为91.4%~91.6%,推导的氨基酸同源性为89.8%~89.9%。分析显示实验鉴定毒株S1 基因与我国国内流行HGC-01-2015 毒株、HLJ-QTH-2018 毒株同源性较高,与早期经典毒株CV777、LZC 毒株、ZK-O 毒株同源性较低。PEDV S1 基因序列比对分析见表8。

图3 PEDV S1 基因菌落PCR 鉴定图Fig.3 The identification of PEDV S1 gene by colony PCR
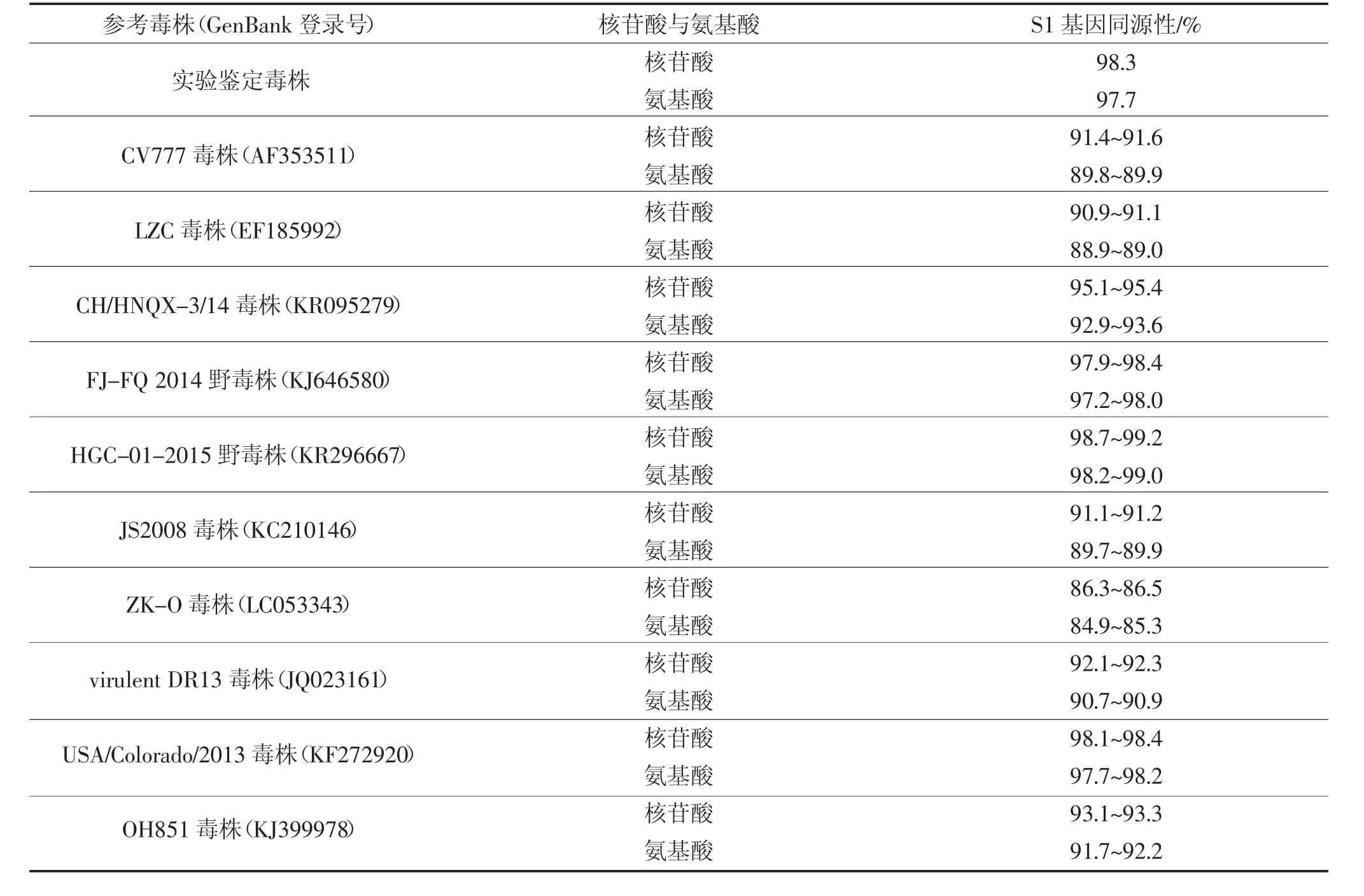
表8 PEDV S1 基因序列分析Table 8 Sequences analysis of S1 genes of PEDV strains

续表8 PEDV S1 基因序列分析Continued table 8 Sequences analysis of S1 genes of PEDV strains
2.5 PEDV S1 基因遗传进化性分析
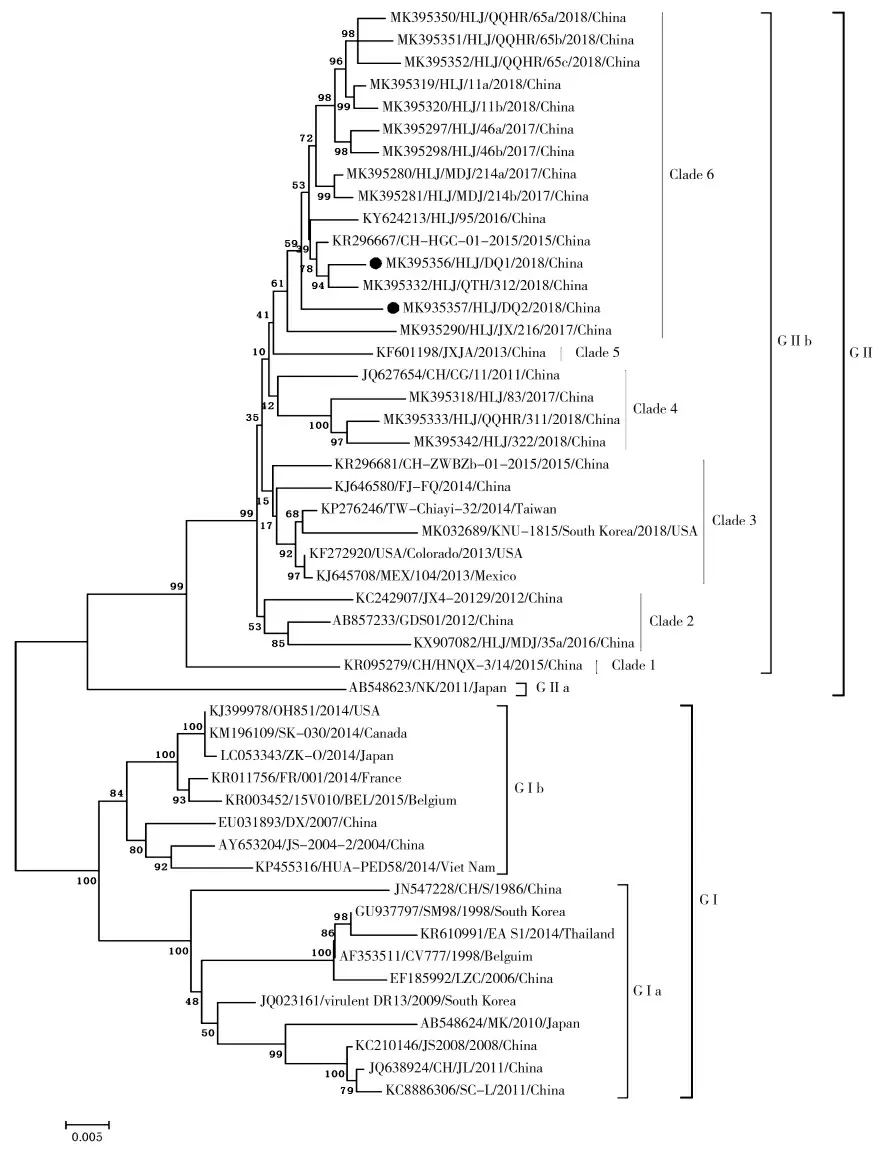
图4 PEDV S1 基因系统进化树Fig.4 The phylogenetic tree of PEDV S1 gene
PEDV S1 基因序列构建系统进化树,分成GⅠ群和GⅡ群,GⅡ群分成GⅡa 亚群和GⅡb 亚群,中国流行毒株以GⅡa 亚群和GⅡb 亚群为主[26]。试验鉴定的两株PEDV 毒株属于GⅡb 亚群第6 分支。GⅡb 亚群包括2011~2018 年中国部分流行毒株和美国高致病性毒株。实验鉴定毒株与GⅡb 亚群第6分支中2015~2018 年黑龙江省部分地区流行毒株亲缘关系最近,与GⅠ群中的经典CV777 毒株(Gen-Bank 登录号AF353511)、2013 年美国高致病性毒株(GenBank 登录号KF272920)亲缘关系远。PEDV S1基因系统进化树见图4。
3 讨论
PED 最早于英国暴发,但并未成功分离出病毒。20 世纪70 至80 年代,欧洲多次出现PED 流行。1982 年,日本首次出现PED 疫情[27]。1993~1994 年,猪流行性腹泻在日本再次流行[28],1996 年,PED 又一次席卷了日本,约有8 万头猪感染PED,导致50%以上病猪死亡,哺乳仔猪死亡率从30%上升至100%。1993 年,PED 在韩国被首次报道,来势汹涌,并呈现全国流行趋势,所有年龄段的猪均发生腹泻[29-30]。同年有研究人员对西班牙不同地区的794 个猪场采集的样品进行PEDV 血清学检测,结果显示PEDV 阳性率为29.6%,55.9%的猪场呈PEDV 抗体阳性[31]。2007 年,PED 疫情首次发生在泰国,在全国迅速流行,新生仔猪死亡率高达100%[32]。PED 疫情首次在美国暴发是在2013 年5 月,并迅速蔓延至美国14个州[33]。2010 年底,在我国南方地区许多猪场出现大规模、严重猪腹泻暴发,而后不断向北方蔓延,关于PEDV 的分子流行病学和遗传演化分析得到了深入的研究。
有研究人员从2011 年底到2014 年3 月,对云南、广西等29 个省份开展了猪群腹泻疫情流行病学调查,结果显示在收集的1383 份腹泻样品中,利用RT -PCR 方法检测到PEDV 阳性样本686 份(49.58%)[34]。自2015 年起,研究人员对中国22 个省市开展了长达三年的猪群腹泻疫情的流行病学调查,结果表明,在543 例腹泻样品中,66.85%(363/543)的腹泻样品为PEDV 阳性,除了PEDV 之外,在腹泻样品中还检测到了大量致病原,包括猪捷申病毒(porcine teschovirus,PTV)、猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)、猪萨佩罗病毒(porcine sapelovirus,PSV)、猪肠道病毒9/10(porcine enterovirus 9/10,PEV)、哺乳动物呼肠孤病毒(mammalian reovirus,MRV)、猪A 群轮状病毒(porcine group A rotavirus,GARV)、 猪 星 状 病 毒(porcine astrovirus,PAstV)、 猪 圆 环 病 毒(porcine torovirus,PToV)、猪细环病毒2 型(torque teno sus virus 2,TTSuV-2)、猪博卡病毒(porcine bocavirus,PBoV)、猪嵴病毒(porcine kobuvirus,PKV)和猪德尔塔冠状病毒(porcine deltacoronavirus,PDCoV);这些数据表明中国PED 的流行范围非常广泛,并且PEDV 是病毒性腹泻的主要病原[35]。1978 年,PEDV被确定为猪流行性腹泻(PED)的病原体[36]。该病的特征是急性水样腹泻、呕吐和脱水,死亡率很高,新生儿仔猪的死亡率常常高达100%[10]。猪流行性腹泻病毒(PEDV)是一种包膜、单股、正链RNA 病毒,属于α-冠状病毒属[17]。PEDV 的出现给我国乃至全世界造成了严重的经济损失,并造成了重大的公共卫生问题。
PEDV S 基因是编码PEDV 结构蛋白的基因中最易变异的基因[37]。S 基因被人为地划分为S1 基因和S2 基因,通过序列比对发现,S2 基因相对保守,而S1 基因变异性较高[38],S1 区比S2 区承受更大的免疫压力[24-25]。故S1 基因常被用作研究PEDV 变异情况的靶向基因。实验检测两份腹泻样品均为PEDV 阳性,说明该猪场两个分场均有PEDV 的流行。获得的PEDV 毒株S1 基因核苷酸与氨基酸同源性高达98.3%和97.7%,鉴定的PEDV S1 基因序列同源性与国内近几年流行毒株具有高度同源性,而与早期经典CV777 毒株同源性较低;PEDV S1 基因系统进化树分析显示,鉴定毒株与2015~2018 年的我国黑龙江省流行毒株亲缘关系较近,与2015 年前国外流行毒株亲缘关系较远。表明在该规模化猪场流行的PEDV 毒株为PEDV 变异株。经前期调查发现两个分场的所有生产母猪在分娩前42 天、21 天肌肉注射了疫苗厂生产的猪流行性腹泻-猪传染性胃肠炎二联灭活苗,而实验结果显示,该猪场流行毒株为PEDV变异株,以传统疫苗株免疫猪不能提供理想的免疫保护,并且两个分场之间一直有种猪运输,有研究表明,在PEDV 感染早期阶段,病毒可通过污染的车辆、污染的道路及污染物迅速感染健康猪群[39],以上因素均可导致新生哺乳仔猪发病率及病死率高。
目前,PEDV 具有较强的传染性,且毒株极易变异,此现象与PEDV 为RNA 病毒具有易变异的特性有很大关系[40],因此严格的生物安全措施为猪场提供了屏障,但是随着我国养猪规模的不断扩大,使得猪种调运频繁,引进种猪过程中部分猪场并未进行有效的隔离与检疫,带毒猪进入猪场后,PEDV 通过粪-口途径感染健康猪,被PEDV 污染的饲料、工具、水等也成为了重要的传染源,使得该病难以彻底消除,且呈持续性感染、逐年递增的趋势[41]。综上所述,猪场应定期消毒,禁止饲养工作人员在猪舍间频繁走动,以最大程度减少PEDV 的传播,同时引进不带毒的母猪,减少垂直传播的可能。猪场工作人员应提高饲养管理水平,做好定期检测,及时淘汰亚健康母猪,因此,对于PED 的防控需要注重猪场的生物安全,做好相关工作。
4 结论
该规模化猪场的两个分场PEDV 检测均呈阳性,且两个分场流行的毒株均为PEDV 变异毒株。

