生防细菌X33 的鉴定及产抑菌活性物质培养条件优化研究
刘诗宇,陈浩,王棋,张军政,宋金柱
(哈尔滨工业大学,哈尔滨 150000)
植物病害是农业生产的一项主要影响因素,现今全球各国在应对植物病害方面主要采取化学农药方法,然而化学农药的长期大量应用可导致诸多不良作用的出现,诸如抗药性、污染与残留等。人们希望一种兼有良好防治效果和和环境友好的防治新方法的出现[1]。近几十年来,生物防治因其对人畜无害、环境友好等特点,成为有效的防治方法,已被各国广泛采用[2-3]。
类芽孢杆菌属作为一种广泛存在于自然环境的、可以形成耐高温、耐旱、抗紫外线内生孢子的好氧-兼性厌氧细菌,是筛选生防菌的优质对象[4]。多粘类芽孢杆菌(Panebacillus polymyxa)为类芽孢杆菌的模式菌种,其作为根际细菌发挥着重要的积极作用[5]。在对诸多不同植物病害进行防治时,多粘类芽孢杆菌可释放诸多不同抗菌成分,包括蛋白类、酚类、肽类、吡嗪类与核苷类等,能够发挥关键性抑菌效能[6-10]。另外,其能够自土壤内移动定殖于植物根部[11],宿主植物能够经由此菌固氮与溶磷效能获取营养成分[12]。同时,为了明确田间环境下相关菌种的抑菌活性,学者还开展了田间试验,所得结果显示,在稳定性、兼容化学农药性、防效一致性等方面,相较真菌与非芽孢杆菌生防菌,芽孢杆菌生防菌剂表现出明显优势[13-18]。
研究通过平板对峙法,从黑龙江省凉水自然保护区筛选出一株具有广谱抑菌效果的拮抗菌株,经鉴定为多粘类芽孢杆菌。下一步对该菌株进行单因素实验和正交试验的发酵条件优化,用以提高其抗菌能力,同时也为后续研究该抑菌物质的性质和结构、防病机理等奠定基础。
1 材料与方法
1.1 实验材料
拮抗菌株为X33,课题组在黑龙江省凉水自然保护区分离并保存。尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)、杨树叶片枯萎病菌(Alternaria tenuissima)、西红柿镰刀菌(Fusarium oxysporum)、甜瓜枯萎病菌(Fusarium oxysporum f.Sp.melonis)等病原真菌均由实验室保存。
实验所用培养基为PDA 培养基、BPY 培养基、LB 培养基[19]。
1.2 实验方法
1.2.1 芽孢杆菌的分离、纯化及拮抗细菌的筛选
1.2.1.1 细菌的分离纯化与保存
取2 g 植物根际土壤加入10 mL 无菌水充分研磨,将研磨液按照10-2,10-3,10-4,10-5等4 个梯度进行稀释,分别取100 μL 涂布于固体LB 平板,各浓度重复实验3 次。根据颜色、形态、大小等特征,挑取单菌落纯化保存。
1.2.1.2 拮抗细菌的筛选
选择对峙培养法,将4 类病原菌(A.tenuissima、R.solani、F.oxysporum、F.oxysporum f.Sp.melonis) 的菌饼(直径为7 mm)分别放到PDA 平板核心处,选择良好纯化的菌种点接于同平板相距3 cm 的4 个角上,接着于28 ℃温度中进行1 周培养,再对抑菌带宽进行测定。各处理皆安排3 个重复。将有效抑制病原菌生长,同时边缘平齐,具备持久拮抗效应的菌株挑选出来。
1.2.1.3 形态学观察
对筛选所得拮抗芽孢杆菌开展革兰氏染色观察与芽孢染色处理,借助光学显微镜与扫描电镜,对菌体形态特征进行观察。
1.2.1.4 生化鉴定
在生理生化测定环节,皆参考《伯杰氏细菌鉴定手册》与《常见细菌鉴定手册》[20]所示方法。
1.2.1.5 PCR 鉴定
借助细菌DNA 提取试剂盒进行X33 基因组DNA 的提取。PCR 扩增环节所用引物为27F-Fan:5′-GTAAAACGACGGCCAGT-3′以及1492R:5′-CAG GAAACAGCTATGAC-3′,并完成0.05 mL 反应体系扩增16S rDNA 序列片段的制备。以下为0.05 mL PCR反应体系:5 μL 的buffer(10×),5 μL 的dNTP(2.5 mM),以及皆为2 μL 的27F-Fan、1492R、DNA 模板,还有33.6 μL 的双蒸水、0.4 μL 的Taq DNA 聚合酶。以下为PCR 扩增条件:于95 ℃下停留0.5 min;于52 ℃下停留0.5 min;于72 ℃下停留1.5 min;于72 ℃下停留10 min,共计30 个循环。待对PCR 扩增产物完成切胶纯化回收处理,同菌株16S rDNA 开展序列比对分析。
1.2.2 发酵上清液的制备
取出部分培养于LB 培养基内的种子液,接种至BPY 培养基内,接种量为1%。接着于37 ℃温度下行2 d 培养(期间转速为180 rpm),再实施25 min 的高速离心处理(温度与转速分别为4 ℃、15 000 r·min-1),之后将沉淀舍弃,借助滤膜(0.22 μm)过滤上清,得到发酵上清液[10]。
1.2.3 抑菌效价的测定
测定方法为菌丝生长速率法,具体为:把无菌的发酵上清液和熔融态PDA 培养基(温度约为55 ℃)根据1∶10 的量充分混合,再移至平板上。打取直径7 mm的植物病原菌菌饼倒置于平板中央[10]。在28 ℃条件下倒置培养7 d 后,通过十字交叉法测定菌落直径,并计算抑菌率。每组3 次重复。
抑菌率(%)为“对照组菌落直径”与“实验组菌落直径”的差值同“对照组菌落直径”之比。
1.3 培养基的优化
1.3.1 培养基成分和培养条件的优化
碳源的筛选:BPY 培养基所含葡萄糖分别用甘露醇(1%)、糊精、蔗糖、麦芽糖、乳糖与可溶性淀粉替代,其他成分不做调整[10]。向液体培养基内接种种子液,接种量为1%,之后于37 ℃温度下,进行2 d 培养(期间转速为180 rpm),再进行无菌上清液的提取。借助菌丝生长速率法测定抑菌率,各组处理皆安排3遍重复。
氮源的筛选:BPY 培养基内蛋白胨分别用1%的NaNO3、NH4H2PO4、NH4Cl 与(NH4)2SO4替代,其他条件参考碳源筛选部分,各组处理皆安排3 遍重复。
无机盐的筛选:BPY 培养基所含NaCl 分别用LiCl、MgCl2、KCl 与CaCl2替代,其他条件参考碳源筛选部分,各组处理皆安排3 遍重复。
多因素正交试验:将经单因素实验确定最优碳源、氮源与无机盐当做变异因素,借助L9(34)正交表,开展培养基配方优化试验,评判指标为“抑菌率”,对各组分培养最优配比加以明确。
1.3.2 培养条件的优化
将已优化的培养基当做发酵培养基,考察指标为“抑菌率”,优化X33 菌株各项发酵条件,包括接种量、装液量、温度、发酵时间、初始酸碱度等。接种量分别设置为装液量的1%、2%、3%、4%、5%、6%、7%和8%;温度等级包括25、28、31、34、37、40、43 ℃;在培养基初始酸碱度上,等级包括4、5、6、7、8 与9;发酵时间分别设置为12、24、36、48、60、72、84 和96 h;在250 mL 锥型瓶中,分别装入25、50、75、100、125和150 mL 发酵培养液。每组处理重复三次,测定抑菌率。
1.4 色谱分析
对未优化时与已优化的发酵液成分开展色谱分析。此环节应用到反相色谱柱Agilent。在流动相方面,A、B 依次是H2O、乙腈,两者皆内含0.5%的甲酸。梯度洗脱步骤:0~2 min 时,B 为5%,2~6 min 时,B上调到99%,6~10 min 时,B 为99%,10~10.1 min时,B 下调到5%,10.1~12 min 时,B 为5%;设定的柱温、流速分别为30 ℃、0.6 mL·min-1,在线性洗脱方面,设定的测定波长、进样量依次是214 nm、0.02 mL。
2 结果与分析
2.1 拮抗细菌的筛选
通过反复分离纯化,最终筛选得到了一株具有广谱抑菌活性的X33 菌株,对杨树叶枯病菌、立枯丝核菌、西红柿镰刀菌、甜瓜枯萎病菌等4 种病原真菌具有显著的拮抗作用,呈现出明显的抑菌圈(图1)。相应的抑菌半径分别为(12.2±0.8)mm、(11.5±0.3)mm、(11.2±0.4)mm、(11.8±1.4)mm。

图1 对4 种病原真菌的抑制作用Fig.1 Inhibition of four pathogenic fungi
2.1.1 菌落形态及镜检染色结果
对菌落大小与形态进行查看,借助光学显微镜查看X33 的个体形态、芽孢染色与革兰氏染色结果。观察结果如图2 所示。鉴定结果表明:拮抗菌株X33在PDA 培养基上生长良好,菌落不透明,边缘不规则,表面有褶皱,乳白色,隆起,有粘性。显微镜与扫描电镜显示菌体细胞呈杆状,有荚膜与芽孢产生。革兰氏反应显示阳性。
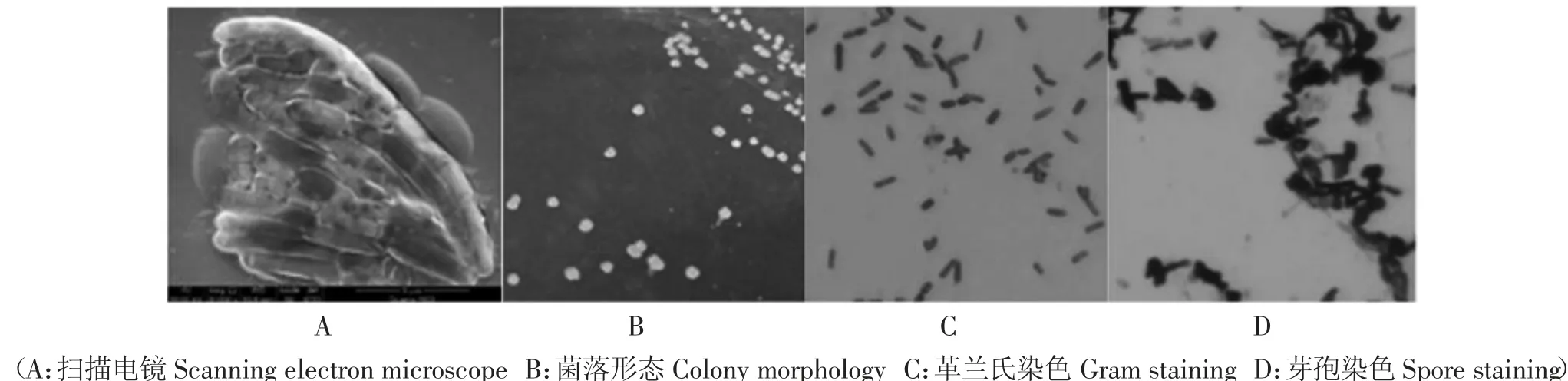
图2 形态学观察结果Fig.2 Morphological observation
2.1.2 生理生化实验结果
甲基红实验、厌氧生长实验、碳源利用实验、硫化氢实验、柠檬酸盐利用试验、触酶反应、淀粉水解及明胶液化实验等皆显示阳性。耐盐性实验中,当NaCl 浓度达到5%时不能生长,柠檬酸盐实验和动力培养基实验为阴性(表1)。测量结果和常见的细菌系统鉴定手册中的多粘类芽孢杆菌相符合。

表1 X33 菌株的生理生化鉴定Table 1 Physiological and biochemical identification of X33 strain
2.1.3 PCR 鉴定结果
使用试剂盒对X33 菌株的基因进行提取,电泳结果显示条带大小约为15 000 bp。X33 菌株用Eubac27F 和Eubac1492R 为引物进行PCR 扩增,电泳结果显示在1 500 bp 处有特异性条带。测序结果显示X33 菌株16S rDNA 序列长度是1 547 bp,在NCBI 内借助BLAST 同一些已录入菌株的16S rDNA基因序列开展相似性对比,发现对比多粘类芽孢杆菌,可达99%的相似度。
参考以上个体形态、革兰氏染色结果、菌落形态表现、芽孢染色观察结果,同时基于分子学鉴定与生理生化表现,可以确定筛选得到的拮抗菌株X33 为多粘类芽孢杆菌(Paenibacillus polymyxa)。
2.2 培养基的优化
2.2.1 发酵培养基成分优化
对于X33 代谢抑菌活性的影响,不同碳源有着显著区别。当碳源选择甘露醇时,可实现最强的发酵滤液抑菌活性,达33%抑菌率;当碳源为麦芽糖时,发酵滤液显示为最低抑菌活性。因此选用甘露醇作为碳源(图3)。不同氮源的发酵滤液均有抑菌效果。以NH4Cl 为氮源时,发酵滤液抑菌活性最强,抑菌率可达28%;以NaNO3为氮源时,抑菌活性最差。故氮源选择NH4Cl(图4)。对于X33 抑菌活性的影响,不同无机盐有所区别。NaCl 为无机盐时,抑菌效果最好,抑菌率达到27%;MgCl2为无机盐时,抑菌效果最差。因此选用NaCl 作为无机盐(图5)。

图3 不同碳源对多粘类芽孢杆菌X33 菌株的发酵的影响Fig.3 Effects of different carbon sources on fermentation of X33 strain

图4 不同氮源对多粘类芽孢杆菌X33 菌株发酵的影响Fig.4 Effects of different nitrogen sources on fermentation of X33 strain

图5 不同无机盐对多粘类芽孢杆菌X33 菌株的影响Fig.5 Effects of different inorganic salts on Bacillus polymyxa X33 strain
经由以上单因素实验,对最佳碳源、氮源与无机盐进行了明确。为了使配方更具优化性,借助L9(34)正交表进行正交试验的设计,考察指标为“发酵滤液的抑菌活性”,对培养基内各组分最优配比加以明确。经极差分析发现,A>B>C,可见,在影响抑菌活性程度方面,甘露醇影响力最大,其次为NH4Cl,影响力最弱的为NaCl。处理组内,最优水平组合是A2B1C2,具体为:H2O、NH4Cl、甘露醇、酵母粉、牛肉膏、NaCl依次为0.1 L、0.9、0.7、0.5、0.5、0.3 g。
然基于K 值确定的理论最优水平组合则是A2B1C1,并未出现于正交试验表内。依然应在此基础上接着进行对比优化,结果显示,就抑菌率而言,相比组合A2B1C2,组合A2B1C1偏高。因此X33 菌株产抑菌物质的最佳培养基配方为甘露醇0.7 g、NH4Cl 0.9 g、NaCl 0.1 g、牛肉膏0.5g、酵母粉0.5g、H2O 100 mL。这时,对尖孢镰刀菌可实现43.2%的抑菌率,并上调防治效果至88%。下表所示为正交试验结果。
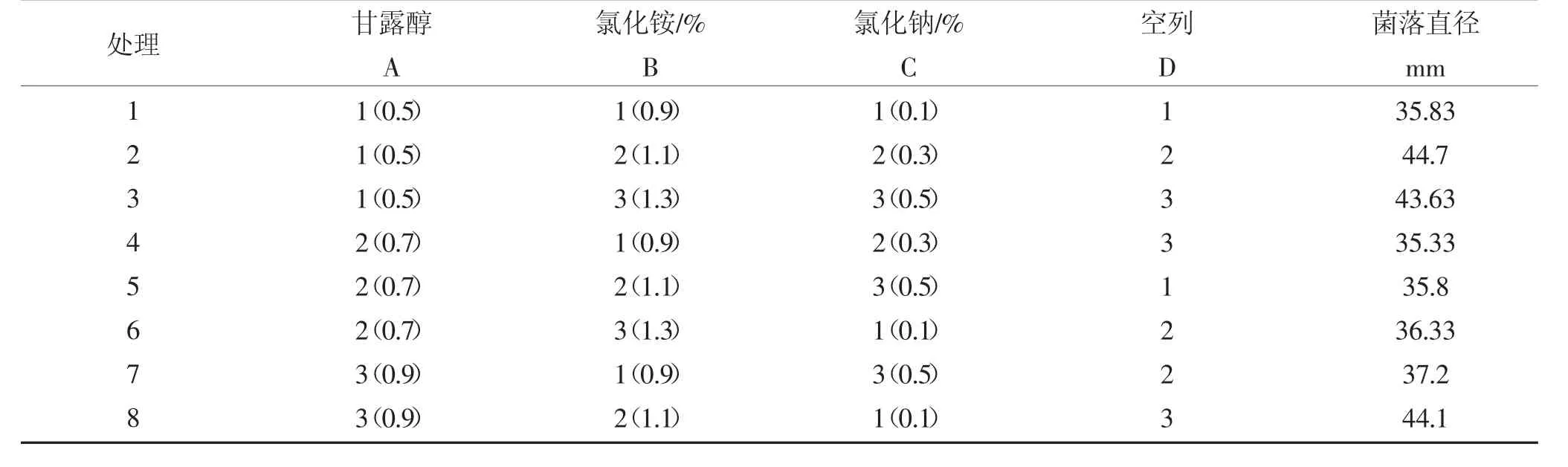
表2 发酵培养基成分的正交设计L9(34)Table 2 Orthogonal design of fermentation medium components L9(34)

续表2 发酵培养基成分的正交设计L9(34)Continued table 2 Orthogonal design of fermentation medium components L9(34)
2.2.2 发酵培养基条件的优化
2.2.2.1 接种量对发酵液抑菌活性的影响
当接种量小于6%时,其正向相关于X33 菌株发酵液的抑菌活性;若接种量为6%,可实现最强抑菌活性,达53.7%抑菌率。若接种量在6%以上,其负向相关于抑菌活性。原因可能为,接种量过高使得营养成分消耗过多,对其次级代谢物质的产生不利。故可确定6%是最佳接种量(图6)。
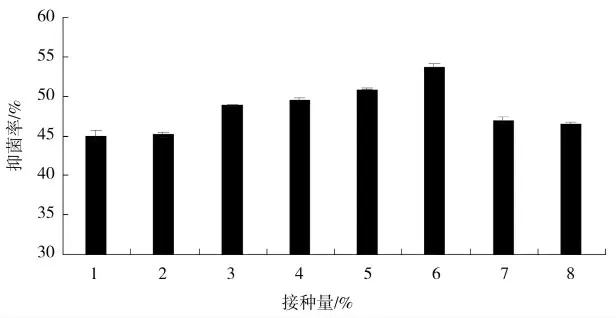
图6 接种量对多粘类芽孢杆菌X33 菌株的影响Fig.6 Effect of inoculum size on Bacillus polymyxa X33 strain
2.2.2.2 温度对发酵液抑菌活性的影响
温度条件在一定程度上影响发酵液的抑菌活性。当温度处于25~43 ℃范围时,X33 菌株皆可生长,同时在31 ℃培养温度下,可实现最强发酵液抑菌活性,达53%抑菌率(图7)。当温度为25 ℃时,显示为最低抑菌活性。可见,31 ℃为最佳培养温度。

图7 温度对多粘类芽孢杆菌X33 菌株的影响Fig.7 Effect of temperature on Bacillus polymyxa X33 strain
2.2.2.3 初始pH 值对发酵液抑菌活性的影响
X33 菌株在pH4~9 时均可生长,在酸性条件下,均保持了较好的抑菌活性。在酸碱度上调下,前期抑菌活性为升高表现,后期则为不断降低。若酸碱度为8,可实现最高抑菌活性,达53%抑菌率(图8)。

图8 初始pH 值对多粘类芽孢杆菌X33 菌株的影响Fig.8 Effect of initial pH on Bacillus polymyxa X33 strain
2.2.2.4 发酵时间对发酵液抑菌活性的影响
从12~72 h 的时间段内,随着培养时间的增加,发酵液抑菌活性逐渐增强,并在第72 h 时达到峰值,抑菌率为51%(图9);此后,抑菌活性为不断轻微降低表现,这可能是因为培养时间过长使得营养成分大量消化,对次级代谢产物的积累不利。
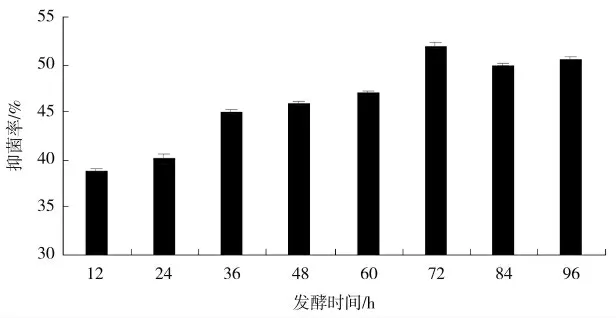
图9 发酵时间对多粘类芽孢杆菌X33 菌株的影响Fig.9 Effect of fermentation time on Bacillus polymyxa X33 strain
2.2.2.5 装液量对发酵液抑菌活性的影响
若250 mL 锥形瓶为100 mL 的装液量,显示为最强发酵液抑菌作用,能够实现43.8%的抑菌率。若装液量增加至150 mL,发酵液抑菌性减弱,可见,X33菌株产代谢产物需具备一定的通气量条件。对装液量做出最佳选择,对菌株生长与发酵有利,此项研究明确的最适宜装液量为250 mL 锥形瓶内100 mL 的装液量(见图10)。

图10 装液量对多粘类芽孢杆菌X33 菌株的影响Fig.10 Effect of liquid volume on Bacillus polymyxa X33 strain
2.3 色谱分析
继续对优化前后的发酵液成分进行液相分析。由图11 知,在此梯度洗脱条件下,发酵产物得到了很好的分离,峰形对称且尖锐。已经优化的发酵液于第1 min 时、第2 min 时与第4.5 min 时,不管峰高抑或峰面积皆相比未优化时偏大。可见,此3 类次级代谢产物经过优化在积累量上有所升高,可能同抑菌活性增强存在直接关系。待至第7.5 min 时,已优化的基线峰高继续升高,然面积继续减少。可见,优化期间相关旁路代谢受到了抑制,显著提升了某一具体成分的分泌和积累,从而提升了抑菌活性。
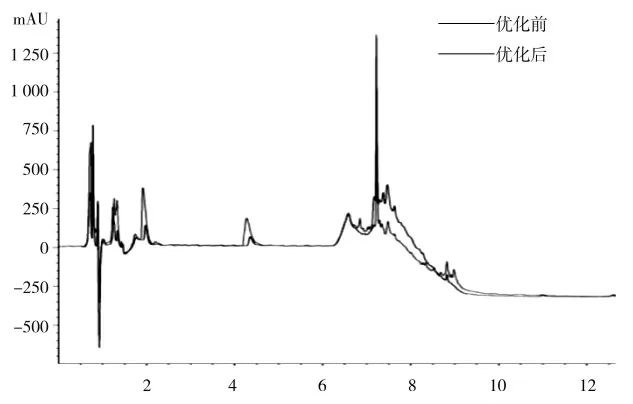
图11 发酵液的色谱分析Fig.11 Chromatographic analysis of fermentation liquid
3 讨论
现今,在全球研究生防微生物方面,芽孢杆菌已成为研究主流。经研究,Liang 等[21]发现,蜡状芽孢杆菌可较强抑制葡萄孢菌,在抑制葡萄孢菌方面,其发酵液可实现75.8%的抑制率。樊陈等[22]对地衣芽孢杆菌LY12 进行了研究。并从其发酵液中分离得到了一种的抗菌肽,其显示很好的抑菌效果,包括革兰氏阴性细菌、革兰氏阳性细菌和真菌。
课题筛选得到了一株具有广谱抑菌活性的多粘类芽孢杆菌(Paenibacillus polymyxa),并对其培养基成分和发酵条件进行优化,抑菌率可超过50%。同时多粘类芽孢杆菌还具有促生作用,从而提高农作物的整体健康水平,增强其对病害致病菌的抵御能力,具有实际应用的潜力。液相色谱分析的结果也很好地佐证了抑菌能力的提升主要是因为4 类次级代谢产物的积累明显增加。但是并未对这4 类物质进行进一步的分离纯化,并未得知具体某一种或哪几种物质共同起抑菌作用。为了更好地利用类芽孢杆菌防治植物病害,仍需要深入的了解生防芽孢杆菌的防病机理,研究其抑菌调控体系;改良类芽孢杆菌的功能基因,通过基因工程的手段对目的基因进行克隆表达,增强其抑菌活性;开展芽孢杆菌生防制剂的研究,使其具有良好的储存行和实用性。在这些方面加以突破,使其更快应用于田间。
4 结论
研究筛选得到一株具有广谱抑菌活性的多粘类芽孢杆菌(Paenibacillus polymyxa)。为了进一步探究其生防潜能,通过正交试验获得最适宜X33 菌株抑菌产物的发酵配方为甘露醇7 g·L-1,NH4Cl 9 g·L-1,NaCl 1 g·L-1,牛肉膏5 g·L-1,酵母粉5 g·L-1。此时,在抑制尖孢镰刀菌方面,可实现43.2%的抑菌率,与基础培养基相比,在抑菌率方面上调了88%。在发酵方面,最佳条件为:接种量6%、培养时间3 d、初始酸碱度8、培养温度31 ℃、装液量100 mL·250 mL-1。当处于上述最优条件时,能够实现50.44%的抑菌率,使抑菌率上调了119.3%。

