UV-C处理对鲜切‘皇冠’梨褐变的影响
陈晨,姜爱丽,刘程惠,赵琪琪,张艳慧,胡文忠
UV-C处理对鲜切‘皇冠’梨褐变的影响
陈晨,姜爱丽,刘程惠,赵琪琪,张艳慧,胡文忠
(大连民族大学生命科学学院/生物技术与资源利用教育部重点实验室,辽宁大连 116600)
【】探索UV-C预处理后鲜切和鲜切后UV-C辐照两种方式对鲜切梨褐变的控制效果及其生理机制,为鲜切梨的贮藏保鲜以及扩大UV-C在果蔬方面的应用提供理论依据。以鲜切‘皇冠’梨为研究对象,分别在鲜切前、后采用UV-C(有效波长254 nm)辐照处理5 min,分析在5℃贮藏过程中,两种方式UV-C处理后鲜切梨的褐变程度(BI)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性、总酚含量、抗氧化相关酶(超氧化物歧化酶(SOD)、过氧化氢酶CAT、抗坏血酸过氧化酶APX、谷胱甘肽还原酶GR)活性、H2O2和丙二醛(MDA)含量以及非酶抗氧化能力(DPPH、ABTS自由基清除能力和还原能力)的变化。与对照相比,两种UV-C处理均能显著抑制鲜切梨的褐变,其中鲜切后UV-C处理控制效果更好。两种UV-C处理均不同程度提高鲜切梨的PPO活性、降低PAL活性和总酚含量,同时提高鲜切梨的抗氧化酶活性以及非酶抗氧化能力,抑制了H2O2和MDA的积累。相关性分析显示,鲜切梨的BI值与CAT、APX和GR活性以及非酶抗氧化能力呈极显著负相关(<0.01),与H2O2和MDA含量呈极显著正相关(<0.01)。UV-C处理主要通过提高鲜切梨的抗氧化防御能力从而延缓贮藏过程中的表面褐变,两种处理方式相比,鲜切后UV-C处理更能有效提高鲜切梨的抗氧化能力,对褐变控制效果更好。
鲜切梨;褐变;UV-C;生理机制
0 引言
【研究意义】近年来,鲜切果蔬由于其方便、快捷、卫生、营养等优点,深受国内外消费者喜爱。但鲜切操作,例如去皮、切分等,会引发果蔬发生一系列复杂的生理变化,从而加速果蔬衰老和品质劣变。其中切割伤害引起的表面褐变是包括鲜切梨在内的多种鲜切果蔬品质下降以及货架期缩短的主要因素之一,也是目前鲜切果蔬加工和贮藏过程中面临的重要问题[1-2]。因此,探索一种有效的保鲜方法来延缓鲜切果蔬在贮藏期间的表面褐变,对延长其货架期具有重要意义。【前人研究进展】鲜切果蔬表面褐变是一个复杂的过程,一般认为鲜切操作破坏了果蔬组织结构,使细胞空间区域化丧失,打破了原来多酚氧化酶(PPO)与其底物酚类物质的分区定位,从而使酶与底物接触,导致酶促褐变反应的发生[3-4]。近年来的研究表明鲜切操作引起活性氧(ROS)的大量产生,导致膜脂过氧化,从而破坏膜结构,加剧酶促褐变反应。提高抗氧化能力能够有效降低ROS积累,从而减轻膜脂过氧化,降低褐变程度[5-7]。因此,酚酶反应、ROS过量产生、膜脂过氧化、抗氧化系统损伤与鲜切果蔬表面褐变具有重要关系。短波紫外线(UV-C)是一种被认为安全的(GRAS)杀菌技术,目前已允许其应用于多种食品的表面杀菌[8],适宜计量的UV-C处理还能有效控制多种鲜切果蔬贮藏期间的表面褐变,但褐变控制机理各不相同。例如适宜计量的UV-C可以降低PPO、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)活性,减轻细胞损伤,从而抑制鲜切莲藕和鲜切杨桃的褐变[9-10]。Huang等[11]研究发现UV-C处理通过降低PPO和POD活性,同时提高PAL活性、总酚含量和抗氧化能力来有效控制鲜切百合的褐变。笔者前期研究发现,UV-C处理也能有效延缓鲜切苹果贮藏期间的褐变,但是并不能抑制其PPO活性[12],进一步研究认为,UV-C主要是通过提高抗氧化防御系统,调节ROS代谢抑制鲜切苹果褐变[13]。【本研究切入点】目前UV-C对鲜切果蔬的褐变控制研究均为鲜切后UV-C处理,完整果蔬UV-C预处理后鲜切的研究尚未见报道。同时,针对不同鲜切果蔬产品,UV-C控制其褐变的生理机制也不尽相同。【拟解决的关键问题】本研究以鲜切梨为研究对象,采用UV-C预处理后鲜切以及鲜切后UV-C处理两种方式,动态监控贮藏期间鲜切梨的褐变程度,同时分析与褐变相关生理指标的变化,系统研究两种UV-C处理方式对鲜切梨褐变控制的生理机制,为鲜切梨的贮藏保鲜以及扩大UV-C在果蔬方面的应用提供理论依据。
1 材料与方法
试验于2017年5月至2018年4月在大连民族大学生命科学学院进行。
1.1 材料与试剂
‘皇冠’梨:购于大连经济技术开发区乐购超市,选择大小均一、色泽均匀、无病虫害、无机械损伤、表面光滑的梨果进行试验;过氧化氢、无水乙醇、丙酮、福林酚、愈创木酚、苯丙氨酸、硝普钠、聚乙烯吡咯烷酮、硫代巴比妥酸、三聚乙酸、邻苯二酚等试剂(分析纯),购于天津市科密欧化学试剂开发中心;GR、SOD试剂盒,购于苏州科铭生物技术有限公司。
1.2 仪器与设备
CR400/CR410型色差计,日本Konica Minolta公司;电子分析天平AL240,瑞士Mettler Toledo公司;电热恒温水浴锅DK-S26、电热恒温鼓风干燥箱DHG- 9053A,上海精宏实验设备有限公司;紫外可见分光光度计UV-9200,北京瑞利分析仪器有限公司;匀浆机T-25,德国IKA;台式高速冷冻离心机BR4i,法国Jouan;制冰机SiM-F140,日本三洋。
1.3 样品预处理
将‘皇冠’梨随机分成3组:第一组‘皇冠’梨置于紫外灯(有效波长为254 nm)下35 cm处照射5 min,随后于5℃冷库贮藏12 h,用灭菌的削皮刀去皮去核切割成约1.5 cm3的小块,为预UV-C处理组;第二组‘皇冠’梨置于5℃冷库贮藏12 h后,按照与第一组相同的操作进行鲜切处理,再采用UV-C辐照处理,为UV-C处理组;第三组‘皇冠’梨置于5℃冷库贮藏12 h后鲜切,作为对照。每组处理量为220块鲜切样品,设置3个重复,将3组处理后的鲜切梨分别放入一次性托盘中并用保鲜膜包好,置于5℃冷库中贮藏。定期取样用于分析生理生化变化。
1.4 生理指标的测定
1.4.1 褐变指数 褐变指数(BI)的测定采用色差计测定*、*、*值,根据公式计算[14]。
BI=[100(x-0.31)]/0.172
x=(a*+1.75 L*)/(5.645 L*+a*-3.012 b*)
1.4.2 H2O2含量测定 H2O2含量的测定参考Patterson等[15]的方法。3 g样品加入5 mL丙酮均质,4℃下10 000 r/min离心20 min。取1 mL上清液加入0.1 mL四氯化钛的浓盐酸溶液和0.2 mL浓氨水,混合液10 000 r/min离心15 min,取沉淀溶于3 mL H2SO4中,410 nm下测定吸光值,以H2O2绘制标准曲线并计算,结果用μmol∙g-1表示。
1.4.3 总酚含量测定 总酚含量(TPC)的测定采用福林酚法[16]。5 g样品加入25 mL 75%乙醇超声提取40 min,4℃下10 000 r/min离心20 min,上清液用于测定总酚含量和抗氧化活性。取1 mL上清液加入福林酚试剂0.2 mL,快速混匀后加入20% Na2CO3溶液1 mL,充分混匀,室温避光放置30 min,在760 nm下测定吸光值,以没食子酸作为标准品绘制标准曲线并计算。样品中的总酚含量用mg/100 g表示。
1.4.4 酶活性测定 PPO、CAT和APX活性测定参考Chen等[17]的方法,PAL活性测定参考李雪等[18]的方法,GR、SOD测定采用试剂盒法。
酶液提取:5 g样品分别加入20 mL不同酶提取液均质后,4℃下12 000 r/min离心30 min,上清液用于酶活性测定。PPO、CAT提取液为0.2 mol∙L-1pH 6.4 磷酸缓冲液(含1 g聚乙烯吡咯烷酮);APX提取液为0.1 mol∙L-1pH 7.5磷酸缓冲液(含1 mmol∙L-1EDTA和3 mmol∙L-1抗坏血酸);PAL提取液为0.1 mol∙L-1pH 8.7的硼酸钠缓冲液(含0.037% EDTA、0.137%-巯基乙醇、3%聚乙烯吡咯烷酮),GR和SOD提取液分别来自苏州科铭生物技术有限公司生产的GR和SOD活性测定试剂盒。
PPO活性测定:按顺序依次加入2.4 mL 50 mmol∙L-1乙酸-乙酸钠缓冲液(pH 5.5)、0.6 mL 50 mmol∙L-1邻苯二酚、0.1 mL酶液,420 nm扫描3 min吸光值变化,以每min下降1个吸光值作为一个酶活性单位(U)。
CAT活性测定:依次加入1.9 mL 0.1 mol∙L-1磷酸缓冲液(pH 7.8)、0.1 mL酶液、0.3 %H2O2,240 nm扫描3 min吸光值变化,以每min下降0.01吸光值作为1 U。
APX活性测定:依次加入2.6 mL 50 mol∙L-1磷酸缓冲液(pH 7.5,含0.1 mmol∙L-1EDTA、0.5 mmol∙L-1抗坏血酸)、0.1 mL酶液、0.3 mL 2 mmol∙L-1H2O2,290 nm扫描3 min吸光值变化,以每min下降0.01吸光值作为1 U。
PAL活性测定:按顺序依次加入3 mL 50 mmol∙L-1硼酸-硼砂缓冲溶液(pH 8.8)、0.5 mL 20 mmol∙L-1L-苯丙氨酸溶液、0.5 mL酶液,37℃孵育60 min,分别在孵育前后290 nm测定吸光值,以每h下降0.01吸光值作为1 U。
1.4.5 抗氧化能力 抗氧化能力采用DPPH自由基和ABTS自由基清除能力以及还原能力3种方法进行测定[19]。
DPPH自由基清除能力测定:0.1 mL多酚提取液加入3.9 mL 0.1 mmol∙L-1DPPH溶液中,混合后室温静置30 min,于517 nm测定吸光值。
ABTS自由基清除能力测定:2.45 mmol过硫酸钾与等体积7 mmol∙L-1ABTS混匀后避光放置12—16 h,适当稀释后使其在734 nm下吸光值约为0.7,即为ABTS工作液,将0.1 mL样品加入3.9 mL ABTS工作液中,反应5 min后在734 nm测定吸光值。
还原能力测定:将300 mmol∙L-1乙酸缓冲液(pH 3.6)、40 mmol∙L-1TPTZ溶液(用10 mmol∙L-1HCl配制)和20 mmol∙L-1FeCl3溶液以10﹕1﹕1的比例混合制得FRAP工作液。待测样品提取物与FRAP工作液以1﹕30(v﹕v)的比例混合后37℃保温5 min,于593 nm测定吸光值。以Trolox作为标准品绘制标准曲线并计算,测定结果以每g样品相当于Trolox的物质的量(μmol)表示。
1.4.6 MDA含量 MDA含量的测定参考Ren等[20]的方法。2 g样品加入100 g∙L-1三氯乙酸溶液均质,4℃下13 000 r/min离心20 min,2 mL上清加入2 mL硫代巴比妥酸溶液煮沸20 min,冷却,分别于450、532和600 nm下测定吸光值。MDA含量如下公式计算,其中,:提取液总体积(mL);:测定时所取样品提取液体积(mL);:样品重(g)。
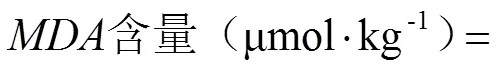
1.5 数据处理与分析
采用SPSS17.0软件对所有数据进行统计分析,利用邓肯氏多重比较法对不同处理组样品进行差异显著性分析,<0.05表示差异显著,生理指标相关性采用Pearson相关性分析。采用origin 9.0软件绘图。
2 结果
2.1 UV-C处理对鲜切梨褐变程度的影响
表面褐变是影响鲜切梨货架期的重要因素之一。如图1所示,鲜切梨在贮藏初期呈亮白色,当贮藏至第12天时,3组样品均发生了不同程度的褐变,但两种UV-C处理组的褐变程度均低于对照组样品。与表观颜色变化相对应,鲜切梨的褐变指数(BI)在贮藏期间均呈上升趋势,但两种UV-C处理组样品的BI值上升较慢,且在12 d的贮藏过程中均显著低于对照组(<0.05),鲜切后UV-C处理组的BI值低于预UV-C处理,说明鲜切后UV-C处理更能有效控制鲜切梨贮藏期间的褐变。
不同字母表示处理间差异显著(P<0.05)。下同 Different alphabets are significantly (P<0.05) different among different treated samples. The same as below
2.2 UV-C处理对鲜切梨PPO活性的影响
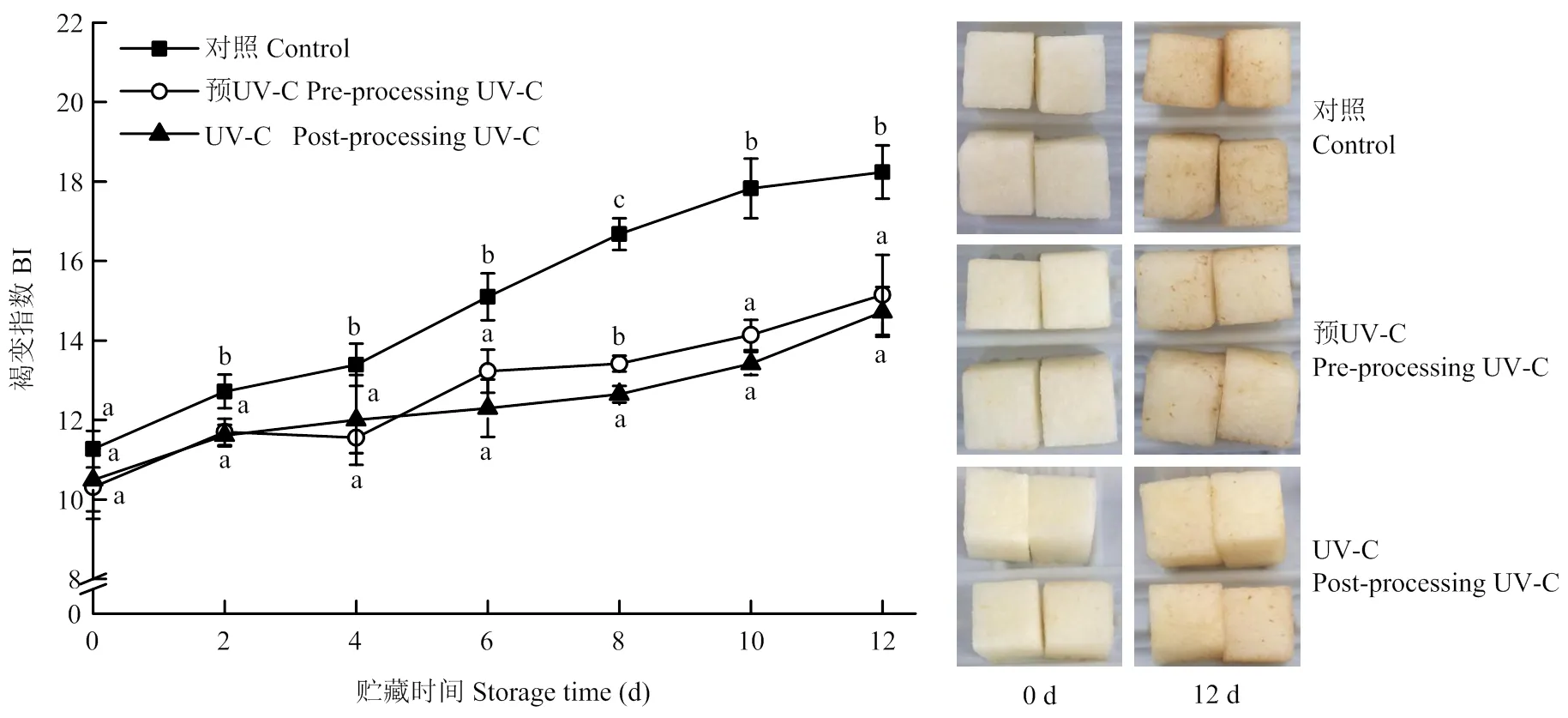
PPO是引起鲜切果蔬组织褐变的关键酶,如图2所示,鲜切梨的PPO活性在贮藏前2 d天略有下降,随着贮藏时间的延长,呈先上升后下降的趋势。两种UV-C处理组样品在贮藏前8 d时PPO活性要显著高于对照组,说明UV-C处理能够加速鲜切梨PPO的合成,其中预UV-C处理诱导PPO合成能力高于鲜切后UV-C处理,但同时其PPO活性下降也较快,当贮藏8 d以后显著低于对照组样品(<0.05),而鲜切后UV-C处理组在贮藏后期(10—12 d)PPO活性与对照组无显著差异(>0.05)。
2.3 UV-C处理对鲜切梨总酚含量和PAL活性的影响
多酚类物质是水果中重要的抗氧化物质,同时也是酶促褐变的底物。如图3-a所示,鲜切梨贮藏过程中多酚类物质的含量呈先上升后下降的趋势。机械伤害能够诱导多酚类物质的合成[21-22],因此,在贮藏初期,总酚含量上升,随着贮藏时间延长,褐变程度加深,多酚类物质不断被消耗,含量逐渐下降。两种UV-C处理组样品的总酚含量在贮藏第2、8和12天时要显著低于对照组。PAL是苯丙烷代谢途径中合成酚类物质的限速酶,鲜切梨在贮藏期间的PAL活性变化趋势以及两种UV-C处理对PAL活性的影响与总酚含量基本一致,在贮藏过程中PAL活性呈先上升后下降的趋势,且两种UV-C处理显著降低PAL活性(图3-b),但3组样品的PAL活性在贮藏前8 d一直呈上升趋势,而总酚含量却在此之前开始下降,可能是由于在贮藏过程中酚类物质由于褐变的消耗速率要高于其合成速度,由于对照组样品褐变程度最大,所以其总酚含量从第2天就开始下降。
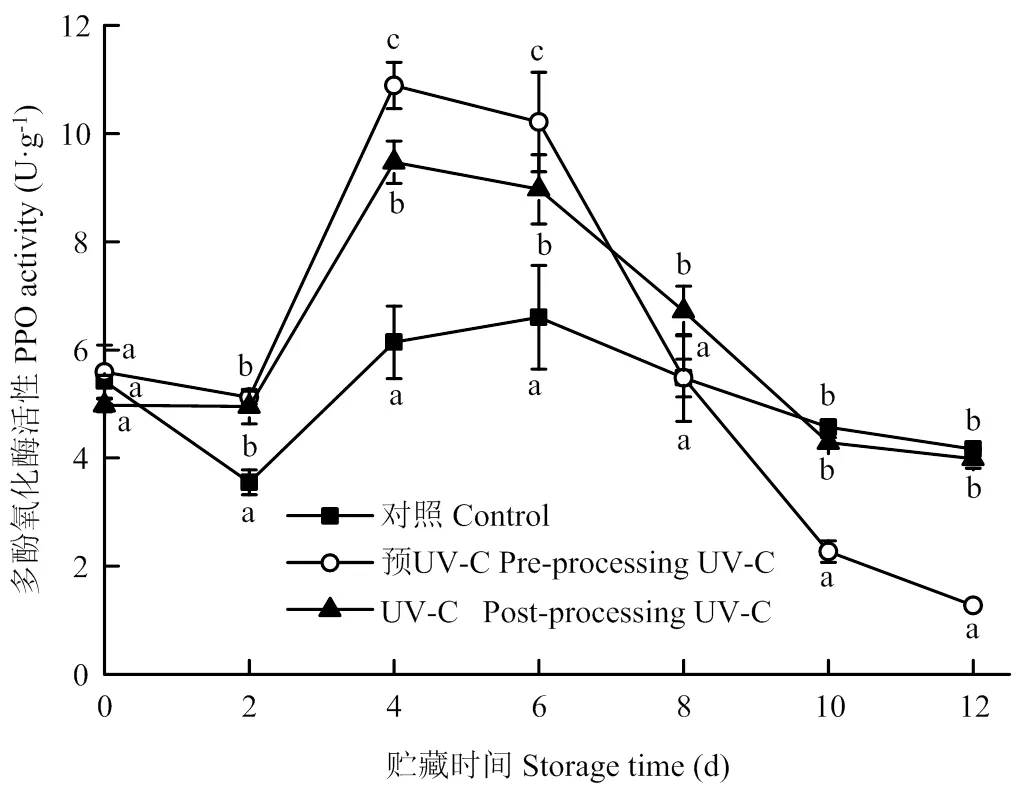
图2 UV-C处理对鲜切‘皇冠’梨PPO活性的影响
2.4 UV-C处理对鲜切梨H2O2和MDA含量的影响
如图4-a所示,鲜切梨的H2O2含量贮藏2 d时略有下降,随后逐渐上升,两种UV-C处理组样品的H2O2含量均显著低于对照组样品(<0.05),但两种处理方式之间除了贮藏8 d外,并没有显著差异(>0.05)。H2O2的积累导致膜脂过氧化程度不断加深,所以MDA的含量也逐渐升高,但在贮藏后期可能由于与蛋白发生交联反应,因而其含量逐渐下降。两种UV-C处理方式均能降低鲜切梨MDA的积累,但鲜切后UV-C处理效果更好。
图3 UV-C处理对鲜切‘皇冠’梨总酚含量(a)和PAL活性(b)的影响
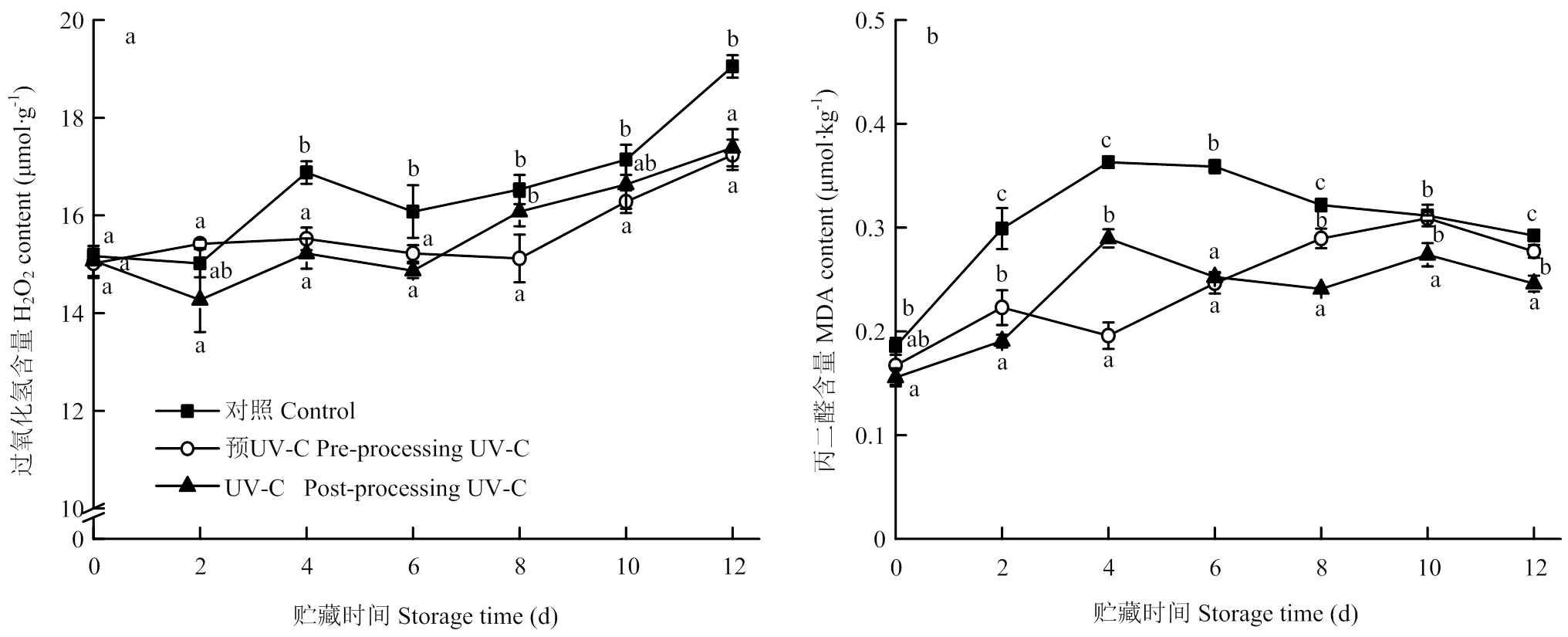
图4 UV-C处理对鲜切‘皇冠’梨H2O2(a)和MDA含量(b)的影响
2.5 UV-C处理对鲜切梨抗氧化酶活性的影响
SOD、CAT、APX和GR是果蔬体内重要的抗氧化酶。如图5-a所示,鲜切梨在贮藏过程中SOD活性呈先下降后上升的趋势,在贮藏6 d时,活性最低。鲜切后UV-C处理组样品在贮藏2—10 d中SOD活性均显著高于对照组(<0.05),而UV-C预处理组只有在贮藏6—10 d以后,SOD活性高于对照组(<0.05)。鲜切梨的CAT活性在贮藏期间整体呈下降趋势,两种UV-C处理均能够延缓CAT活性的下降,其中鲜切后UV-C处理的延缓效果更好(图5-b)。如图5-c和5-d所示,鲜切梨的APX和GR活性在贮藏过程中均呈先上升后下降的趋势,3组鲜切梨样品的APX和GR活性均分别在贮藏2 d和4 d时达到最大,鲜切后UV-C处理一定程度上提高了鲜切梨的APX活性,而UV-C预处理对鲜切梨的APX活性无显著影响(>0.05),但能够显著提高鲜切梨的GR活性(< 0.05),且提高效果高于鲜切后UV-C处理。
2.6 UV-C处理对鲜切梨非酶抗氧化能力的影响
分别采用DPPH自由基和ABTS自由基清除能力以及还原能力来评价UV-C处理对鲜切梨非酶抗氧化能力的影响,结果如图6所示。鲜切梨在贮藏期间抗氧化能力呈下降趋势,鲜切后UV-C处理可以提高鲜切梨的抗氧化能力,但在贮藏过程中其抗氧化能力下降速度较快,贮藏6 d后,鲜切后UV-C处理组样品对DPPH自由基的清除能力和还原能力与对照组样品无显著差异,对ABTS自由基的清除能力在贮藏8 d后与对照组样品无显著差异(>0.05)。与对照相比,UV-C预处理对鲜切梨的DPPH自由基清除能力以及还原能力无显著影响(>0.05),但在贮藏2—6 d时,其对ABTS自由基的清除能力显著高于对照组样品(<0.05)。由此可见,鲜切后UV-C处理能更有效提高鲜切梨的非酶抗氧化能力。

图5 UV-C处理对鲜切‘皇冠’梨SOD(a)、CAT(b)、APX(c)和GR(d)活性的影响
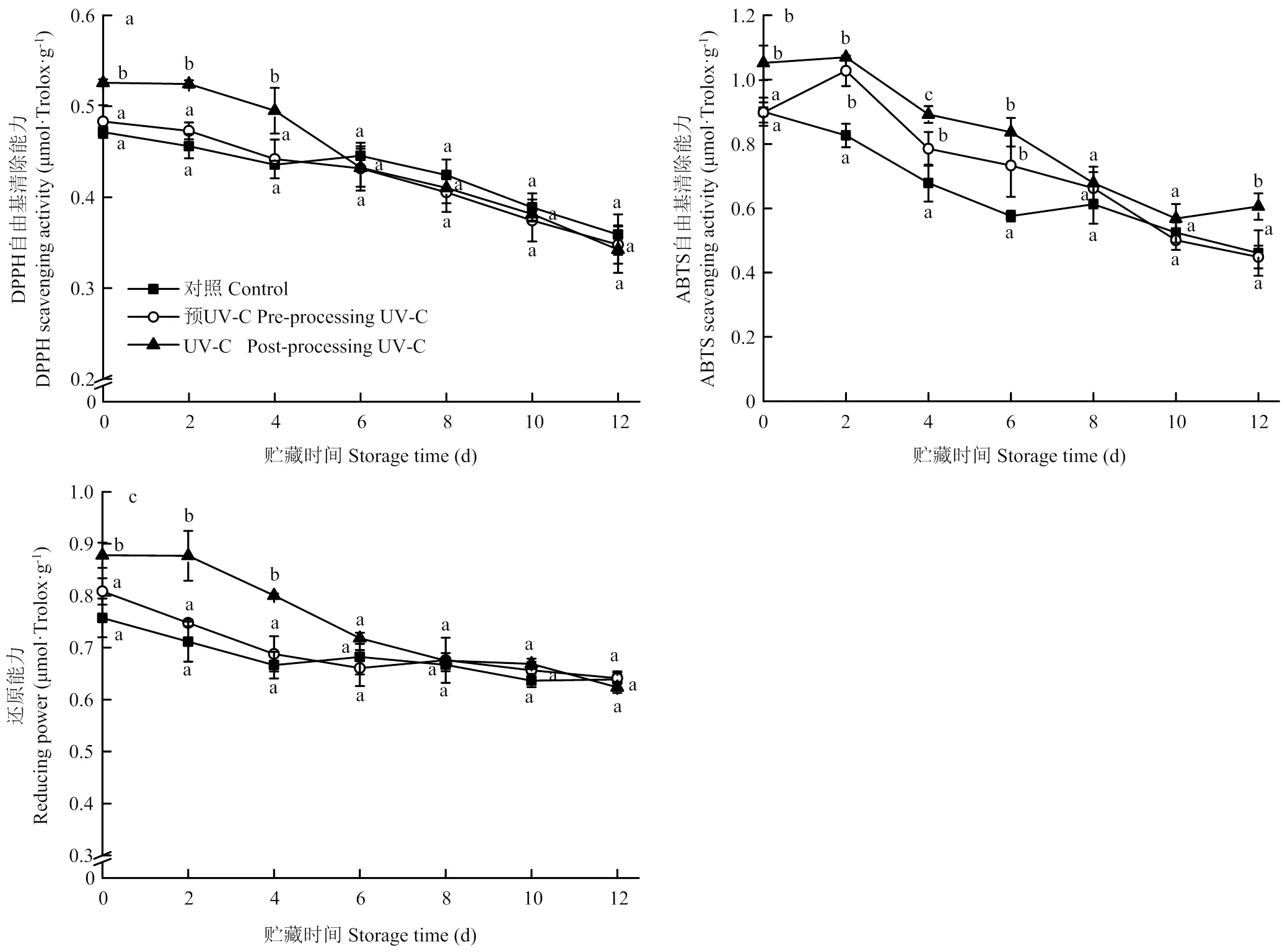
图6 UV-C处理对鲜切‘皇冠’梨DPPH自由基(a)和ABTS自由基(b)清除能力、还原能力(c)的影响
2.7 相关性分析
如图7所示,鲜切梨贮藏期间褐变程度(BI值)与H2O2和MDA含量以及PAL活性呈极显著正相关(<0.01),与CAT、APX和GR活性以及DPPH自由基和ABTS自由基清除能力、还原能力呈极显著负相关(<0.01)。
3 讨论
切割伤害引发鲜切水果的表面褐变是影响其货架期的主要因素之一,本研究结果显示UV-C预处理后鲜切以及鲜切后UV-C处理均能够有效延缓鲜切梨的褐变。酶促褐变是一个复杂的过程,一般认为PPO在有氧条件下催化酚类物质形成邻苯醌,后者通过复杂的醌聚合反应形成褐色物质是酶促褐变发生的直接原因,在完整的细胞组织中,PPO主要存在于细胞质中,而酚类物质通常贮存和积累在液泡中,鲜切切割操作打破了酚酶的区域化分布,使PPO与酚类底物相遇,引起褐变的发生[23]。当前许多研究采用的褐变控制方法均伴随着PPO活性的降低[24-25],但是在本研究中,两种UV-C处理方式却使PPO活性提高,提示UV-C可能通过其他途径控制鲜切梨的褐变。Huque等[26]研究表明鲜切苹果的PPO含量足以引起褐变的发生,其褐变的限制性因素是酚类物质的含量,在本研究中,两种UV-C处理后可以使总酚含量降低,这可能是其控制鲜切梨褐变因素之一。
近年来,越来越多研究表明酶促褐变不仅与酚类物质含量以及PPO的活性有关,还受细胞膜透性以及膜脂过氧化等多因素影响[6]。Cantos等[27]研究认为鲜切马铃薯的褐变速度与PPO活性以及酚类物质浓度无关,细胞膜的完整性才是控制褐变速率的关键因素。同样,Li等[28]的研究也发现膜是影响鲜切梨褐变的重要因素。细胞膜的破坏除了由于鲜切操作带来的直接机械损伤外,切割伤害引发大量ROS的产生,直接或间接启动膜脂过氧化反应,过氧化产物MDA使膜中的酶蛋白发生交联、聚合反应,引起细胞膜的损伤和破坏,最终导致细胞膜的区室化功能丧失,从而加快酶促褐变反应的发生[29-30],减缓膜脂过氧化程度可以有效控制鲜切果蔬的褐变程度[31]。随着贮藏时间的延长,鲜切梨的H2O2含量不断升高,膜脂过氧化程度逐渐加重,相关性分析结果显示鲜切梨的褐变程度与H2O2和MDA含量呈显著正相关,进一步证实了自由基引发的膜脂过氧化是加剧褐变的重要因素。笔者前期研究发现UV-C处理可以通过提高鲜切苹果的ROS代谢能力,减轻膜脂过氧化程度从而控制鲜切苹果的褐变[13]。同时,UV-C处理还能提高鲜切杨桃贮藏过程中细胞膜的完整性,进而控制其褐变反应[9]。本研究中,两种UV-C处理均能降低H2O2和MDA的积累,从而说明无论是鲜切前还是鲜切后UV-C处理,均可以通过降低ROS的积累以及减轻氧化损伤来控制鲜切梨的褐变。
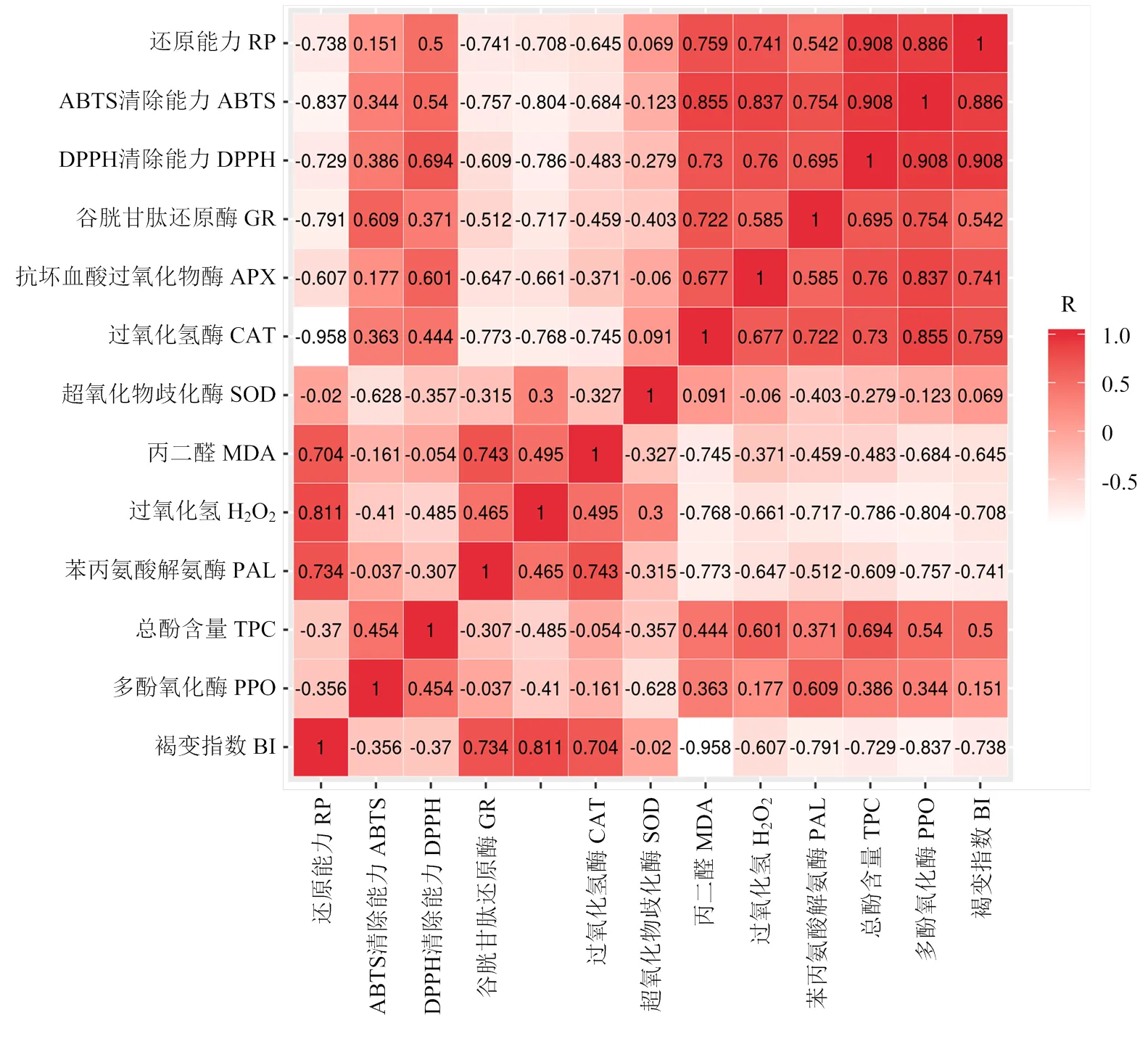
图7 BI与PPO活性等生理指标的相关性分析
ROS的大量积累会加剧酶促褐变反应,但同时果蔬自身拥有一套精准的抗氧化防御系统,能够及时清除ROS,因此,抗氧化防御系统在褐变控制过程中发挥重要的作用[32]。切割伤害能够诱导鲜切果蔬的抗氧化酶活性提高以及抗氧化物质积累,因此在贮藏初期(前2 d),鲜切梨的抗氧化酶(APX和GR)活性和总酚含量显著提高,而H2O2含量显著降低。随着贮藏时间的延长,果蔬组织逐渐衰老,其抗氧化防御能力也逐渐减弱,从而引起ROS大量积累,氧化损伤程度加重,最终加剧褐变反应。相关性分析结果也显示鲜切梨的H2O2和MDA含量分别与抗氧化酶活性(CAT和GR)和抗氧化能力(还原能力、DPPH自由基和ABTS自由基清除能力)呈显著或极显著负相关。研究表明UV-C处理能够提高鲜切紫甘蓝[33]、鲜切石榴[34]、鲜切红心萝卜[35]的酶与非酶抗氧化能力,而鲜切果蔬抗氧化活性的提高,有助于控制其褐变的发生[36-37]。在本研究中,两种UV-C处理均能不同程度的提高鲜切梨的抗氧化酶活性以及非酶抗氧化能力,说明UV-C处理控制鲜切梨的褐变与其提高抗氧化能力,减轻ROS引发的氧化损伤和膜脂过氧化密切相关。在今后通过进一步优化鲜切后UV-C处理工艺,以增强其对鲜切水果的褐变控制效果。
4 结论
无论是鲜切前UV-C预处理还是鲜切后UV-C处理5 min均能有效延缓鲜切梨的表面褐变,这种控制作用与PPO活性无关,主要是通过降低鲜切梨总酚含量,提高其抗氧化酶活性和非酶抗氧化能力,从而降低ROS的积累,减轻氧化损伤,保持膜的完整性,最终控制褐变的发生。两种处理方式相比,鲜切后UV-C处理更能有效提高鲜切梨的抗氧化能力,因而对褐变控制效果更好。
[1] Perez-Cabrera L, Chafer M, Chiralt A, Gonzalez- Martinez C. Effectiveness of antibrowning agents applied by vacuum impregnation on minimally processed pear., 2011, 44(10): 2273-2280.
[2] Bobo-García G, Arroqui C, Merino G, Vírseda P. Antibrowning compounds for minimally processed potatoes: A Review., 2019, 5: 529-546.
[3] Degl'Innocenti E, Guidi L, Pardossi A, Tognoni F. Biochemical study of leaf browning in minimally processed leaves of lettuce (L. var.)., 2005, 53(26): 9980-9984.
[4] Saltveit M E. Wound induced changes in phenolic metabolism and tissue browning are altered by heat shock., 2000, 21(1): 61-69.
[5] Sun Y, Zhang W, Zeng T, Nie Q X, Zhang F Y, Zhu L Q. Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism., 2015, 177: 376-381.
[6] Toivonen P M A, Brummell D A. Biochemical bases of appearance and texture changes in fresh-cut fruit and vegetables., 2008, 48(1): 1-14.
[7] 袁芳, 邱诗铭, 李丽. 不同保鲜剂复合处理对鲜切芒果活性氧代谢、细胞膜透性和褐变的影响. 食品科学, 2020, 41(3): 218-223.
YUAN F, QIU S M, LI L. Effect of composite preservative on active oxygen metabolism, cell membrane permeability and browning of fresh-cut mango., 2020, 41(3): 218-223. (in Chinese)
[8] United States Food & Drug Administration. Ultraviolet radiation for the processing and treatment of food. Code of Federal Regulations, 2002.
[9] Moreno C, Andrade-Cuvi M J, Zaro M J, Darre M, Vicente A R, Concellón A. Short UV-C treatment prevents browning and extends the shelf-life of fresh-cut carambola., 2017, 2017: 1-9.
[10] Wang D, Chen L K, Ma Y, Zhang M, Zhao Y W, Zhao X Y. Effect of UV-C treatment on the quality of fresh-cut lotus (.) root., 2019, 278: 659-664.
[11] Huang H, Ge Z W, Limwachiranon J, Li L, Li W R, Luo Z S. UV-C treatment affects browning and starch metabolism of minimally processed lily bulb., 2017, 128: 105-111.
[12] Chen C, Hu W Z, He Y B, Jiang A L, Zhang R D. Effect of citric acid combined with UV-C on the quality of fresh-cut apples., 2016, 111: 126-131.
[13] 周琪, 陈晨, 周福慧, 胡文忠, 赵蕾, 许源源. 短波紫外线控制鲜切苹果褐变与其活性氧代谢的相关性. 食品科学, 2019, 40(5): 102-109.
Zhou Q, Chen C, Zhou F H, Hu W Z, Zhao L, Xu Y Y. Correlation between enzymatic browning inhibition by UV-C treatment and reactive oxygen species metabolism of fresh-cut apples., 2019, 40(5): 102-109 (in Chinese)
[14] Palou E, López-Malo A, Barbosa-Cánovas G V, Welti-Chanes J, Swanson B G. Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree., 1999, 64(1): 42-45.
[15] Patterson B D, Macrae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)., 1984, 139(2): 487-492.
[16] 陈晨, 胡文忠, 田沛源, 姜爱丽. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析. 食品科学, 2014, 35(2): 12-17.
Chen C, Hu W Z, Tian P Y, Jiang A L. Optimization of ultrasound-assisted extraction of polyphenols from banana peel and its antioxidant capacity., 2014, 35(2): 12-17. (in Chinese)
[17] Chen C, Hu W Z, Zhang R D, Jiang A L, Liu C H. Effects of hydrogen sulfide on the surface whitening and physiological responses of fresh-cut carrots., 2018, 98(12): 4726-4732.
[18] 李雪, 吴觉天, 王毅, 姜红, 毕阳, 司敏, 张静荣, 徐洁. 采后ABA处理促进‘陇薯3号’马铃薯块茎愈伤形成. 中国农业科学, 2017, 50(20): 4003-4011.
LI X, WU J T, WANG Y, JIANG H, BI Y, SI M, ZHANG J R, XU J. Postharvest ABA treatment promote wound healing of potato ‘Longshu No.3’ tubers., 2017, 50(20): 4003-4011. (in Chinese)
[19] Chen C, Hu W Z, Zhang R D, Jiang A L, Zou Y. Levels of phenolic compounds, antioxidant capacity, and microbial counts of fresh-cut onions after treatment with a combination of nisin and citric acid., 2016, 57(3): 266-273.
[20] REN Y L, WANG Y F, BI Y, Ge Y H, Wang Y, Fan C F, Li D Q, Deng H W. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (L.) fruit., 2012, 234(6): 963-971
[21] Reyes L F, Cisneros-Zevallos L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (L.)., 2003, 51(18): 5296-5300.
[22] Viacava F, Santana-Gálvez J, Heredia-Olea E, Pérez- Carrillo E, Nair V, Cisneros-Zevallos L, Jacobo- Velázquez D A. Sequential application of postharvest wounding stress and extrusion as an innovative tool to increase the concentration of free and bound phenolics in carrots., 2020, 307: 125551.
[23] Landrigan M, Morris S C, Eamus D, McGlasson W B. Postharvest water relationships and tissue browning of rambutan fruit., 1996, 66(3/4): 201-208.
[24] Rico D, Martín-Diana A B, Barat J M, Barry-Ryan C. Extending and measuring the quality of fresh-cut fruit and vegetables: A review., 2007, 18(7): 373-386.
[25] Oms-Oliu G, Rojas-Graü M A, González L A, Varela P, Soliva-Fortuny R, Hernando M I H, Munuera I P, Fiszman S. Martín-Belloso O. Recent approaches using chemical treatments to preserve quality of fresh-cut fruit: A review., 2010, 57(3): 139-148.
[26] Huque R, Wills R B H, Pristijono P, Golding J B. Effect of nitric oxide (NO) and associated control treatments on the metabolism of fresh-cut apple slices in relation to development of surface browning., 2013, 78: 16-23.
[27] Cantos E, Tudela J A, GIL M I, Espín J C. Phenolic compounds and related enzymes are not rate-limiting in browning development of fresh-cut potatoes., 2002, 50(10): 3015-3023.
[28] Li Z H, Zhang Y, Ge H B. The membrane may be an important factor in browning of fresh-cut pear., 2017, 230: 265-270.
[29] Jiang J, Jiang L, ZhangL, Luo H B, Opiyo A M, Yu Z F. Changes of protein profile in fresh-cut lotus tuber before and after browning., 2012, 60(15): 3955-3965.
[30] Lin Y F, Lin H T, Lin Y X, Zhang S, Chen Y H, Jiang X J. The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested longan fruit., 2016, 111: 53-61.
[31] Gao H, Chai H K, Cheng N, Cao W. Effects of 24-epibrassinolide on enzymatic browning and antioxidant activity of fresh-cut lotus root slices., 2017, 217: 45-51.
[32] Mittler R. Oxidative stress, antioxidants and stress tolerance., 2002, 7(9): 405-410.
[33] Zhang J, Yuan L, Liu W, Lin Q, Wang Z D, Guan W Q. Effects of UV-C on antioxidant capacity, antioxidant enzyme activity and colour of fresh-cut red cabbage during storage., 2017, 52(3): 626-634.
[34] Maghoumi M, Gómez P A, Mostofi Y, Zamani Z, Artés- Hernández F, Artés F. Combined effect of heat treatment, UV-C and superatmospheric oxygen packing on phenolics and browning related enzymes of fresh-cut pomegranate arils.2013, 54(2): 389-396.
[35] 高梵, 龙清红, 韩聪, 金鹏, 郑永华. UV-C处理对鲜切红心萝卜抗氧化活性的影响. 食品科学, 2016, 37(11): 12-17.
Gao F, Long Q H, Han C, Jin P, Zheng Y H. Effect of UV-C treatment on antioxidant activity of fresh-cut red-fleshed radish., 2016, 37(11): 12-17. (in Chinese)
[36] Hu K D, Qian W, Hu L Y, Gao S P, Wu J, Li Y H, Zheng J L, Han Y, Liu Y S, Zhang H. Hydrogen sulfide prolongs postharvest storage of fresh-cut pears () by alleviation of oxidative damage and inhibition of fungal growth., 2014, 9(1): e85524.
[37] Zheng J L, Hu L Y, Hu K D, Wu J, Yang F, Zhang H. Hydrogen sulfide alleviates senescence of fresh-cut apple by regulating antioxidant defense system and senescence-related gene expression., 2016, 51(2): 152-158.
Effect of UV-C on the Browning of Fresh-Cut Huangguan Pear
CHEN Chen, JIANG AiLi, LIU ChengHui, Zhao QiQi, ZHANG YanHui, HU WenZhong
(Ministry of Education, College of Life Science, Dalian Minzu University/Key Laboratory of Biotechnology and Bioresources Utilization, Dalian 116600, Liaoning)
【】In order to provide an experimental basis for the preservation of fresh-cut pears and enlarging the application of UV-C, the effects of pre-processing and post-processing UV-C treatment on the browning inhibition of fresh-cut pears and its possible physiology mechanism were studied.【】Fresh-cut pears were separately treated by pre-processing and post-processing UV-C (254 nm) for 5 min, and then the physiological parameters were evaluated, including browning degree (BI), the activities of polyphenol oxidase (PPO), phenylalnine ammonialyase (PAL), total phenolic content (TPC), H2O2and MDA content, the activities of antioxidant enzymes (superoxide dismutase, SOD, catalase CAT, ascorbate peroxidase APX, glutathione reductase GR) and non-enzymatic antioxidant capacities (DPPH, ABTS radical scavenging activities and reducing power).【】The results showed that both pre-processing and post-processing UV-C treatment could effectively delay the browning of fresh-cut pears. Post-processing UV-C treatment exhibited better browning controlling effect than that of pre-processing UV-C treatment. Both two kinds of UV-C treatments could improve the PPO activity, reduce the PAL activity and TPC, as well as increase the enzymatic and non-enzymatic antioxidant activities of fresh-cut pears and decrease the accumulation of H2O2andMDA. Statistical analysis indicated that BI were significantly negatively correlated with CAT, APX and GR activities, and non-enzymatic capacities (<0.01). While there was a positive correlation between BI and H2O2, MDA content (<0.01).【】These findings suggested that UV-C treatment delayed browning of fresh-cut pears during storage mainly through improving the antioxidant defense system. Post-processing UV-C treated fresh-cut pears possessed higher antioxidant activity than that of pre-processing treated samples, therefore, which exhibited better browning controlling effect.
fresh-cut pears; browning; UV-C; physiology mechanism

10.3864/j.issn.0578-1752.2020.24.011
2020-05-04;
2020-07-22
国家重点研发计划(2016YFD0400903)、国家自然科学基金(31801598)、大连市青年科技之星项目(2017RQ147)
陈晨,E-mail:chenchen@dlnu.edu.cn。通信作者胡文忠,E-mail:hwz@dlnu.edu.cn
(责任编辑 赵伶俐)

