术前盆腔对比增强MRI评估子宫内膜癌子宫肌层浸润程度
王志涛,葸燕燕,张正平,朱 力,侯登华,韩颜竹
(宁夏医科大学总医院放射科,宁夏 银川 750004)
子宫内膜癌是最常见妇科恶性肿瘤之一,发病率逐年增高[1-2]。我国子宫内膜癌约占女性全身恶性肿瘤7%,占女性生殖道恶性肿瘤20%~30%,平均发病年龄60岁[3]。影响子宫内膜癌预后的因素较多,其中淋巴结转移是重要因素[4],而其发生率与肌层浸润深度呈正比。术前准确评估子宫肌层浸润程度有利于优选治疗方案及改善预后[5]。本研究探讨MRI评估子宫内膜癌子宫肌层浸润程度的应用价值。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月—2019年5月于宁夏医科大学总医院经分段诊断性刮宫及宫腔镜下活检确诊的89例子宫内膜癌,术前MRI诊断存在肌层浸润,年龄26~79岁,平均(52.5±21.0)岁;32例未绝经,57例已绝经;临床表现包括阴道不规则流液或出血、下腹部疼痛等。纳入标准:经病理确诊子宫内膜癌;入组前未接受放射、化学和/或免疫治疗。排除标准:存在手术禁忌证;既往子宫手术史;合并严重心、肝、肾功能障碍或其他恶性肿瘤。
1.2 仪器与方法 检查前患者禁食5 h,适度充盈膀胱。嘱患者仰卧,采用GE Signa Excite HDX 3.0T超导型MR仪,8通道相控阵体部线圈,扫描范围自腹主动脉分叉至耻骨联合,需覆盖整个病灶,分别采集常规平扫MRI、弥散加权成像(diffusion weighted imaging, DWI)、动态对比增强MRI(dynamic contrast enhanced-MRI, DCE-MRI)及延迟增强MRI。快速自旋回波T1W序列:TR 560 ms,TE 6.7 ms;脂肪抑制T2W序列:TR 3 460 ms,TE 85.6 ms,轴位层厚5 mm,层间距0.2~0.6 mm,FOV 38 cm×38 cm,矩阵384×256;矢状位、冠状位层厚5 mm,层间距0.3 mm,FOV 32 cm×32 cm~38 cm×38 cm,矩阵320×256。DWI采用单次激发自旋回波-回波平面成像脂肪抑制序列,TR 4 000 ms,TE 60.3 ms,b=800 s/mm2,激励次数12,层厚5 mm,FOV 38 cm×38 cm,矩阵130×96。DCE-MRI采用三维容积内插快速扰相GRE序列,TR 4.4 ms,TE 0.9 ms,层厚 4 mm,FOV 38 cm×38 cm,矩阵256×384;采用高压注射器以流率2.5 ml/s经上肢静脉注射对比剂轧喷替酸葡甲胺(Gd-DTPA),剂量0.2 mmol/kg体质量,注药同时进行扫描,分别获取0、20、40、60、80、100、120 s时相图像。延迟增强采用脂肪抑制T1W序列,轴位TR 560 ms,TE 6.7 ms,FOV 38 cm×38 cm,矩阵384×256;矢状位及冠状位层厚4 mm,层间距0.5 mm,FOV 24 cm×24 cm,TR 185 ms,TE 2 ms,矩阵320×256。
1.3 图像分析 由2名具有3年以上相关经验的影像科主治医师采用盲法分别阅片,意见不一时经协商达成一致。参照文献[6]标准诊断肌层浸润深度:浸润深度<1/2肌壁为浅肌层浸润,≥1/2为深肌层浸润。
1.4 病理检查 行开腹手术或经腹腔镜手术,根据术中冰冻病理结果选择具体术式,对手术切除的肿瘤组织进行病理学检查,参照美国病理学家学会诊断标准[6]判定肌层浸润深度。
2 结果
术前MRI示病变区子宫内膜均呈不均匀中-高信号强度,子宫肌层内边缘不清,结合带中断,受累肌壁呈不均匀高信号;诊断浅肌层浸润62例,深肌层浸润27例,见图1、2。

图1 患者女,50岁,子宫内膜癌ⅠA期 A~D.分别为术前矢状位T2WI(A)、矢状位脂肪抑制增强T1WI(B)、冠状位T2WI(C)、冠状位脂肪抑制增强T1WI(D),均显示浅肌层浸润(<1/2肌壁) (箭示病灶)
89例中,对24例行开腹手术,其中单纯子宫全切10例,全子宫+双侧附件或单侧附件切除8例,全子宫+双侧附件切除+盆腔淋巴结清扫术3例,广泛全子宫+双侧输卵管切除+盆腔淋巴结清扫术2例,广泛全子宫+双侧附件切除+盆腔淋巴结清扫术1例;对65例行经腹腔镜手术,其中单纯子宫全切23例,全子宫+双侧附件或单侧附件切除20例,全子宫+双侧附件切除+盆腔淋巴结清扫术10例,广泛全子宫+双侧输卵管切除+盆腔淋巴结清扫术7例,广泛全子宫+双侧附件切除+盆腔淋巴结清扫术5例。
术后病理结果显示,子宫内膜癌组织分化程度1级37例,2级42例,3级10例;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期ⅠA期48例,ⅠB期24例,Ⅱ期9例,ⅢA期2例,ⅢC期5例,Ⅳ期1例;浅肌层浸润63例,深肌层浸润26例。
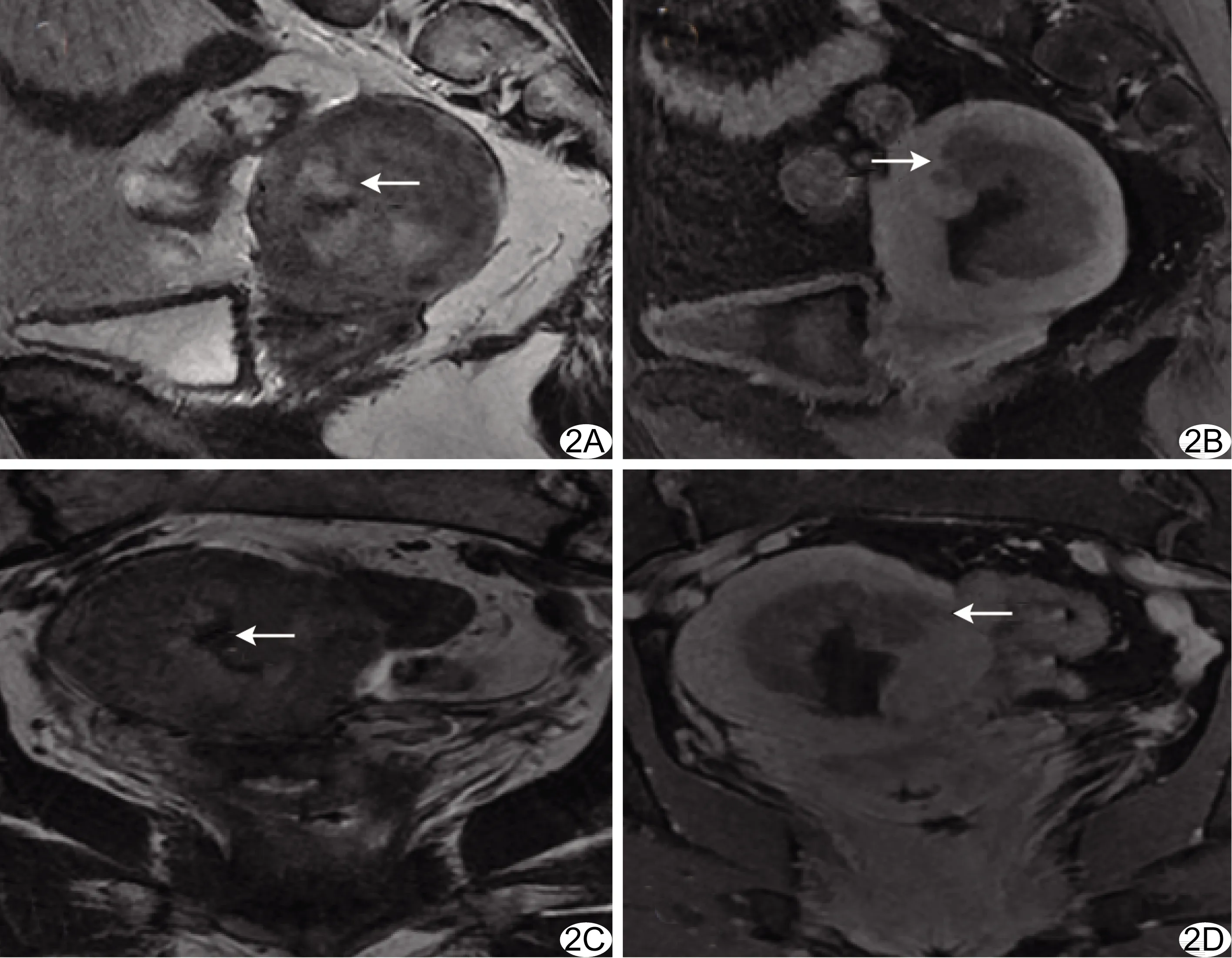
图2 患者女,62岁,子宫内膜癌ⅠB期 A~D.分别为术前矢状位T2WI(A)、矢状位脂肪抑制增强T1WI(B)、冠状位T2WI(C)、冠状位脂肪抑制增强T1WI(D),均显示深肌层浸润(>1/2肌壁) (箭示病灶)
MRI诊断浅肌层浸润的敏感度90.48%(57/63),特异度80.77%(21/26),阳性预测值91.94%(57/62),阴性预测值77.78%(21/27),准确率87.64%(78/89);诊断深肌层浸润的敏感度80.77%(21/26),特异度90.48%(57/63),阳性预测值77.78%(21/27),阴性预测值91.94%(57/62),准确率87.64%(78/89)。
3 讨论
淋巴结转移是子宫内膜癌预后不良的影响因素之一,一旦发生,复发风险增加,生存率降低[7]。淋巴结转移与组织学类型、分化程度及肌层浸润深度有关。PÖLCHER等[8]报道,分化3级且深肌层浸润(肌层浸润≥1/2)的透明细胞型或浆液性乳头状子宫内膜癌复发风险较高,分化1、2级且浅肌层浸润者复发风险低。术前准确评估子宫肌层浸润深度,并适当选择治疗方案,对改善预后具有积极意义。
既往研究[9-12]报道,MRI具有良好的软组织分辨率,可用于诊断子宫内膜肿瘤并评估肿瘤对邻近组织的侵犯情况。MRI可清晰显示正常子宫带状结构,区分异常与正常子宫肌层,诊断子宫内膜癌肌层浸润深度的准确率较高;但当子宫内膜癌组织与正常子宫肌层T2WI信号强度相似,或伴有增生、息肉、肌瘤或子宫腺肌病等时,其判断子宫肌层浸润程度的准确性降低。
欧洲泌尿生殖放射学会(European Society of Urogenital Radiology, ESUR)公布的子宫内膜癌分期指南建议采用DCE-MRI辅助诊断肌层浸润[13]。DCE-MRI可反映子宫内膜癌与正常子宫肌层的血流灌注差异,与正常子宫肌层相比,子宫内膜癌呈弱强化,此种差异有利于判断肌层侵犯深度。本组对89例子宫内膜癌患者术前均采用DCE-MRI及其他对比增强MRI评价肌层浸润深度,结果显示62例存在浅肌层浸润、27例有深肌层浸润,术后病理结果显示浅肌层浸润63例、深肌层浸润26例,术前MRI诊断浅肌层浸润的敏感度90.48%、特异度80.77%、准确率87.64%,其诊断深肌层浸润的敏感度、特异度及准确率分别为80.77%、90.48%、87.64%,与既往文献[14-17]结果基本相符。以上结果提示,术前对比增强MRI评估肌层浸润程度效果较好。另一方面,影响MRI诊断效能的因素较多,如肿瘤体积较大导致子宫肌层变薄、正常子宫肌层与肿瘤MRI信号强度相近均可增加诊断难度;并发子宫良性病变如增生、息肉、肌瘤、腺肌病或内膜炎等亦可影响诊断结果。本研究未对上述因素进行分析,且样本量相对较少,有待进一步完善研究。
综上所述,术前对比增强MRI评估子宫内膜癌肌层侵犯程度的效能较高,可为治疗方案选择提供参考。

