长链非编码RNA ZFAS1在食管癌中的表达及作用机制研究
张 千,朱亚宁,周武碧
食管癌是世界上最致命的上消化道癌症之一[1],其中食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)占90%以上[2]。尽管食管癌的诊断和治疗取得了巨大的进步,但患者预后仍然很差,5年生存率仅为20%[3]。因此,有必要对食管癌的致病机理进行深入探究,为其提供新的治疗靶点。长链非编码RNA(long noncoding RNA,lncRNAs)是一种具有超过200个碱基对的非编码类RNA,在人体的各种生理活动中发挥重要作用。越来越多的研究证实,lncRNAs参与了多种癌症的发生、发展过程[4]。目前,已发现多种lncRNAs与食管癌的进展有关,如lncRNA UCA1[5]、PEG10[6]等。锌指结构反义转录本1(zinc finger antisense 1,ZFAS1)是新近发现位于染色体20q13的lncRNA,最初发现ZFAS1异常表达于乳腺癌组织和细胞中,随后有研究发现ZFAS1在肝细胞癌中高表达,且与癌症的转移和不良预后有关,另外ZFAS1还被发现可在结肠癌中作为致癌基因发挥促进细胞增殖、抑制凋亡的作用[7]。然而,目前罕有关于ZFAS1在食管癌作用的文献报道。本研究通过StarBase数据库预测发现微小RNA(microRNA,miRNA)miR-302b-3p可能是ZFAS1的靶基因。有研究发现miR-302b-3p具有抑制癌细胞增殖的作用[8]。因此,本研究假设lncRNA ZFAS1可通过靶向miR-302b-3p在食管癌中发挥作用。首先检测食管癌组织和细胞的ZFAS1表达水平,并进一步研究抑制ZFAS1表达对食管癌细胞功能如细胞增殖、迁移和凋亡的影响及其潜在机制。
1 材料与方法
1.1 临床资料 选取2016年7月—2017年6月在南京医科大学附属淮安第一医院行食管癌手术切除术的38例患者,收集ESSC和相应癌旁组织(距离原发灶>5 cm)。本研究纳入的患者在术前未接受过局部或全身治疗。所有组织样本经液氮冷冻,储存于-80 ℃超低温冰箱以供使用。本研究所有患者知情同意,并获得本院伦理委员会批准。
1.2 方法
1.2.1 细胞培养 人永生化的正常食管上皮细胞Het-1A及Eca-109细胞系均购自美国ATCC公司,分别使用含有10%胎牛血清(美国Gibco公司)和100 U/mL青霉素/链霉素的Dulbecco改良Eagle培养基(dulbecco′s modification of Eagle′s medium,DMEM,瑞士Lonza公司)及RPMI-1640(美国Invitrogen公司)的培养基培养于含5% CO2的37 ℃环境中。
1.2.2 实时荧光定量PCR(qRT-PCR)技术检测组织和细胞ZFAS1表达 使用Trizol试剂(美国Invitrogen公司)提取组织和细胞总RNA成分,分光光度计测得RNA浓度和OD260/280比值。根据说明书逆转录(日本Takara公司)获得cDNA,随后使用SYBR Green试剂盒(日本Takara公司)在ABI 7300 System PCR仪(美国Applied Biosystems公司)上进行qRT-PCR检测。使用GAPDH作为内参基因,GAPDH和ZFAS1引物由中国生工公司代为设计与合成,序列如下:ZFAS1(前引物:5′-AAGCCACGTGCAGACATCTA-3′;后引物:5′-CTACTTCCAACACCCGCATT-3′),GAPDH(前引物:5′-TGGTATCGTGGAAGGACTCA-3′;后引物:5′-CCAGTAGAGGCAGGGATGAT-3′)。采用2?傆bΔΔCt法计算ZFAS1的相对表达量。
1.2.3 细胞转染和分组 将Eca-109细胞分为3组:空白组、NC干扰组及ZFAS1干扰组。将处于指数生长期的细胞以1×106个/孔的密度接种于6孔板中,待24 h后根据说明书,使用LipofectamineTM3 000转染试剂(美国Invitrogen公司)进行ZFAS1干扰RNA(ZFAS1-siRNA)、阴性对照(NC-siRNA)(广州RiboBio公司)的转染。6 h后更换新鲜培养基进行后续实验。
1.2.4 Cell Counting Kit-8(CCK-8)测定细胞活性 使用CCK-8(日本Dojindo公司)测定细胞活性,首先将空白组、NC干扰组及ZFAS1干扰组3组细胞以1×104的密度均匀接种于96孔板中(每组设置4个复孔),连续4 d相同时间测定细胞450 nm波长下的OD值以评估细胞活性。
1.2.5 细胞划痕实验 使用记号笔和尺子在6孔板背面适当地画出水平线,将细胞以5×105个/孔的密度接种于6孔板中,进行转染48 h后使用移液枪头垂直于先前画的水平线画3条互相平行的垂直线,随后用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗细胞3次,去除脱落细胞,加入无血清培养基,放回培养箱继续孵育。分别于0 h和48 h取标本拍照进行分析。
1.2.6 细胞凋亡检测 采用膜联蛋白V(annexin-V)-异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(美国Invitrogen公司)测定细胞凋亡水平。将细胞以1×105个/孔的密度接种于6孔板中,转染48 h后按照说明书收集细胞,流式细胞仪检测细胞凋亡情况,使用FlowJo软件进行数据分析。
1.2.7 双荧光素酶报告基因 将Eca-109细胞均匀接种于培养板中过夜培养,并将pmirGLO-ZFAS1-wt(野生型)或pmirGLO-ZFAS1-mut(突变型)荧光素酶报告基因质粒和miR-302b-3p模拟物(miR-302b-3p mimics)或miR-302b-3p抑制物(miR-302b-3p inhibitor)转染入细胞。用双荧光素酶报告基因分析系统检测荧光素酶活性。
1.2.8 Western蛋白印迹法 利用RIPA强裂解液(上海碧云天公司)裂解提取蛋白,SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白条带,随后将蛋白转移至PVDF膜(美国Millipore公司),封闭后进行一抗c-Jun氨基末端激酶2(c-Jun N-terminal kinase 2,JNK2)、胰岛素样生长因子1受体(insulin-like growth factor-1 receptor,IGF-1R)、白细胞介素-1受体相关激酶4(interleukin-1 receptor-associated kinase 4,IRAK-4)和上皮细胞激酶(epithelial cell kinase 2,EphA2)(均购自美国Abcam公司,编号分别为ab178953、ab182408、ab5985、ab78002)孵育。GAPDH(ab128915,购自美国Abcam公司)作为内参蛋白。

2 结果
2.1 ZFAS1在ESSC组织和细胞中的表达 与癌旁组织相比,ZFAS1在食管癌组织中表达明显上调(t=19.40,P<0.001,图1A)。与正常食管上皮细胞Het-1A相比,食管癌细胞Eca-109中的ZFAS1表达水平显著增高(t=13.80,P<0.001,图1B)。

图1 ZFAS1在食管癌组织及细胞中表达
2.2 干扰ZFAS1表达抑制ESSC细胞增殖 与NC干扰组细胞相比,ZFAS1干扰组细胞的ZFAS1表达水平显著降低(t=15.53,P<0.001),空白组与NC干扰组比较没有统计学意义(t=2.065,P>0.05,图2A)。采用CCK-8检测不同转染组细胞的增殖活性,与NC干扰组细胞相比,48、72及96 h测得ZFAS1干扰组细胞增殖活性显著降低,差异具有统计学意义(t值分别=2.933,8.568,10.04,P<0.05),而24 h时没有明显差异(t=0.1960,P>0.05)。空白组与NC干扰组比较无统计学差异(t值分别=1.434,1.260,0.1761,0.4214,均P>0.05,图2B)。

图2 ZFAS1干扰对食管癌细胞增殖的作用
2.3 干扰ZFAS1抑制ESSC细胞迁移 与NC干扰组细胞相比,ZFAS1干扰组细胞的迁移率显著降低,差异均有统计学意义(t=13.96,P<0.001),空白组和NC干扰组相比较,细胞迁移能力无明显变化(t=0.6948,P>0.05,图3)。
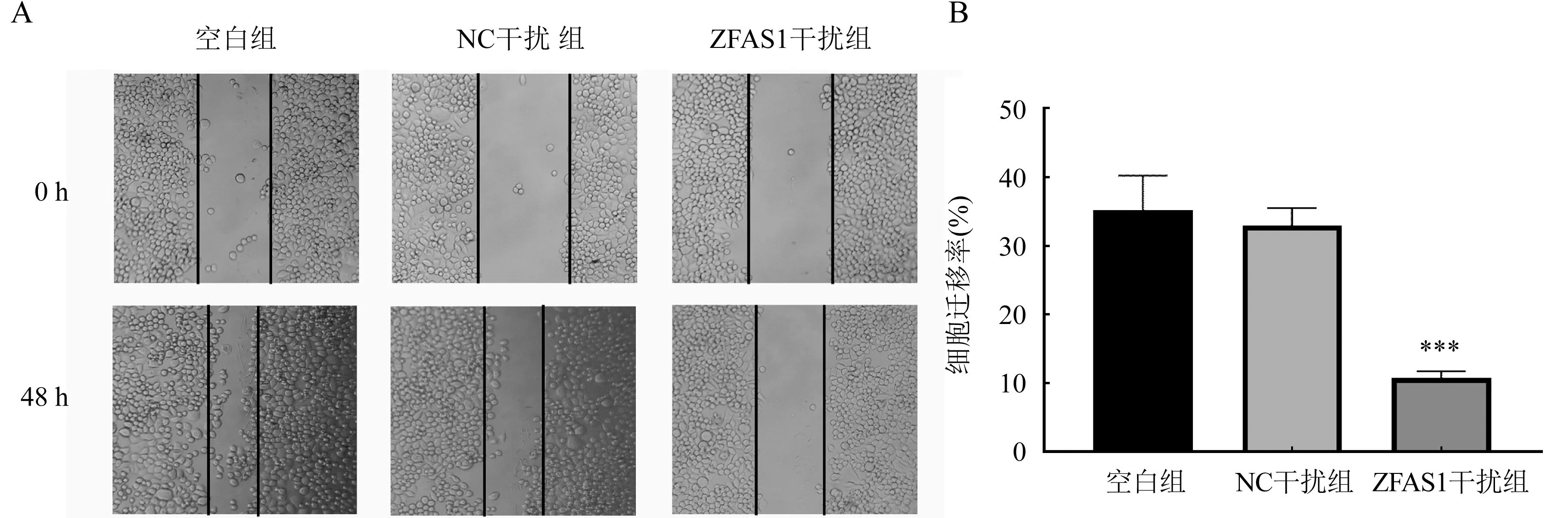
图3 ZFAS1-siRNA对食管癌细胞迁移的作用(×40)
2.4 ZFAS1-siRNA促进ESSC细胞凋亡 空白组和NC干扰组相比较,细胞凋亡率无明显变化(t=0.4741,P>0.05)。与NC干扰组细胞相比,转染ZFAS1干扰细胞的凋亡率显著升高,差异具有统计学意义(t=10.68,P<0.001,图4)。

图4 干扰ZFAS1表达对食管癌细胞凋亡的影响
2.5 miR-302b-3p为ZFAS1的作用靶点 ZFAS1中存在能够与miR-302b-3p结合的序列,图5A。荧光素酶报告基因结果证实miR-302b-3p为ZFAS1的作用靶点(t=2.925,P<0.05,图5B)。而且ZFAS1可以通过ceRNA的方式调控miR-302b下游靶基因JNK2、IGF-1R、IRAK4和EphA2的表达,图5C。
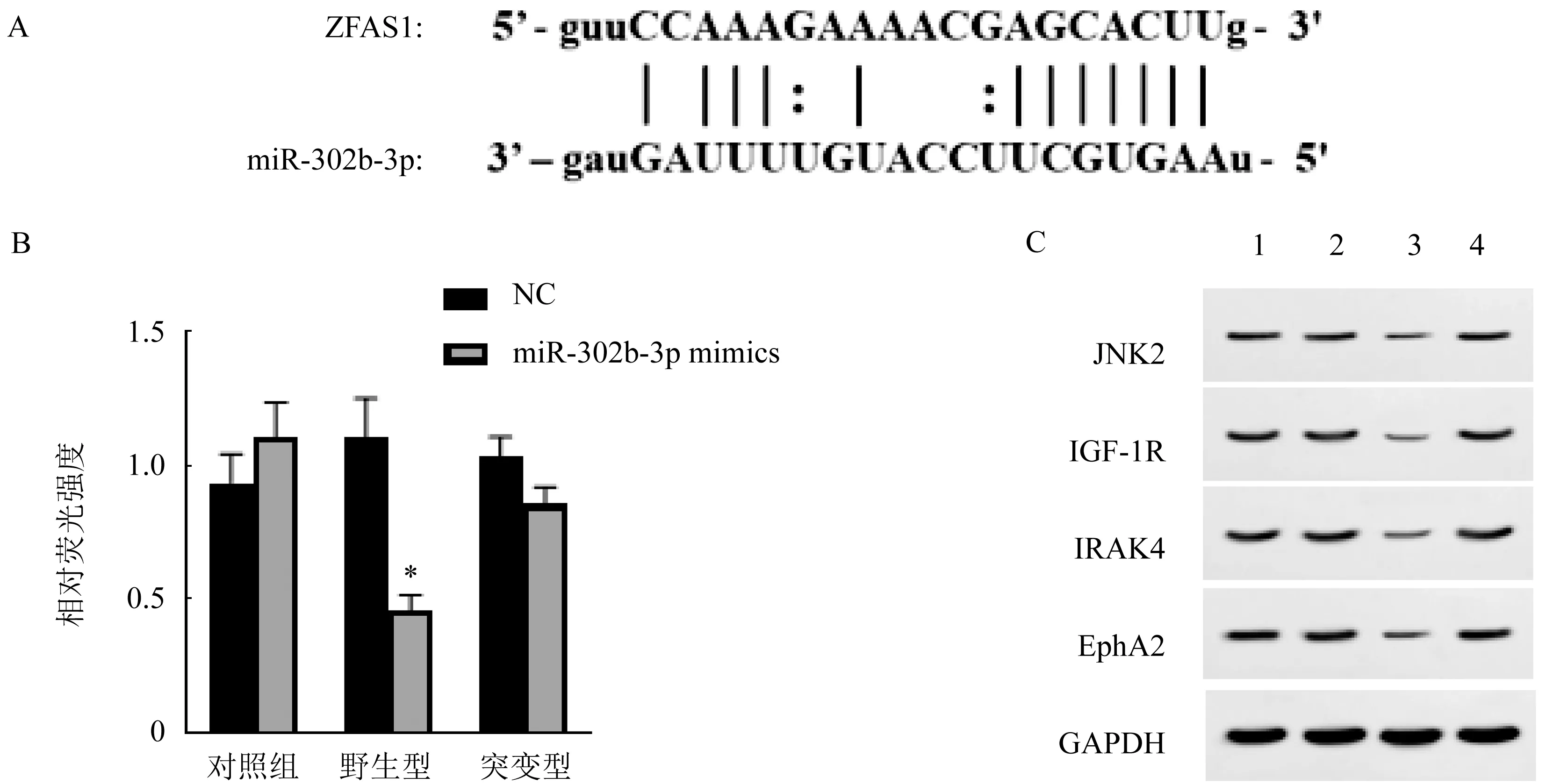
图5 ZFAS1靶向miR-302b-3p对JNK2、IGF-1R、IRAK4和EphA2表达的调控作用
3 讨论
越来越多研究显示,哺乳动物基因组编码了大量长度超过200个核苷酸,蛋白质编码能力有限的LncRNA,这些LncRNAs长度超过200个核苷酸,具有有限的蛋白质编码能力[9]。近年来,有研究发现可产生LncRNA的蛋白质编码基因中有18%与癌症有关,而所有人类蛋白质编码基因中仅有9%与癌症有关[10]。鉴于LncRNAs在基因表达调控中的重要作用,且参与细胞增殖、凋亡、分化等多种活动,因此大量研究围绕LncRNAs在癌症病理过程的作用展开[11],识别和研究与癌症相关的LncRNAs对于理解LncRNAs在癌症进展中的作用至关重要,并可能对发现新的治疗靶点发挥重要作用。
ZFAS1是一种新近发现的LncRNA[12]。最近的证据表明ZFAS1在恶性肿瘤的发生发展中发挥重要作用[13-17]。例如,ZFAS1在乳腺癌[13]、结直肠癌[14,17]、胃癌[15-16]中均有表达改变。此外,ZFAS1的表达与肺癌[18]、结直肠癌[14]、胃癌[15]患者的预后相关。目前罕有关于ZFAS1与食管癌的报道,Shi等[19]发现ESCC组织中的ZFAS1表达明显高于相应的邻近正常组织,且高ZFAS1表达的ESCC患者总体生存率较低,本研究结果与Shi等的发现一致。本研究通过qRT-PCR检测正常食管细胞及食管癌细胞的ZFAS1表达水平,发现食管癌细胞表达ZFAS1水平较正常细胞高。此外,通过干扰Eca-109细胞表达ZFAS1,该细胞的增殖、迁移能力受到明显抑制,且凋亡率升高。以上结果提示ZFAS1在食管癌的进展过程中发挥了促进作用。
近期有研究发现LncRNA可通过靶向内源性RNA发挥作用,即LncRNA可能作为竞争miRNA的竞争性内源RNA(competing endogenous RNA,ceRNA),从而负调控miRNA的表达[20]。Xu等[21]发现LncRNADANCR可作为一个ceRNA在胶质瘤中通过靶向miR-634调控RAB1A的表达。Gao等[22]发现LncRNA FLVCR1-AS1通过靶向miR-573上调E2F3的表达,促进肺癌的增殖和侵袭。为研究ZFAS1作用食管癌的潜在机制,本研究首先通过Starbase数据库预测发现,ZFAS1中存在能够与miR-302b-3p结合的序列,随后用荧光素酶报告基因结果证实miR-302b-3p为ZFAS1的作用靶点。miR-302基因簇首先发现于人类胚胎干细胞,包括miR-302a、miR-302b、miR-302c、miR-302d和miR-367。近年来,miR-302簇已被证明在癌细胞的增殖、分化及其致瘤性中发挥重要作用[23]。目前关于miR-302b-3p的研究较少,Tan等[24]发现过表达miR-302b-3p可通过直接靶向JNK2基因在加速皮肤衰老过程中发挥重要的生物学作用;Guo等[25]发现miR-302b-3p可靶向作用IGF-1R抑制胃癌细胞增殖。此外有研究证实IRAK4和EphA2同样是miR-302b-3p的作用因子。本研究在证实miR-302b-3p为ZFAS1的作用靶点后,分别检测空白组、ZFAS1干扰组及ZFAS1干扰+miR-302b-3p抑制剂组的JNK2、IGF-1R、IRAK4和EphA2蛋白表达变化,结果显示与空白组相比,ZFAS1干扰组的4个蛋白均表达减少,但添加miR-302b-3p抑制剂可逆转此效应,说明ZFAS1在食管癌细胞中通过miR-302b-3p调控JNK2、IGF-1R、IRAK4和EphA2。
综上所述,本研究证实ZFAS1是食管癌的一个新的潜在致癌基因,它可通过促进细胞增殖、迁移及抑制凋亡发挥作用。本研究还发现ZFAS1可以通过ceRNA的方式调控miR-302b-3p下游靶基因JNK2、IGF-1R、IRAK4和EphA2的表达。对参与ZFAS1介导的细胞增殖、迁移及凋亡反应的上下游调控机制尚不清楚。本研究的发现可能为揭示ZFAS1在食管癌发生发展中的作用机制提供新线索,并为食管癌的治疗提供新方向。

