小鼠心肌梗死模型的快速制作方法研究
张宁坤,高连如,赵 力,王丽华,朱 莹,刘秋颖,刘 玲,苗 晨,郝 璐,陈 宇
心肌梗死是心血管疾病中最危急事件[1]。我国每年新发急性心肌梗死约100万人,并有低龄化的趋势,急性心肌梗死死亡率居高不下,研究心肌梗死病因、病理等发病机制,研发新的治疗方法和药物是心血管疾病领域的重要研究方向。在心肌梗死、心力衰竭等心血管疾病基础研究及干细胞移植治疗缺血性心脏病的基础研究中,动物心肌梗死模型被广泛应用,在其模型制作中由于小鼠繁殖力强、易于饲养、价格低廉、占用空间少、操作简便,小鼠染色体在进化的过程中保留了人类同线性基因群,小鼠基因在一定程度与人类基因同源性强[2],通过小鼠模型可从分子、细胞、形态学、发育、电生理和行为等多方面研究人类病因[3],因此,在基础研究中使用小鼠作为动物模型也更为广泛[4-5]。小鼠心肌梗死模型的制作方法有药物法、电刺激法、电凝烧灼法[6]、冷冻法及冠状动脉结扎法,其中冠状动脉前降支结扎法是目前实验中最为常用的心肌梗死造模方法[7],这种方法可直接造成冠状动脉堵塞,实验周期短,可以观察梗死后对心肌的损害[6]。现有的操作方式是将小鼠麻醉后气管插管,机械辅助通气,开胸后进行前降支结扎。此方法操作环节多,耗费时间长,小鼠胸腔开口视野小,心脏搏动快,在胸腔内进针结扎极易扎到心房,是引起小鼠死亡的最多因素。为解决这一问题,本研究对高效快速制作小鼠心肌梗死模型方法经过深入研究[8],强化操作技能训练,建立了一套独特的快速制作小鼠心肌梗死模型的方法,减少操作环节,优化流程,为快速大量制作小鼠心肌梗死模型提供了一个优良的技术方法。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级健康雄性BALB/c小鼠100只,体质量(20±2)g,购于北京科宇动物养殖中心,生产许可证号:SCXK(京)2018-0010。适应性饲养一周后进行实验。
1.1.2 试剂和仪器 异氟烷(江苏恒丰强生物技术有限公司),氧气(北京东方医用气体有限公司),HE染色试剂盒(武汉博士德生物工程有限公司),超声(Vivid7,美国GE公司),显微镜(CKX-41,日本奥林巴斯公司),小动物心电图机(ZS-2000,北京众实迪创科技发展有限责任公司)。
1.2 实验方法
1.2.1 动物麻醉 用气体流量管连接好氧气、麻醉机、气体分流器、麻醉诱导箱,调整异氟烷的浓度为3%诱导麻醉模式,打开分流器将异氟烷与氧气的混合气输入至麻醉诱导箱。每次在麻醉诱导箱中放入5只小鼠,麻醉时间为1 min,小鼠麻醉后,调整麻醉机参数使异氟烷的浓度为1.5%持续麻醉模式,再调整气体分流器将异氟烷与氧气的混合气持续输入至麻醉诱导箱和小鼠手术台呼吸面罩,将已经麻醉的小鼠从麻醉诱导箱中取出,口鼻放入小鼠手术台上呼吸面罩内,小鼠仰卧在手术台,四肢用胶带固定。
1.2.2 模型制作 小鼠左前胸备皮后碘伏消毒,用10 cm手术剪在胸骨左缘第3~4肋间胸大肌前沿剪开皮肤,开口尺寸为0.5~1.0 cm用镊子夹住皮肤,止血钳在皮肤下分离胸大肌与皮肤,再用镊子夹住胸大肌,止血弯钳探入胸大肌下夹住胸小肌进行两者分离,此时明显可见第3~4肋骨,止血弯钳通过3~4肋间探入胸腔左右轻轻分开肋骨,左手在小鼠体外用拇指抵住小鼠腹腔左上部,中指弯曲抵住小鼠腹腔右侧,食指抵住小鼠胸腔右侧。先轻轻用力反复挤压胸腔,待见到心尖部位于胸腔开口处时再同时挤压胸腔,配合调整止血钳撑开肋骨开口大小。随着心脏自主收缩搏动,小鼠心脏游离端即可通过3~4肋间开口跳出胸腔。迅速用7-0缝合线平左心耳下缘进针,向心脏右侧至肺动脉圆锥与心尖部连线处出针,在目视下结扎前降支,左心室前壁(left ventricular anterior wall,LVAW)心肌颜色变淡,止血钳再从心脏下面探入3~4肋间胸腔开口处轻轻撑开肋骨。随着心脏自主收缩,心脏迅速收回到胸腔,左手拇指、食指和中指配合轻轻挤压胸腔,挤出胸腔内空气,用止血钳钳合肋骨,迅速将胸小肌复位于3~4肋间上,胸大肌覆盖于胸小肌之上,胸部皮肤切口两侧钳夹合拢,用6-0号线缝合皮肤切口。术后切口碘伏消毒,脱呼吸面罩,将小鼠置于37 ℃动物复温电热毯上。
1.2.3 心电图检查 在术后进行心电图检查,用针电极刺穿小鼠四肢,电极连接心电图机检测小鼠心电图,观察ST段抬高情况。
1.2.4 超声检查 在术前和术后2周进行超声检查。小鼠胸骨左右两侧皮肤脱毛,使用14.0 MHz高频超声探头检查小鼠心脏左室射血分数(left ventricular ejection fraction,LVEF)、左室收缩末内径(left ventricular end-systolic diameter,LVESD)、左室舒张末内径(left ventricular end-diastolic diameter,LVEDD)、左室短轴缩短率(left ventricular fractional shortening,LVFS)及LVAW厚度。
1.2.5 小鼠心肌组织外观和病理学检查 小鼠心肌梗死模型制作2周后处死小鼠,取出心脏,与正常小鼠的心脏对比观察心脏前壁外观情况,经冠状面切开小鼠心脏,观察LVAW厚度。石蜡包埋心脏进行病理切片,厚度5 μm,进行HE染色,观察LVAW的病理变化。

2 结果
2.1 模型制作成功率 100只小鼠前降支结扎制作心肌梗死模型后,诱导麻醉及持续麻醉期间小鼠心律、呼吸均正常,无死亡,术中无死亡,术后2周内死亡4只,小鼠心肌梗死模型快速制作后存活率达96%。经解剖发现,死亡小鼠因心肌梗死面积过大,导致死亡。而存活小鼠中,2只小鼠超声心功能检查及病理检查未符合心肌梗死表现,心肌梗死模型成功率94%。
2.2 模型制作时间 本方法开胸时皮肤是实际剪开,在分离胸大肌和胸小肌以及分离肋间时均是钝性分离,不进行任何剪切,肌肉没有机械损伤,有利于伤口恢复。术者通过熟练的操作手法完成从开胸、挤出心脏、结扎前降支到关胸的步骤,在(40±10)s内完成(图1)。心脏整体目视下的冠脉前降支结扎可达到100%的结扎率,胸腔开放时间为15~30 s。在关胸同时,通过左手的熟练操作挤压出胸腔空气,覆盖胸小肌、胸大肌及缝合时保证胸腔负压,即刻能恢复自主呼吸,撤除呼吸面罩后,1 min后即可苏醒。

图1 制作小鼠心肌梗死模型操作方法
2.3 心电图检查结果 小鼠Ⅱ导联心电图ST段明显抬高,图2。

图2 小鼠心肌梗死模型制作后心电图
2.4 超声检查结果 M型超声可见,术前小鼠左室舒缩功能节律性强,左室壁正常(图3)。术后较术前LVAW出现节段性运动减弱或消失,梗死区域有心肌强回声,LVAW组织发生重构,舒缩功能减低,左室室壁厚度明显变薄(图4);检查小鼠心功能LVEF较术前降低[(27.5±3.9)%,P<0.01],LVESD较术前增加[(1.07±0.23)mm,P<0.01],LVEDD较术前增加[(1.4±0.29)mm,P<0.01],LVFS较术前降低[(8.1±3.1)%,P<0.05],LVAW较术前降低[(0.44±0.06)mm,P<0.01(图5)。

图3 小鼠心肌梗死模型制作前M型超声

图4 小鼠心肌梗死模型制作后M型超声
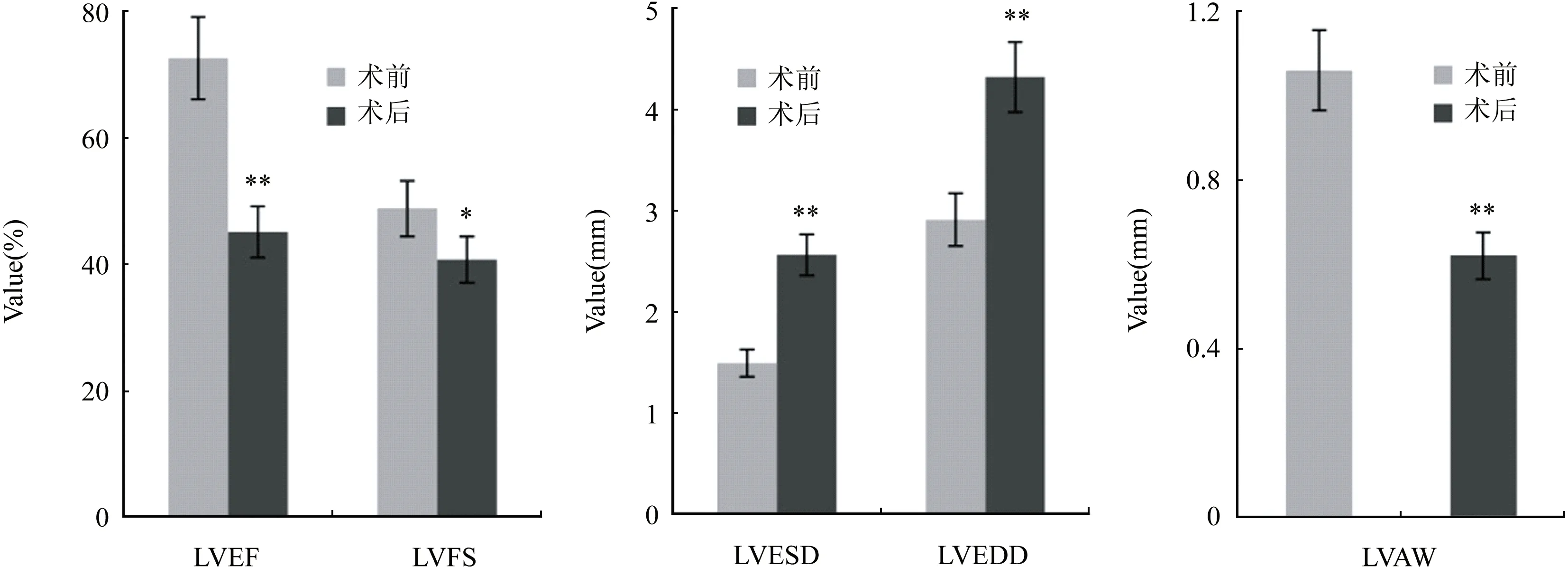
图5 小鼠心肌梗死模型制作前后超声心功能检查
2.5 病理检查结果 小鼠心肌梗死后心脏整体外观,前降支结扎处,LVAW明显凹陷(图6A),正常小鼠心脏整体外观饱满圆润(图7A);心脏冠状切面可见模型小鼠LVAW厚度减低,颜色较其他组织变浅(图6B),较正常小鼠显著减低,正常小鼠LVAW组织饱满(图7B)。病理检查HE染色,可见心肌梗死小鼠LVAW出现大量瘢痕组织,显示心肌梗死后心肌的重构(图6C),而正常小鼠未见异常(图7C)。
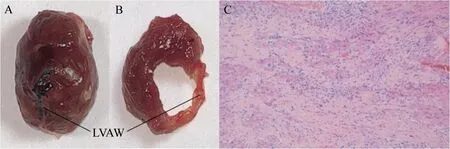
图6 模型小鼠心肌梗死组织
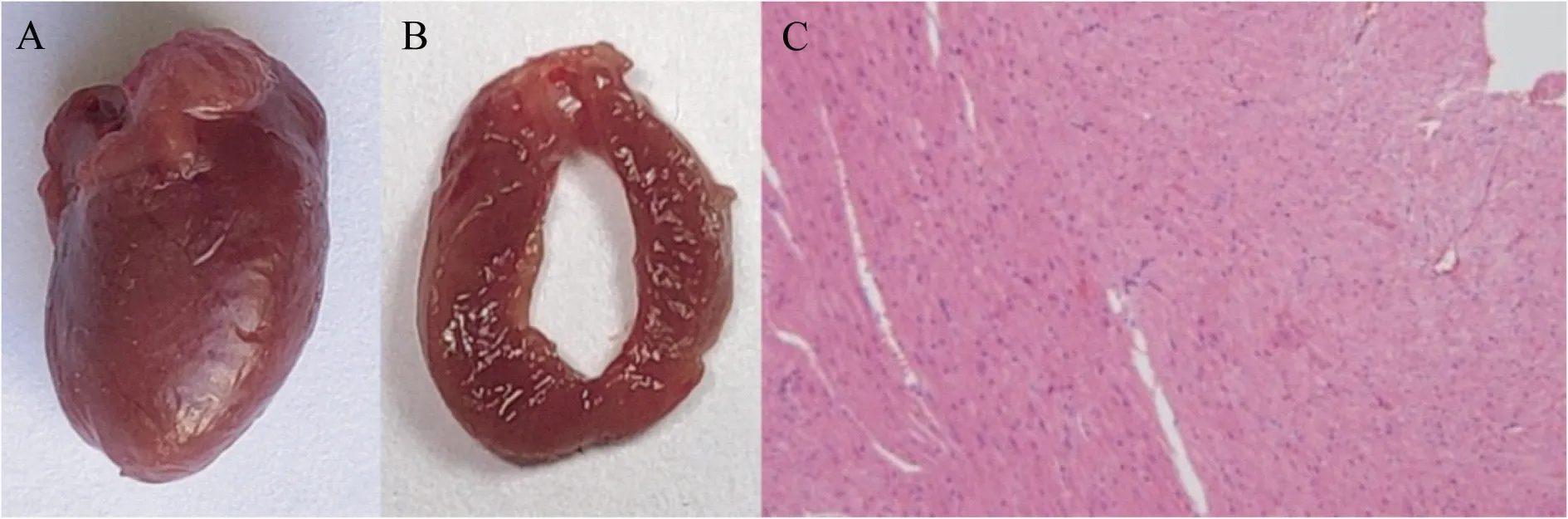
图7 正常小鼠心肌组织
3 讨论
制作小鼠心肌梗死模型直接有效的方法是制造冠状动脉前降支狭窄或堵塞,这种方法研究周期短,可以制造一个比较稳定的缺血病变区,模型制作方便,可重复性强,效果显著,符合临床冠状动脉缺血造成心肌梗死的病理发生发展过程,对研究心肌梗死的病理机制和寻求可采取的治疗方案实用性更强,也更贴近临床[6]。有学者报道,如果未造成完全的冠脉堵塞或形成缺血适应可影响心肌梗死的形成[9]。因此,冠状动脉彻底结扎对制作心肌梗死模型的成功尤为重要。
冠状动脉前降支结扎法是目前国内外常用的建立心肌梗死动物模型的方法,既往的冠状动脉结扎法是经肌肉或腹腔注射麻醉药物,使小鼠持续麻醉,经口气管插管,呼吸机辅助呼吸,开胸结扎前降支。这种方法的优点是:小鼠经麻醉后可保持持续麻醉1 h以上,有充足的时间进行术前准备和冠状动脉前降支结扎[6]。缺点是:①小鼠的气管狭窄,在经口气管插管时对插管的选择非常有限,小鼠的插管因为更细,研究者多用光滑的细软管[10]。在呼吸机辅助呼吸时因为通气压力增高会导致插管的深部与小鼠气管密合不严,从而使通气效率减低,引起小鼠死亡。②开胸结扎的时候,为保证关胸后胸腔闭合好,开口较小,进针易扎到心房或左心耳引起大出血导致小鼠死亡。③呼吸机辅助呼吸使两侧肺组织有规律的膨胀,左肺的膨胀会扩张到胸腔开口处,在开胸或进针结扎前降支时极易损伤肺组织,在关胸后引起气胸等严重并发症,极易导致小鼠的死亡。④肌肉注射麻醉药物,通常使用速眠新、氯氨酮、水合氯醛、戊巴比妥、戊巴比妥钠、丙泊酚及甲托咪定[11]等,在手术操作时间不稳定及小鼠耐受不同的情况下,会导致麻醉药物的麻醉效果降低;如果再追加麻醉药物大多效果不佳。如果追加过量,手术后较长时间小鼠不易苏醒,而且由于中枢神经的抑制、体温下降、无法自主呼吸最终死亡率增高。
本方法将小鼠的心脏挤出胸腔,目视下结扎冠状动脉前降支,视野开阔目标清晰。也有学者尝试了这种方法,但操作难度太大,主要是开胸和挤出心脏时方法不正确,时间较长,死亡率高[12]。本研究团队进行了大量的学习和强化训练后,优化了操作环节,压缩各步骤的操作时间来完成小鼠心肌梗死模型的制作,突出的优点是:①在熟练的操作流程下,短时间内完成手术,不需要气管插管,麻醉使用异氟烷与氧气混合气体经呼吸面罩输送给小鼠进行全身麻醉[13],此麻醉方法与肌肉注射麻醉药物的方法都是抑制小鼠中枢神经达到麻醉效果,本方法麻醉效率高,给小鼠输入麻醉混合气体后,通常在1 min左右迅速达到麻醉效果,撤除麻醉混合气体后,小鼠短时间内即解除对中枢神经系统抑制,很快苏醒,有时苏醒的时间不会超过1 min,避免了小鼠术后持续抑制中枢神经而引起的一系列后果。②在开胸结扎前降支时只有皮肤是剪开的,其余的肌肉组织分离都是钝性分离,肋间开口能使心脏移出胸腔即可,开口不宜过大,避免了不必要的失血和后续关胸不严造成气胸的严重问题,利于伤口愈合和呼吸功能在术后的迅速恢复。通过术者的熟练操作手法,可迅速将心脏挤压出胸腔,心脏在胸腔外,肉眼直视可以清晰看到冠状动脉前降支,心脏嵌在胸腔开口处更容易被固定,减少快速心律对心脏位置固定的影响,对进针结扎前降支及出针位置会掌握的非常准确,不会引起误扎心房和左心耳导致出血和心律失常等并发症的发生。关胸时术者顺势挤压出胸腔气体,止血钳闭合两肋骨迅速覆盖胸大肌和胸小肌,建立胸腔负压,保持小鼠正常呼吸。从止血钳进入胸腔到挤出心脏、结扎前降支、关闭胸腔这段操作过程的时间只有15~30 s,在胸腔开放的过程中,可以造成小鼠肺不张的情况,因为胸腔开放的时间非常短,不需做其他处理,心脏回复到胸腔后迅速关胸腔,关胸的过程同时制造了胸腔的负压状态,肺不张的情况立即缓解,恢复正常呼吸。操作过程中无因肺不张而导致小鼠呼吸困难和死亡的情况,这是本研究的重点核心步骤,操作过程几乎没有影响到小鼠的自主呼吸,撤除麻醉后即可苏醒。
判定小鼠心肌梗死模型是否成功,通常使用超声或心电图检查,为实现交叉印证心肌梗死情况,可以使用多因素共同判断,①心电图判断,小鼠的心肌梗死心电图与大鼠类似,在心肌梗死模型制作完成后,连接肢体导联,2个或2个以上相邻导联Q波形成且>1/4R波,宽度>0.04 s,ST段抬高0.2 mV可判定为心肌梗死[14]。②超声检查心功能,小鼠体积小,胸壁薄距心脏距离短,要使用高频探头进行检查[15],通常用12~14 MHz超声探头,小鼠心肌梗死2周后,梗死部位即发生心肌组织重构,与术前相比LVEF和LVFS会明显减低,LVESD和LVEDD会明显增加,LVAW厚度明显减低、运动功能明显减弱。③直观心肌前壁组织变化,处死小鼠取心脏后,观察LVAW与正常小鼠的不同,心肌梗死小鼠LVAW凹陷,颜色变白,厚度明显低于正常组小鼠LVAW认为心肌组织已经因为心肌梗死发生严重的心肌重构。④病理学检查,心肌重构的部位心肌细胞丢失严重,瘢痕组织会代替丢失的心肌细胞,失去活力,HE染色可见明显的瘢痕组织形成,为心肌梗死后心肌重构的重要表现。
以本研究方法制作的心肌梗死模型,小鼠死亡率低,成模率高,减少了手术操作的时间,可以在短时间内大量迅速制作小鼠心肌梗死模型,提高了大规模制作小鼠心肌梗死模型进行相关实验研究的效率。

