HMGB1-RAGE/TLRs-NF-κB信号通路中关键蛋白的表达与糖尿病肾病的关系
高 啸,沈 莹
糖尿病是一种代谢性疾病,患者长期血糖水平异常偏高,或与高血压共存,长此以往易造成器官受损、功能障碍或衰竭[1-2]。糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重并发症之一,约25%糖尿病患者终末期患上肾脏疾病[3]。尽管在DN治疗方面取得了进步,但近年来发病率仍在急剧上升[4]。当前的治疗包括控制血压和血糖、降血脂以及保证肾功能,终末期患者使用透析或肾脏移植治疗等。但此类治疗仅用于减缓疾病的进展,还需要新的生物标志物和疗法以减轻疾病的负担并控制其他并发症。研究表明,高迁移率族蛋白B1(high mobility group protein B1,HMGB1)、晚期糖基化终产物受体(receptor of advanced glycation endproducts,RAGE)、Toll样受体(toll-like receptor,TLR)和核转录因子-κB(nuclear factor kappa-B,NF-κB)的一系列复杂机制在糖尿病慢性炎症的发展中起着重要作用[5]。本研究拟观察DN模型小鼠体内上述几种蛋白表达情况,进一步探讨HMGB1-RAGE/TLRs-NF-κB信号通路中关键蛋白与DN的关系。
1 资料与方法
1.1 实验动物和模型建立 C57BL/6雄性小鼠(8~9周)购于广东省医学实验动物中心[SCXK(粤)2008-0002,粤监证字2008D007],适应性饲养1周,饲养条件为12 h光照周期,温度为(21.0±2.0)℃,相对湿度为50.0%~70.0%,自由进食、水。动物实验经医院实验动物伦理委员会审批通过。注射日小鼠禁食禁水4 h,每日静脉注射链脲菌素(STZ,1 g/瓶,北京索莱宝科技有限公司)55.0 mg/kg,连续5 d,共注射15只。同时给予15.0 g/L蔗糖水48 h。注射完成1周后,检测空腹血糖,若大于16.0 mmol/L,则视为糖尿病小鼠;糖尿病小鼠继续饲养,4周后出现尿蛋白,标志DN模型建立成功[6]。共构建DN模型成功12只,随机分为DN组和治疗组,每组各6只小鼠。用生理盐水替代STZ以相同方式给予另一批小鼠,作为对照组(共6只)。其中治疗组小鼠给予胰岛素(国药准字H10890001,江苏万邦生化医药股份有限公司)皮下注射治疗,1/d,每次2.0 U。以造模成功后为第0周,共治疗4周。DN组和对照组小鼠注射同等量生理盐水代替胰岛素,注射时间和剂量相同。
1.2 HMGB1拮抗剂A Box对小鼠DN模型的影响将DN组6只小鼠随机抽取3只给予人重组HMGB1拮抗剂A Box(HMGBiotech Srl公司,意大利)注射,另外3只小鼠以生理盐水替代A Box注射,每次400.0 μg,每周3次,共处理10周;对照组同样方法处理。
1.3 样品收集 DN组于建模完成后1 d、3 d和1周取尾部静脉血2 mL,治疗组控制血糖在10 mmol/L内后1 d、3 d和1周后取尾部静脉血2 mL,对照组小鼠和DN组同期取1 d、3 d和1周尾部静脉血2 mL,以检测相关蛋白和mRNA水平。建模14周后,处死全部小鼠,收集血液用以检测血糖水平,收集尿液用以对尿白蛋白定量。收集肾脏、脾脏和胰腺组织切片用10%中性缓冲的福尔马林固定以进行石蜡包埋,冷冻于OCT化合物中或速冻于液氮中以进行mRNA提取。
1.4 指标检测
1.4.1 小鼠尿白蛋白定量和血糖检测 使用酶联免疫吸附法(ELISA)定量集(Bethyl Laboratories公司,蒙哥马利,TX,USA)对白蛋白进行定量。取尾静脉血使用血糖仪监测其含量。
1.4.2 HMGB1-RAGE/TLRs-NF-κB信号通路关键蛋白水平检测 使用ELISA法检测HMGB1、RAGE、TLR2、TLR4和NF-κB蛋白水平,试剂盒购于Shino-TestCorporation(日本Kanagawa公司)。利用实时反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测HMGB1、RAGE、TLR2、TLR4和NF-κB mRNA水平,所有结果均以2-ΔΔCt法计算和表示[7]。
1.4.3 组织学染色 将固定在福尔马林中的肾脏切片使用高碘酸-席夫染色(periodic acid-schiff,PAS)和天狼星红染色(picro sirius red stain,PSR),全部操作按照试剂盒说明书步骤完成。在PSR染色切片上对肾小管间质胶原进行评估,光镜下放大切片(×400),选取连续20个视野,计算网格中肾小管间质胶原所占的百分比[8]。只计算肾小管间质胶原,排除血管和肾小球。

2 结果
2.1 各组小鼠一般情况比较 与对照组比较,DN组和治疗组小鼠体质量、血糖和尿白蛋白定量均明显增加(t分别为6.782、10.806、9.712,P<0.01;t分别为6.533、3.161、7.208,P<0.01);与DN组比较,治疗组上述各指标均明显下降(t分别2.324、7.038、2.942,P<0.05),表1。DN组小鼠PAS染色可见肾小球肥大,系膜细胞增生系膜基质增多增厚,治疗组肾小球肥大情况缓解,图1。
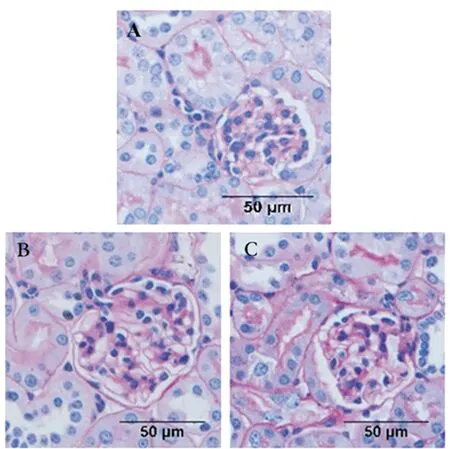
图1 3组小鼠肾脏肾小管PAS染色(×400)
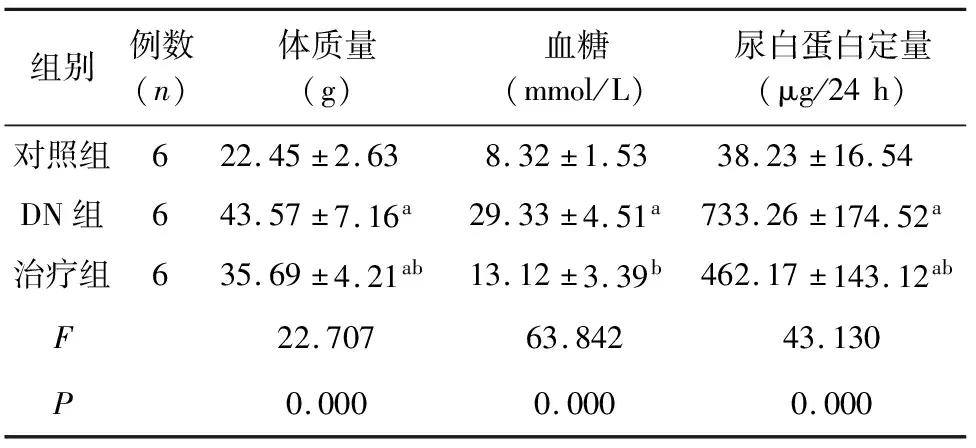
表1 3组小鼠一般情况比较
2.2 3组小鼠的HMGB1、RAGE、TLR2、TLR4及NF-κB水平变化 DN组建模完成后1 d、3 d和1周HMGB1、RAGE、TLR4,NF-κB水平均较对照组明显升高(P<0.05),治疗组小鼠控制血糖在10 mmol/L内后1 d、3 d和1周后的HMGB1、RAGE、TLR2、TLR4和NF-κB水平均较对照组明显升高(P<0.05);与DN组比较,治疗组各时间段上述几种蛋白水平均明显偏低(P<0.05,表2)。
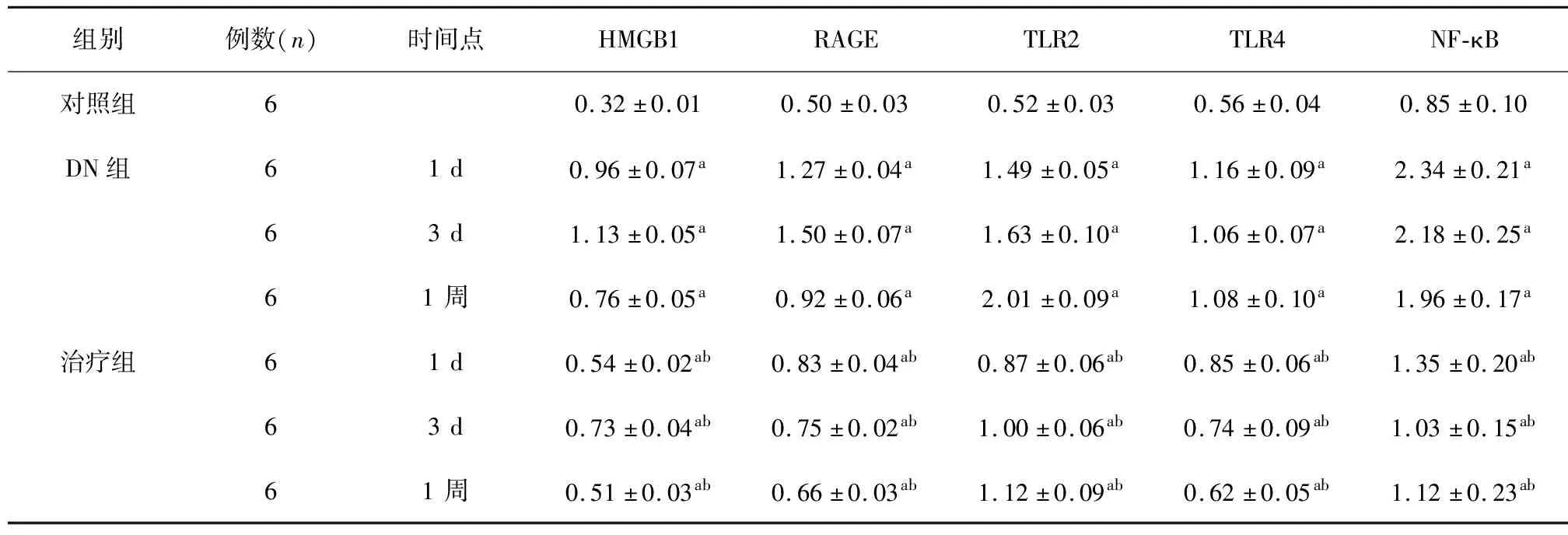
表2 DN小鼠不同时间点HMGB1、RAGE、TLR2、TLR4和NF-κB水平变化(μg/L)
建模完成各时间段DN组和治疗组HMGB1、RAGE、TLR2、TLR4和NF-κB mRNA水平均明显高于对照组(P<0.01);与DN组比较,治疗组各时间段上述几种mRNA水平均明显偏低(P<0.05),表3。

表3 DN小鼠不同时间点HMGB1、RAGE、TLR2、TLR4和NF-κB mRNA水平变化(2-△△Ct)
2.3 HMGB1对小鼠DN模型的影响 在DN模型小鼠肾小管间质观察到明显间质胶原蛋白沉淀,对照组小鼠中未观察到。给予A Box后,生理盐水处理小鼠组织学染色无明显变化(t=0.086,P=0.933),DN模型小鼠沉淀明显减少(t=3.014,P=0.013),表4,图2。

表4 HMGB1对小鼠DN模型肾小管间质胶原蛋白百分比的影响
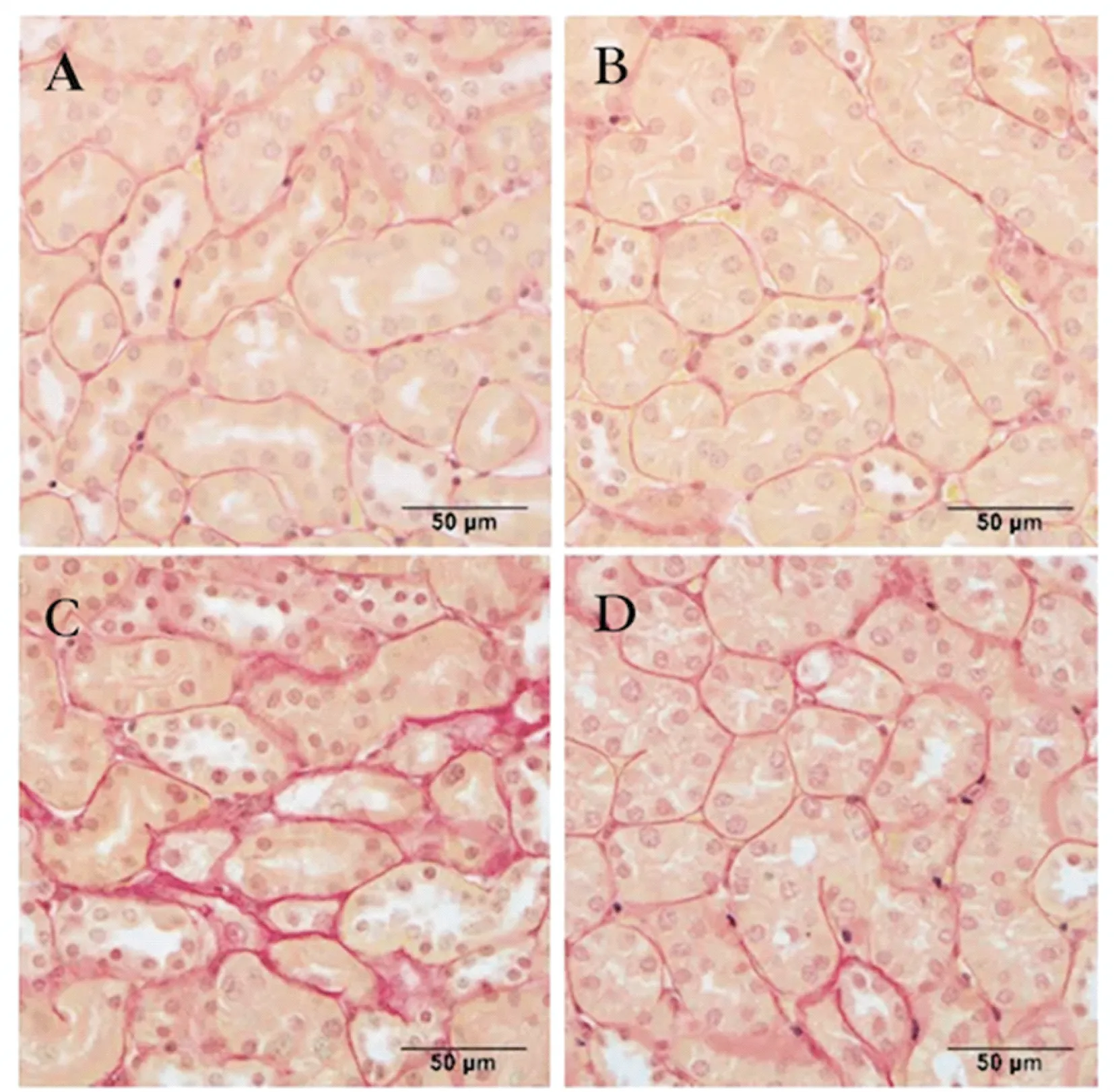
图2 HMGB1 A Box对肾脏肾小管间质的影响(PSR染色×400)
3 讨论
糖尿病高血糖导致细胞代谢反应的各种变化,包括活性氧生成的增加和晚期糖基化终产物(advanced glycation end products,AGEs)的形成[9-10]。后者可以与各自的受体(RAGE)相互作用,诱导一系列代谢反应,导致促炎细胞因子的产生和分泌[11-12]。进一步研究发现,一系列促炎症介质都与糖尿病的发病有关,包括肿瘤坏死因子-α、白细胞介素-1b、白细胞介素-8和HMGB1等[13]。HMGB1本身可以通过RAGE、TLR2和TLR4发出信号,最终导致NF-kB的激活,NF-kB在造血细胞和内皮细胞中诱导白细胞粘附分子的上调和促炎细胞因子和血管生成因子的产生,从而促进炎症[14]。此外,NF-kB的激活诱导HMGB1受体的表达,增加HMGB1的分泌可介导炎症和血管生成的放大,并增加与其相互作用的受体的表达,从而形成HMGB1-RAGE/TLRs-NF-κB信号通路。本研究中,通过注射STZ建立DN模型,后通过胰岛素治疗小鼠模型,发现DN小鼠肾小球明显肥大、血糖和尿白蛋白明显升高,符合模型临床表现。本研究检测HMGB1-RAGE/TLRs-NF-κB信号通路中各种关键蛋白的表达,结果显示,DN模型小鼠体内HMGB1、RAGE、TLR2、TLR4和NF-κB蛋白和mRNA水平均明显高于对照组(P<0.05)。但DN模型小鼠经胰岛素治疗后,上述蛋白和mRNA水平均明显下调,说明在DN中HMGB1、RAGE、TLR2、TLR4和NF-κB表达均明显上调,与既往研究结果一致。
另外,本研究验证了一种假设,即HMGB1可阻断HMGB1-RAGE/TLRs-NF-κB信号通路中关键蛋白的表达从而阻止DN的发展。先建立DN模型,后给予HMGB1拮抗剂A Box,特异性的拮抗HMGB1与TLRs和RAGE的结合。通过PSR染色观察了肾小管间隙胶原蛋白沉淀情况。结果显示,给予HMGB1 A Box后DN小鼠间质胶原蛋白沉淀明显减少。肾脏受损伤后会形成各种慢性不可逆的改变,肾小管间隙被大量间质胶原蛋白和细胞外基质等替代,终致使间质纤维化,而这种纤维化的程度与范围均与肾损伤密切相关[15]。因此,HMGB1的拮抗可抑制肾损伤的进一步发生,也说明HMGB1 A Box为防止DN的发展提供了重要的保护。
综上所述,HMGB1-RAGE/TLRs-NF-κB信号通路关键蛋白HMGB1、RAGE、TLR2、TLR4和NF-κB在糖尿病肾病小鼠中表达增高,阻断HMGB1和RAGE、TLRs结合,能够阻止DN发展。

