基于纳米金/聚赖氨酸修饰的丝网印刷电极免疫传感器对双酚A的灵敏检测
何祖宇,李普旺,周 闯,王 超,吕明哲,宋书会, 刘运浩,杨子明*
(1.中国热带农业科学院南亚热带作物研究所 海南省热带园艺产品采后生理与保鲜重点实验室, 广东 湛江 524091;2.中国热带农业科学院农产品加工研究所,广东 湛江 524001)
双酚A (BPA)是一种重要的化工原料,常用于合成环氧树脂、聚碳酸酯、不饱和聚酯树脂、聚砜树脂等多种高分子材料,广泛应用于奶瓶、饮料瓶、食品等日常消费瓶的包装内衬[1-2]。研究表明,BPA 具有类雌激素的作用,即使很低的剂量也会干扰正常性激素的分泌,从而影响人类的生殖功能[3]。在日常生活中,BPA会随着食品、饮料的包装溶解扩散到水体或土壤中,通过生物富集作用进入人体,给人们的生活健康带来极大的危害[4]。目前用于检测BPA的方法主要有高效液相色谱法及高效液相色谱-质谱联用法[5-6]、气相色谱法[7]、荧光光谱法[8]、电化学法[9-10]等。色谱和光谱法需要复杂、昂贵而精密的设备和专业培训的操作人员,样品检测前需要进行预处理、提取、纯化等过程,耗时耗力,限制了其广泛使用。而电化学方法由于选择性好、灵敏度高且操作简便等优点,目前备受人们关注[11-12]。
丝网印刷电极是指采用丝网印刷技术通过层层沉积将油墨印刷在惰性固体平面基质上,利用丝网或刻空模版形成电极图形后,再通过电极烘烤将油墨中溶剂去除,制备得到的定型固化电极[13]。丝网印刷电极具有制造工艺简单、成本低、设计灵活、重复性好、便于携带且能够大规模生产等优点[14-15],能满足快速准确的原位分析和便携式设备开发日益增长的需求,因此已成功用于商业化。迄今为止,基于不同的分子识别元件,已开发了酶传感器[16]、核酸传感器[17]、分子印迹传感器[18]、免疫传感器[19]等丝网印刷电极电化学传感器,并获得较好的检测性能。
本文采用丝网印刷碳电极(SPCEs)为工作电极,在电极表面电沉积聚L-赖氨酸(PLL)和纳米金颗粒,以提高对抗原的固定能力,通过构建BPA电化学免疫传感器,实现了对BPA的灵敏检测。
1 实验部分
1.1 试剂与仪器
双酚A标准品(光谱纯,百灵威科技有限公司);L-赖氨酸(PLL,分析纯,阿拉丁试剂有限公司);四氯金酸(氢醌,分析纯,国药集团化学试剂有限公司);30%过氧化氢、对苯二酚(氢醌,分析纯,广州化学试剂厂);双酚A抗原(质量浓度为5.00 mg/mL)、双酚A单克隆抗体(一抗,质量浓度为10.00 mg/mL),均为实验室自制;HRP标记的羊抗鼠IgG抗体(二抗,Santa Cruze 公司);其他试剂均为分析纯;实验用水均为去离子水。
丝网印刷碳电极(长三角系统生物交叉科学研究院有限公司);CHI660D电化学工作站(上海辰华仪器有限公司);JC-2000C1接触角测量仪(上海中晨数字技术设备有限公司);KQ-50B超声波清洗器(昆山超声仪器设备有限公司);HH-W-420数显恒温水箱(金坛市江南仪器厂)。
1.2 实验步骤
1.2.1 SPCEs/PLL/AuNPs电极的制备SPCEs的前处理:先用水将剪裁好的SPCEs冲洗干净并用氮气吹干表面,然后将电极浸泡至1/15 mol/L PBS(pH 7.4)中,在恒电位1.7 V下活化4.0 min,最后用水洗净电极,吹干,待用。
SPCEs/PLL的制备:将上述前处理好的SPCEs电极浸泡至1.0 mg/mL PLL溶液中,在-0.3~0.3 V电压和0.05 V/s扫描速度下进行循环伏安(CV)扫描5圈,再将电极水洗,吹干,待用,制得SPCEs/PLL。
SPCEs/PLL/AuNPs的制备:将上述PLL修饰的SPCEs电极浸泡至含0.5 mmol/L HAuCl4的0.5 mol/L硫酸溶液中,在恒电位1.5 V下电沉积4.0 min后,将电极水洗,吹干,待用,制得SPCEs/PLL/AuNPs。
1.2.2 免疫传感器的整体构建在SPCEs/PLL/AuNPs电极表面滴加5 μL抗原(Antigen,Ag)溶液,37 ℃下恒温恒湿反应1 h。洗涤吹干后,在电极上滴加5 μL封闭液,37 ℃下恒温恒湿反应1 h。洗涤吹干后,在电极上滴加5 μL一抗(Primary antibody,Ab1),37 ℃下恒温恒湿反应1 h。洗涤吹干后,继续在电极上滴加5 μL 稀释200倍的HRP酶标二抗(HRP-labeled secondary antibody,HRP-Ab2),在37 ℃下恒温恒湿反应1 h,洗涤吹干备用。
1.2.3 氢醌/双氧水(HQ/H2O2)体系下的电化学行为研究经上述免疫反应的电极在CHI660D电化学工作站上进行性能测试:将电极浸泡至10 mL 1 mmol/L HQ缓冲液(pH 7.4)中,在-0.4~0.5 V电压和0.1 V/s扫描速度下CV扫描1圈,记录还原峰电流。然后加入30 μL 0.5 mol/L H2O2溶液,搅拌均匀,在上述条件下继续CV扫描1圈,记录还原峰电流,并计算加入H2O2溶液前后还原峰电流的差值,即为BPA免疫传感器的响应信号(ΔI)。
1.3 实验条件的优化
抗原浓度的优化:通过改变抗原浓度的稀释倍数,其他条件控制不变,根据响应信号与抗原稀释倍数的关系,选取合适的抗原稀释倍数。同理,本实验优化了一抗的稀释倍数、一抗的孵育时间以及检测体系的pH值。
1.4 竞争型免疫检测
在最优检测条件下,将BPA标准液与一抗混合均匀,滴加至已固定抗原的电极表面,使BPA和已固定的抗原竞争有限的一抗。通过不同浓度的BPA与一抗混合,获取BPA标准溶液浓度与响应电流信号的关系,并计算得到lgCBPA与响应信号的标准曲线。
2 结果与讨论
2.1 免疫传感器检测原理
本文构建的BPA免疫传感器的检测原理如图1所示,首先在SPCEs表面电聚合一层PLL膜,接着在电极表面电沉积金纳米颗粒;随后进行免疫传感器的整体构建,将抗原吸附到SPCEs/PLL/AuNPs电极表面后,滴加脱脂奶粉封闭非特异性位点,进一步滴加BPA小分子与一抗混合液进行竞争免疫反应;最后加二抗与一抗进行反应,根据二抗上标记的HRP催化H2O2氧化氢醌产生峰电流的大小得出相应响应电流,拟合标准曲线。其中,辣根过氧化物酶(HRP)通过HQ/H2O2体系催化氧化H2O2,可能的反应机理如下[20]:
HRP(Fe3+)+H2O2→ Compound(Ⅰ)+H2O
(1)
Compound(Ⅰ)+HQ → Compound(Ⅱ)+BQ
(2)
Compound(Ⅱ)+HQ → HRP(Fe3+)+BQ +H2O
(3)
BQ +2H++2e → HQ(电极反应)
(4)
HQ和BQ分别表示氢醌以及氢醌的氧化态。当存在H2O2时,HRP被氧化成化合物(Ⅰ),接着化合物(Ⅰ)与HQ反应,使HQ被氧化成BQ。在CV扫描过程,当HQ被消耗时,CV图中氧化峰电流值下降。HQ被消耗的同时会产生更多的BQ,相反,还原峰电流会迅速增加,此传感器的检测信号由酶催化H2O2产生的还原峰电流变化值来描述。
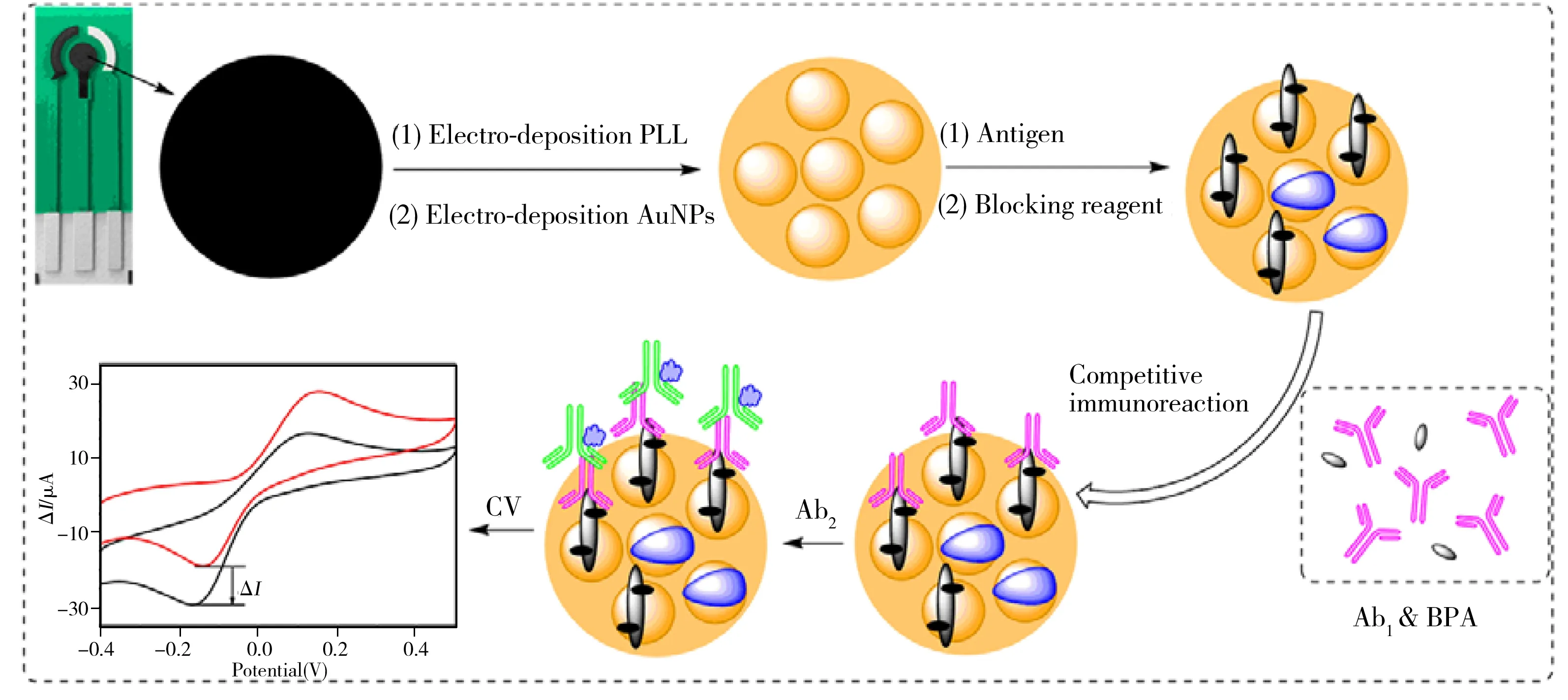
图1 基于SPCEs/PLL/AuNPs的BPA免疫传感器的检测原理图Fig.1 Principle of BPA immunosensor based on SPCEs/PLL/AuNPs
2.2 SPCEs前处理及表面修饰效果分析
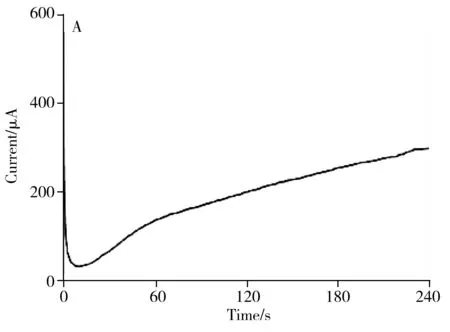
SPCEs属于三电极体系的一种,参比电极是银电极,对电极和工作电极均为碳电极。SPCEs的导电性能对免疫传感器的性能影响很大,其导电能力强,则传感器的检测灵敏性高,得到的实验结果误差较小,反之亦然。未作任何处理的SPCEs工作电极因表面较粗糙,导电性能较差。根据SPCEs的设计特点,由于不能进行打磨、抛光等前处理,因此选取电化学方法进行前处理最为快捷有效。本实验以1/15 mol/L PBS溶液为导电介质,在1.7 V电压下采用计时伏安法对电极进行电化学活化4 min。由图2A可以看出,随着电活化的进行,SPCEs的活化电流逐渐增大,由开始的几十微安提高到300 μA左右,可以推测电极的导电能力大大增强。活化电流提高的原因可能是,随着电活化的进行,工作电极表面不稳定的物质被分解,同时其表面粘附力弱的物质脱落,导致工作电极电阻降低,导电性能提高,电流增大。
为进一步证明电极的活化效果,将未活化和已活化的SPCEs分别浸泡在5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]电解液中进行CV扫描(见图2B曲线a、b)。结果显示,未活化的SPCEs氧化峰电位和还原峰电位的间距(ΔE)约为800 mV,Ipa/Ipc也偏离1较远,表明未活化SPCEs上的电极反应为非可逆的氧化还原反应,不利于工作电极表面反应的进行;活化后SPCEs的氧化峰电位和还原峰电位的间距大大减小,ΔE约为250 mV,氧化还原峰的峰电流均增强,且Ipa/Ipc约等于1,说明活化后SPCEs电极上的电极反应为可逆反应,活化后的电极表面具有更好的电化学活性,并且有效地提高了电子的传输速率。
本研究通过电聚合法将PLL修饰至SPCEs,并将修饰电极浸泡至5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中进行CV扫描,以表征PLL是否修饰到电极表面(图2B曲线c)。结果显示,相比于覆盖PLL前,SPCEs工作电极覆盖了一层PLL后,其ΔE略有增加,而氧化还原峰电流减小,这是由于PLL膜表面含有丰富的带负电的羰基,阻止了[Fe(CN)6]3-/[Fe(CN)6]4-离子靠近工作电极,因此电流传输速度降低,氧化还原峰电流减小[21]。实验结果也表明PLL已成功电聚合至电极表面。
同理,本文通过将SPCEs/PLL浸泡在5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中并进行CV扫描,表征PLL修饰电极表面是否成功电沉积纳米金颗粒(图2B曲线d)。结果显示,其还原峰电流比PLL修饰电极提高约13 μA。这是因为金具有非常好的导电性能[22],使得纳米金修饰的电极可得到较大的还原电流值,且依然保持良好的可逆性能,从而为后续免疫传感器的构建奠定了坚实基础。

图3 不同SPCEs电极表面与水的接触角Fig.3 Contact angles of different SPCEs with water A:unactivated SPCEs,B:activated SPCEs,C:SPCEs/ PLL,D:SPCEs/PLL/AuNPs
2.3 SPCEs的亲水性研究
SPCEs电极表面的亲水性对免疫传感器的构建具有重要影响。本文同时测定经不同方法处理的电极工作表面与水的接触角,实验结果如图3所示。结果显示,未处理过的SPCEs电极表面与水的接触角为131°,电活化后的SPCEs电极表面与水的接触角为110°,经PLL修饰后SPCEs/PLL电极表面与水的接触角为81°,经纳米金/PLL修饰后SPCEs/PLL/AuNPs电极表面与水的接触角为76°。可见,随着处理的进行,接触角不断减小,表明电极表面的亲水性进一步提高。这是由于未作任何处理的电极表面有较多疏水性的物质,所以电极表面亲水能力很低。电活化处理后的电极,电极表面杂质减少,亲水能力提高,但接触角仍然大于90°,电极表面不容易被润湿,表现为疏水。电极表面经PLL改性后,由于PLL薄膜表面具有丰富的羰基、氨基等基团,因此,电极表面的亲水性得到大大提高(接触角81°),电极表面从疏水变为亲水。经纳米金进一步修饰,电极表面的接触角进一步减小。由于金表面带有较多的电荷且金纳米颗粒的表面能较高,从而增强了电极表面亲水性。通过电化学活化、覆盖PLL膜、电沉积纳米金等过程,工作电极由疏水变为亲水,亲水性得到较大提高,为后续免疫传感器的构建提供了良好基础。
2.4 实验条件的优化
在电化学免疫传感器的制备中,对构建过程以及免疫反应过程中的条件进行优化对于发挥传感器的性能非常重要。本文对抗原的稀释倍数、一抗的稀释倍数、一抗的孵育时间以及电化学检测体系的pH值进行了优化。
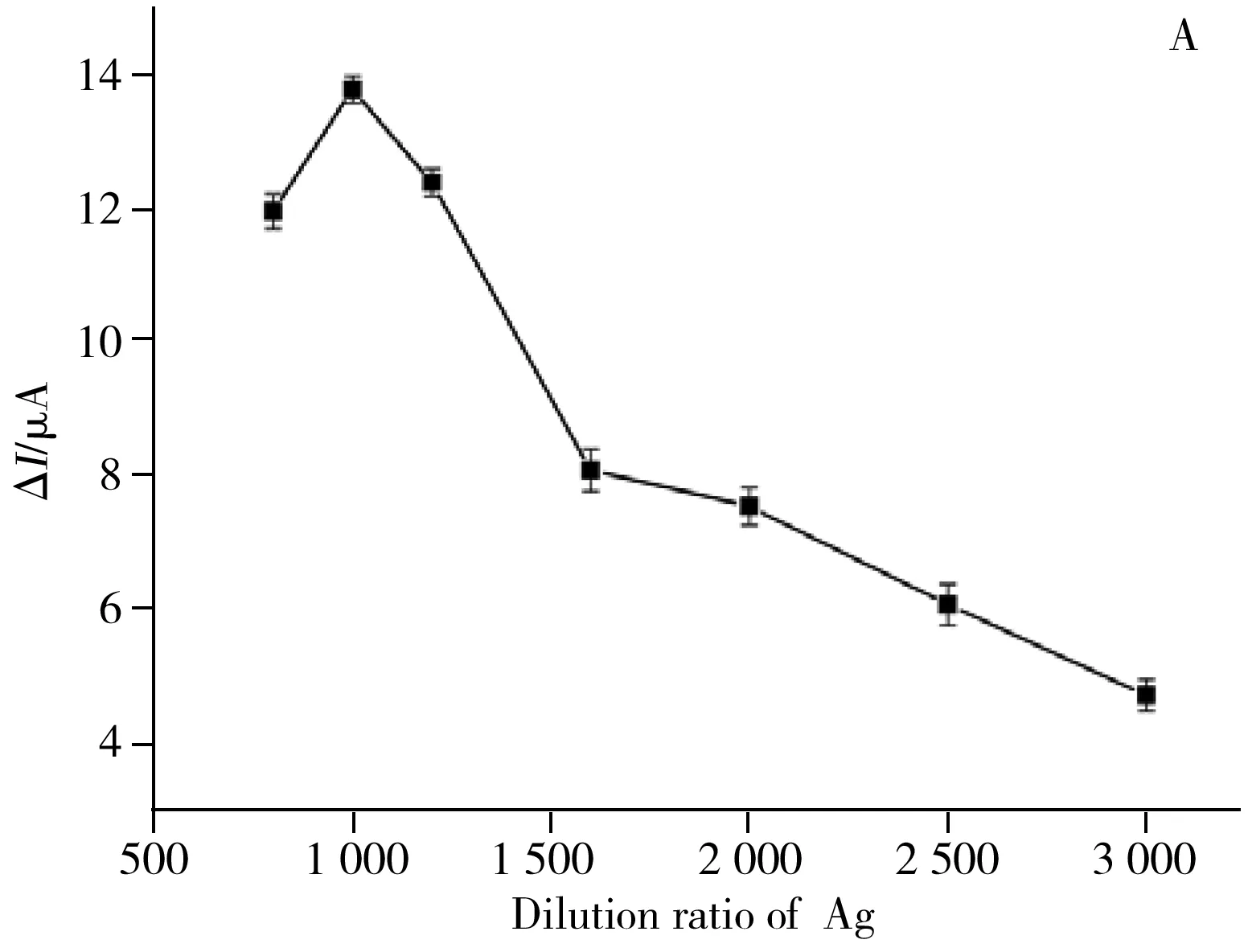
2.4.1 抗原稀释倍数的优化依据竞争型免疫分析原理,固定到电极工作界面上抗原量的多少直接影响免疫分析的信号大小以及灵敏度。一方面,固定的抗原过少会使得到的响应信号偏小而易被噪声干扰,降低免疫传感器的稳定性以及灵敏度;另一方面,固定的抗原过多会使得其与抗体结合的竞争能力相对于样品中待测物过强,而降低免疫分析的灵敏度。因此,选取合适的抗原稀释倍数才能获得良好的检测结果。本实验通过控制其他条件不变,梯度改变抗原的稀释倍数为3 000、2 500、2 000、1 600、1 200、1 000和800倍,由此得到抗原稀释倍数与响应信号大小的关系(图4A)。结果显示,当抗原的稀释倍数从3 000倍减小至1 000倍时,响应信号逐渐增加。这主要是因为随着抗原浓度的增大,相同时间内结合到电极表面的抗原增多,进一步结合一抗、二抗的抗原越多,则响应信号越大。但当抗原稀释倍数继续减小至800倍时,电极表面固定的抗原已达到饱和,致使空间位阻增大,影响了抗原与一抗的结合率,因此响应信号反而减小。综合考虑,选取1 000倍作为抗原的最佳稀释倍数。
2.4.2 一抗稀释倍数的优化在竞争型免疫分析中,由于加入的一抗可同时与被固定的抗原或样品中的待测物发生特异性结合,所以加入一抗量的多少对免疫分析有重大影响。若加入一抗的量过少,会使特异性结合到电极工作界面的一抗很少而得不到理想的响应信号;若加入一抗的量过多,则会削弱电极界面上抗原与游离代谢物之间的竞争关系,无法检出低浓度的待测物。固定抗原稀释倍数为1 000倍,改变一抗稀释倍数为3 000、2 000、1 600、1 000和800倍,体系的响应信号如图4B所示。随着Ab1稀释倍数的不断减小,即抗体浓度不断增大,传感器的响应信号逐渐增强。当稀释倍数继续减小时,信号开始快速增加,且一抗稀释800倍和1 000倍的信号相当。考虑到高浓度一抗会削弱传感器对低浓度小分子的检测灵敏度,因此,本研究选择1 000倍作为一抗的最佳稀释倍数。
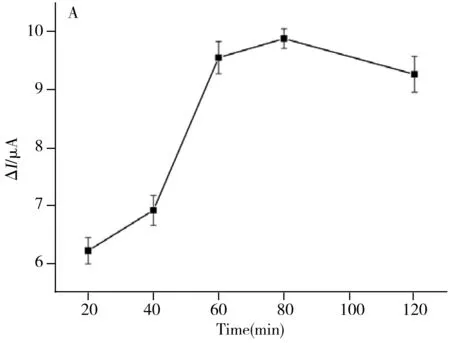
2.4.3 一抗孵育时间的优化选定抗原和一抗稀释倍数为1 000倍,考察了一抗的孵育时间分别为20、40、60、80和120 min时免疫传感器的检测信号,结果如图5A所示。由图可知随着一抗孵育时间的增大,免疫传感器的响应信号先增大后减小,因此选择最佳的一抗孵育时间为60 min,以获得较好响应信号,同时可以节省时间。
2.4.4 pH值的优化本方法的电化学信号来源于偶联在二抗上的HRP对H2O2的催化作用。HRP是一种铁卟啉蛋白,其催化活性易受外界条件的影响。因此,在电化学测试过程中,选取合适的pH值是保证HRP良好催化活性的重要条件。在室温条件下,通过改变检测体系的pH值为5.29、5.91、6.81、7.38、8.04、8.67,得到响应信号与检测体系pH值的关系曲线(图5B)。从图中可以看出,测试体系偏酸或偏碱时,响应信号均较小,这是由于一般蛋白质在酸性或碱性条件下易变性,导致催化效率降低。当测试体系的pH为7.38时,其响应信号最大,由于pH 7.4的环境在免疫分析中最为常用,本实验选取pH 7.4为最佳pH值。
2.5 免疫传感器对双酚A标准溶液的检测
在最优条件下,通过测定一系列不同质量浓度的BPA标准溶液(0.5、1、5、10、50、100、250 ng/mL),得到响应信号与BPA浓度的关系。结果显示,当BPA的质量浓度在1~250 ng/mL范围内,其质量浓度对数lgCBPA与响应信号ΔI之间存在良好的线性关系,其线性拟合方程为:ΔI=-(2.68±0.10)×lgCBPA+(9.72±0.15),相关系数r2=0.993,检出限 (S/N=3)为0.85 ng/mL。方法的检出限远低于国标饮用水标准对BPA限制的最高浓度(10 ng/mL)[23],说明该BPA免疫传感器可以满足国标的检测要求。
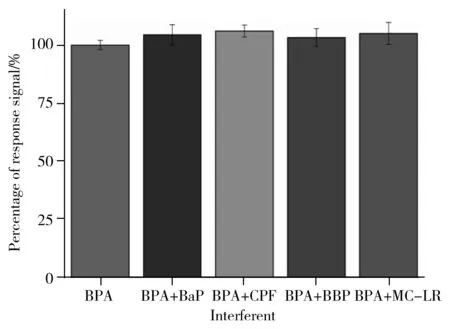
图6 BPA 免疫传感器的特异性实验Fig.6 Specificity of BPA immunosensor
2.6 免疫传感器的特异性
采用标准加入干扰小分子的方法对该免疫传感器的特异性进行验证。在1 ng/mL BPA标准样品中分别加入相同浓度的苯并芘(BaP)、毒死蜱(CPF)、3-溴联苯(BBP)和微囊藻毒素-LR(MC-LR),验证干扰小分子对响应信号的影响情况。结果显示,当受到这4种干扰物影响时,响应信号的偏差为3.3%~6.0%(如图6)。表明该免疫传感器对BPA具有良好的特异性。
2.7 免疫传感器的重现性与稳定性
免疫传感器的重现性通过批内实验和批间实验的相对标准偏差(RSD)来评估,批内差异是指同一样品浓度相同批次测试结果的RSD,而批间差异是指同一样品浓度不同批次测试结果的RSD。当BPA的检测浓度分别为0、1、10 ng/mL,其批内RSD分别为4.1%、3.4%、4.7%,批间RSD分别为3.2%、3.5%、4.5%。说明制备的BPA电化学免疫传感器的重现性良好。
将固定抗原的丝网印刷电极SPCEs/PLL/AuNPs/Antigen置于4 ℃冰箱,保存5 d后对浓度为1 ng/mL的BPA进行检测,响应电流值仅下降3.2%;保存10 d后继续检测,其响应电流值仅下降5.4%。表明该免疫传感器具有较好的稳定性,可用于实际样品中BPA的测定。
2.8 加标回收实验
本实验以河水作为样本,通过加标回收实验验证BPA免疫传感器在实际水样检测中的可行性。实验结果显示,实际水样中未检出BPA,对水样进行加标,当BPA的加标浓度分别为1、10、50 ng/mL时,其回收率分别为98.3%、104%、102%,表明BPA免疫传感器可用于环境水样中BPA的检测。
3 结 论
本文通过电聚合法在丝网印刷碳电极工作表面依次修饰PLL和纳米金颗粒,成功制备了BPA电化学免疫传感器。在最优条件下,所研制的免疫传感器对BPA的检测性能优异,如较宽的线性范围、较低的检出限以及较好的重现性、稳定性和特异性等,可用于BPA的低浓度检测。所研制的基于丝网印刷碳电极的电化学免疫传感器的操作过程简便快捷、成本低,在环境污染物的灵敏快速检测中具有广阔的应用前景。

