大豆苷元苯磺酸酯衍生物的细胞代谢研究
李雪芹,焦艳晓,李兴隆,彭 游
(九江学院 基础医学院 江西省生态化工工程技术研究中心,江西 九江 332005)
大豆异黄酮是大豆等多种植物中的一种重要代谢产物,因具有广泛的生理活性而备受关注。大豆异黄酮包括染料木素、大豆苷元(Daidzein,DD,4′,7-二羟基异黄酮)、黄豆黄素及其苷类[1],在结构上与17-雌二醇相似,能够通过与雌激素受体结合表现出雌激素行为。其中,DD作为大豆异黄酮中的主要活性成分,近年来成为科学家们研究的热点。DD具有抗炎,抗氧化,预防骨质疏松、癌症、心血管疾病以及抗动脉粥样硬化等多种生理活性[2-6]。但是,由于在4′-位和7-位两个羟基极性基团的作用下,DD易形成分子间氢键,从而导致水溶性差,生物利用度低,限制了其在临床的广泛应用。为了提高其生物利用度和活性,本课题组以DD为先导化合物,根据药动基团变换原理进行结构修饰,合成了3个大豆苷元苯磺酸酯类衍生物(D1~D3,图1),以期通过结构改造从根本上改善其药学性质,增强其抗动脉粥样硬化等方面的生物活性[7-9]。
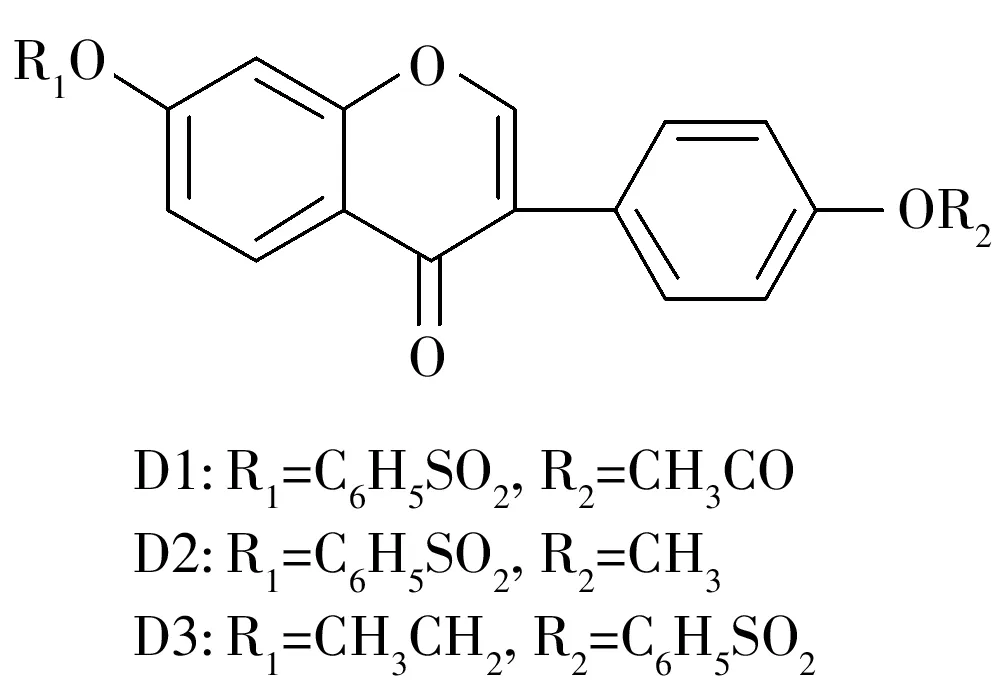
图1 大豆苷元衍生物的结构Fig.1 Structures of daidzein derivatives
体外代谢研究可在新药研发早期利用体外代谢参数合理预测候选化合物的体内药动学行为,指导后期药效、药动以及安全性评价的模型选择,具有广阔的应用前景[10-12]。利用细胞对药物进行体外代谢研究可以排除体内多种因素的干扰,为整体实验提供可靠的理论依据[10]。本课题组前期利用人主动脉血管平滑肌细胞(HAVSMCs)研究了大豆苷元衍生物D1~D3体外吸收与构性的关系,发现大豆苷元衍生物的细胞吸收均远高于先导物DD[13-14]。本文进一步采用高效液相色谱-三重四极杆质谱(HPLC-MS)研究大豆苷元衍生物在HAVSMCs中的代谢成分,推测其体外代谢路径,为衍生物体内吸收代谢提供理论基础。
1 实验部分
1.1 仪器与试剂
Agilent 6430 Triple Quadrupole LC-MS,TG18-WS型湘立台式高速离心机,Hair超低温冰箱,DN-24A型氮吹仪,美国ESCO CO2培养箱,日本Olympus倒置生物相差显微境。
大豆苷元苯磺酸酯衍生物D1~D3由本实验室合成[7-9];青霉素链霉素混合液购自北京索莱宝(Solarbio)科技有限公司,生物级二甲亚砜(DMSO)购自Sigma-Aldrich中国公司;南美胎牛血清购自依科赛(Excell bio)生物科技(太仓)有限公司,DMEM高糖培养基购自美国Hyclone公司。HAVSMCs购自北纳创联生物技术有限公司。其余试剂为化学纯或分析纯。
1.2 实验方法
1.2.1 细胞的培养与药物处理参照文献[13]、[14]所述方法,对冻存管的HAVSMCs进行复苏,取传代为3~10代的HAVSMCs以105密度接种于6孔板,每孔2 mL。置于37 ℃、5%CO2培养箱培养24 h,使细胞贴壁;更换无血清的DMEM培养液继续培养24 h,使细胞同步化。弃去上清液,分别加入含有不同药物浓度的10%血清DMEM培养液,空白细胞组则加入等量的不含药物的DMEM培养液。每组设3个复孔,继续培养。48 h后终止培养,分别收集细胞培养上清液,于-80 ℃冰箱冷冻保存。用PBS洗涤细胞3次,将6孔板置于-80 ℃冰箱冷冻保存。
1.2.2 HPLC-MS分析条件色谱条件:流动相为甲醇-乙酸(0.1%)溶液(1 ∶1,体积比),流速为0.5 mL/min,进样量为10 μL。检测波长λ=254 nm,柱温25 ℃。
质谱条件:采用三重四极杆串联精密质谱仪,配有电子电离源,负离子模式测定。全质谱数据在m/z50~1 000范围获得,最佳质谱参数如下:毛细管电压4.0 kV,进样锥电压35 V,去溶剂化气流(N2)速率900 L/h,进样锥气流(N2)速率50 L/h,去溶剂温度50 ℃,离子源温度150 ℃,诱导碰撞解离(CID)模式下的碰撞气体采用高纯氦气,进气压力设为40 psi(275 800 Pa),标准品的CID碰撞能为5~35 eV,裂解电压为135 V。
1.2.3 细胞上清液成分测定将药物作用的细胞上清液解冻,涡旋0.5 min,静置。取细胞上清液50 μL置于2 mL离心管中,再加入50 μL甲醇,涡旋1 min。加入100 μL 0.4%磷酸二氢铵、1 mL乙酸乙酯,涡旋3 min。以3 000 r/min离心10 min,吸取上清液950 μL,N2气吹干,加入500 μL甲醇,涡旋0.5 min。过0.45 μm有机膜后进行HPLC-MS分析。
1.2.4 细胞裂解液成分测定将用6孔板培养的细胞从-80 ℃冰箱中取出,常温解冻,每孔加入解冻好的细胞裂解液(给药细胞裂解后的溶液)1 mL,超声2 min,取0.5 mL置于2 mL离心管中,加入50 μL甲醇、100 μL 0.4%磷酸二氢铵、1 mL乙酸乙酯,涡旋3 min,以3 000 r/min离心10 min。吸取上清液950 μL,用N2吹干,加入500 μL甲醇,涡旋0.5 min。过0.45 μm有机膜后,进行HPLC-MS分析。
1.2.5 数据分析数据获取和加工的质谱软件包括Mass Hunter Acquisition B.03.01、Qualitative Analysis B.03.01。
2 结果与讨论
2.1 化合物D1的细胞代谢途径
化合物D1与细胞共孵48 h后的细胞裂解液经HPLC-MS分析后,通过软件Qualitative Analysis B.03.01提取特定分子色谱图解析,经与空白对照样品的质谱图数据比较,发现8个原药和代谢产物峰,并获得这些代谢物的相对分子质量,见表1。在化合物D1的细胞裂解液中发现8个离子峰([M-H]-):393.1、471.1、473.1、 429.3、 375.1、 253.4、434.8、294.9。化合物D1细胞裂解液的总离子色谱图与部分代谢物质谱图见图2,其上清液中代谢物成分与细胞裂解液一致。
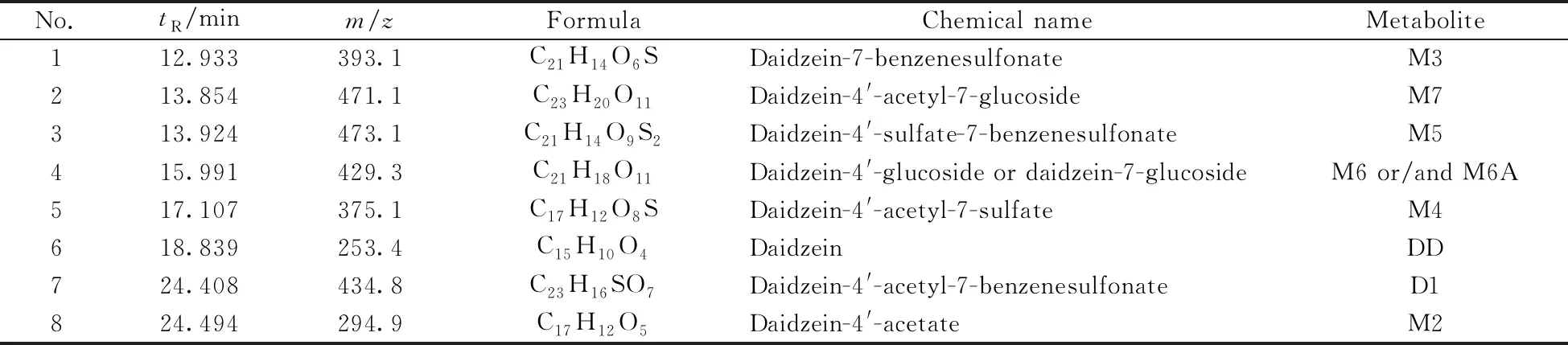
表1 D1体外代谢成分质谱数据Table 1 Mass spectrum data of D1 metabolites in vitro
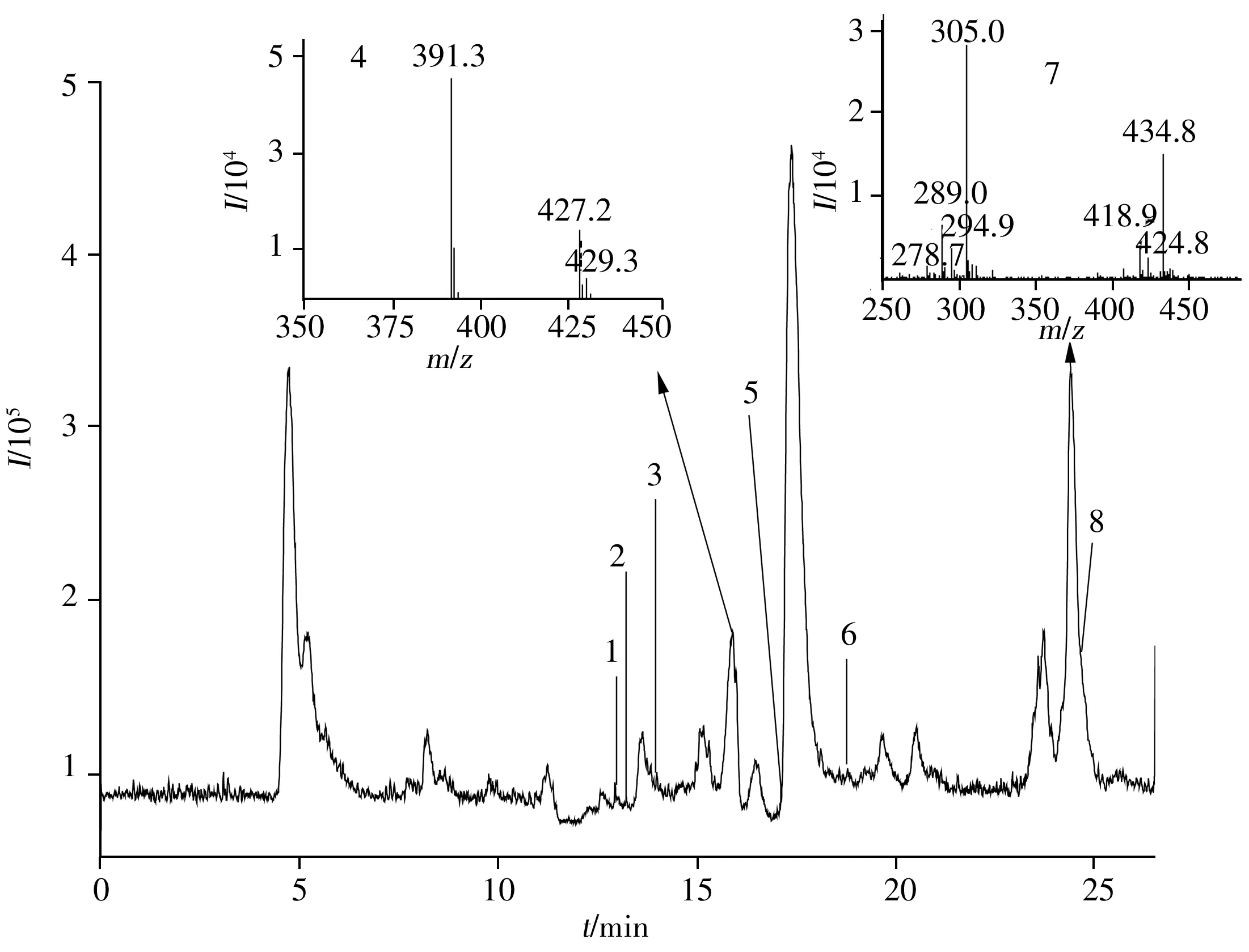
图2 化合物D1细胞裂解液的总离子色谱图及部分代谢物质谱图Fig.2 The total ion chromatogram of cell lysate spiked with D1 and mass spectrogram of partial metabolites the numbers were the same as those in Table 1
由细胞裂解液的液相色谱-质谱检测结果发现,化合物D1的细胞代谢途径可能为化合物进入细胞后,水解脱去乙酰基,生成代谢产物M3。或者先脱去苯磺酰基生成化合物M2,化合物M2在二磷酸尿苷(UDP)-葡萄糖醛酸转移酶的作用下与细胞内的葡萄糖醛酸结合生成葡萄糖醛酸苷M7。代谢物M2、M3在磺基转移酶作用下,分别发生硫酸化反应生成代谢产物M4、M5。同时,化合物M2和M3 都可以进一步水解生成大豆苷元DD,DD在UDP-葡萄糖醛酸转移酶的作用下与细胞内葡萄糖醛酸苷结合,生成葡萄糖醛酸苷产物M6或M6A。化合物D1的细胞代谢途径见图3。
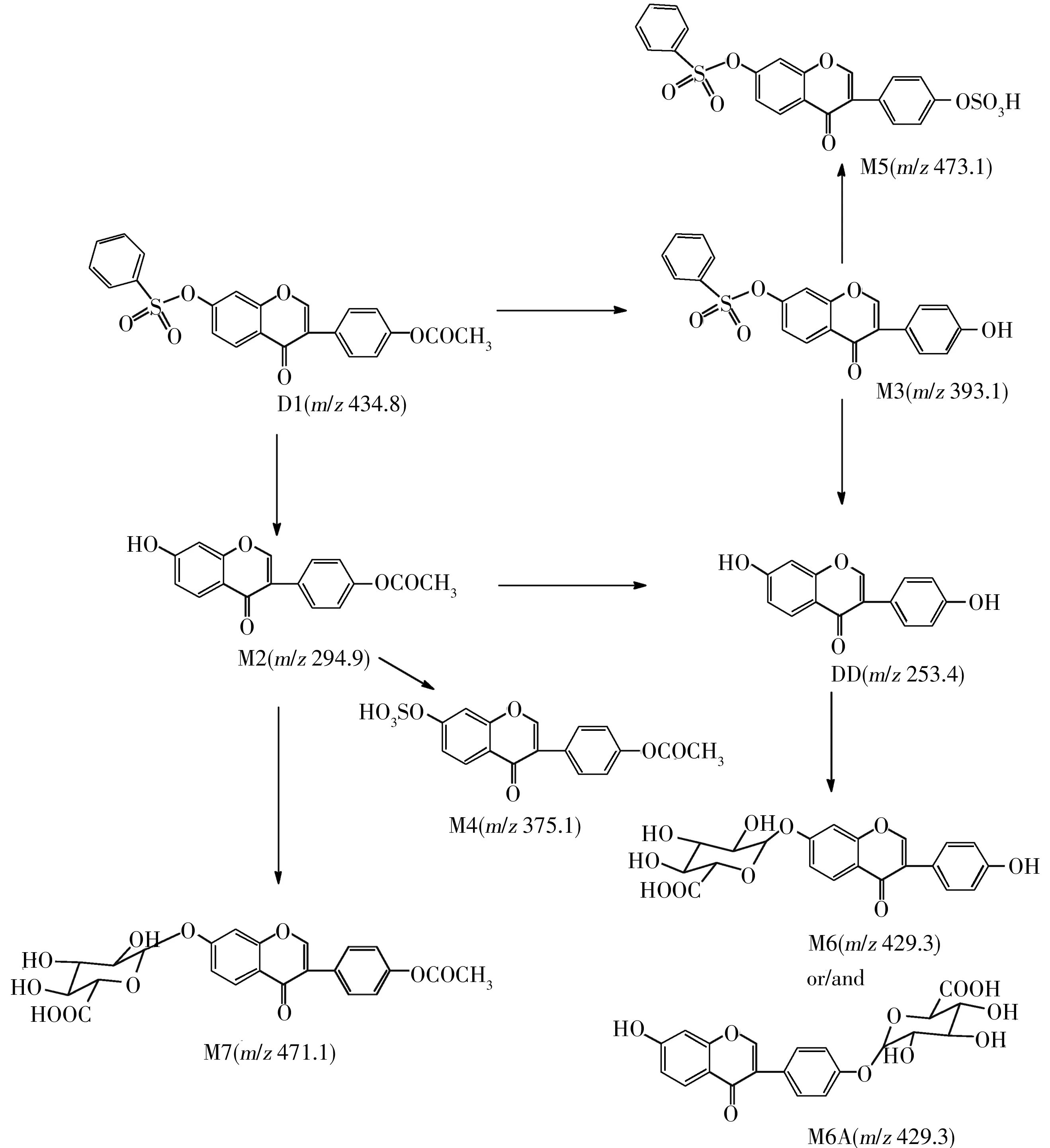
图3 D1的HAVSMCs体外代谢途径Fig.3 The metabolism pathway of D1 in HAVSMCs
2.2 化合物D2的细胞代谢途径
化合物D2与细胞共孵48 h后的细胞裂解液经HPLC-MS分析,通过软件Qualitative Analysis B.03.01提取特定分子色谱图解析,并与空白对照样品的质谱图数据比较,发现4个代谢产物峰,并获得了这些代谢产物的相对分子质量,见表2。在化合物D2的细胞裂解液中发现代谢物分子离子峰([M-H]-):429.3、253.2、443.2、266.9。化合物D2细胞裂解液的总离子色谱图和部分代谢产物质谱图见图4。化合物D2细胞上清液中的代谢物成分与细胞裂解液一致。
表2 D2体外代谢成分质谱数据Table 2 Mass spectrum data of D2 metabolites in vitro
由D2体系细胞裂解液的液相色谱-质谱检测结果发现:化合物D2的细胞代谢途径可能为化合物进入细胞后,在水解酶的作用下,水解脱去苯磺酰基生成化合物M8。化合物M8进一步水解生成大豆苷元DD,DD和M8分别与细胞内葡萄糖醛酸苷结合,并分别生成葡萄糖醛酸苷M6(M6A)和M9。在体系中未发现D2先进行甲基醚水解的化合物,表明在细胞内水解酶的作用下苯磺酸酯键比甲基醚键更易发生水解。化合物D2的细胞代谢途径见图5。
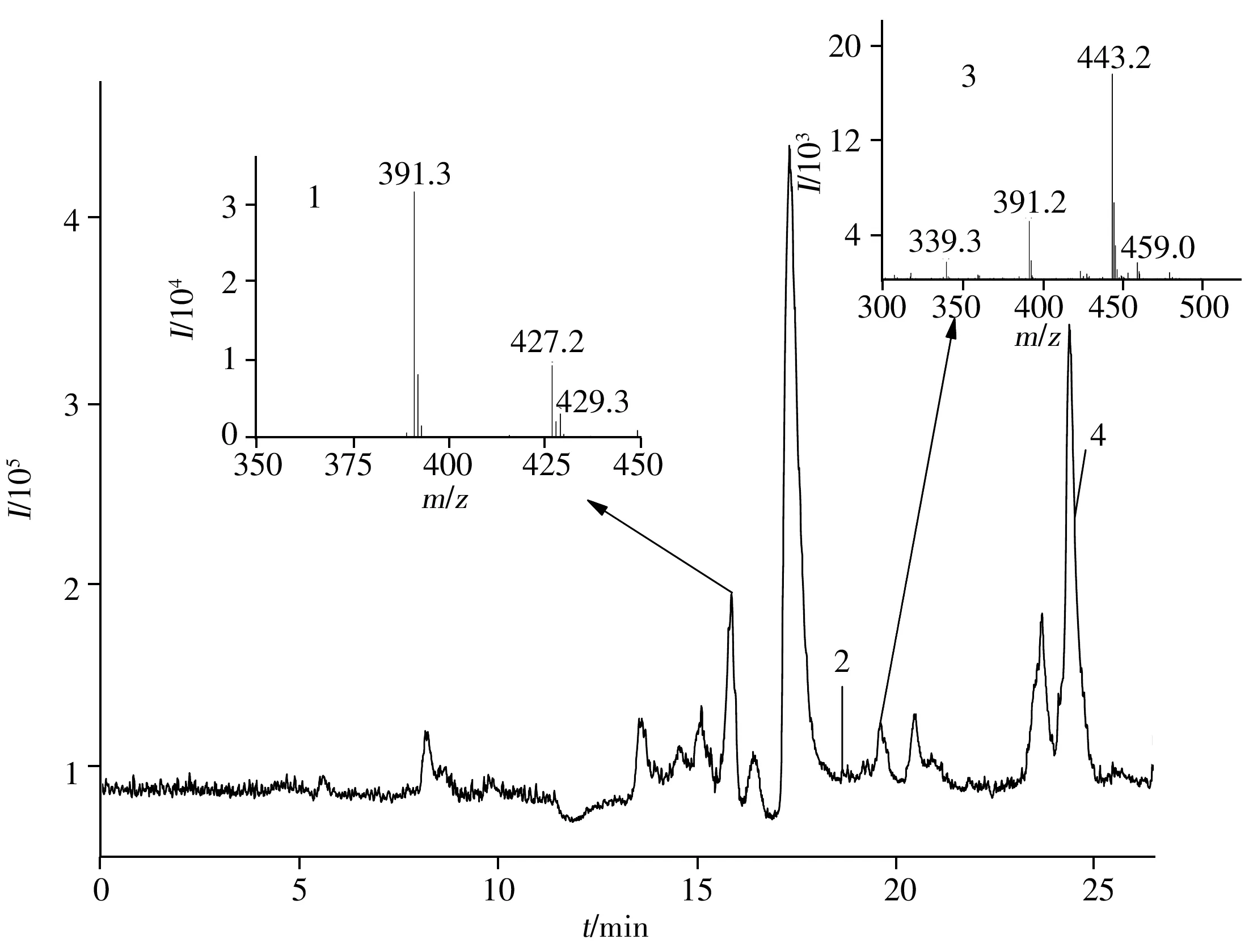
图4 D2细胞裂解液的总离子色谱图和部分代谢产物质谱图Fig.4 The total ion chromatogram of cell lysate spiked with D2 and mass spectrogram of partial metabolites the numbers were the same as those in Table 2
2.3 化合物D3的细胞代谢途径
化合物D3与细胞共孵48 h后的细胞裂解液经HPLC-MS分析,通过软件Qualitative Analysis B.03.01提取特定分子色谱图解析,并与空白对照样品的质谱图数据比较,发现6个代谢产物峰,并获得了这些代谢物的相对分子质量,见表3。在化合物D3的细胞裂解液中发现离子峰([M-H]-):361.2、473.0、457.2、429.3、253.2、281.3。化合物D3细胞裂解液的总离子色谱图与部分代谢产物质谱图见图6。化合物D3上清液中的代谢物成分与细胞裂解液一致。

表3 D3体外代谢成分质谱数据Table 3 Mass spectrum data of D3 metabolites in vitro

(续表3)
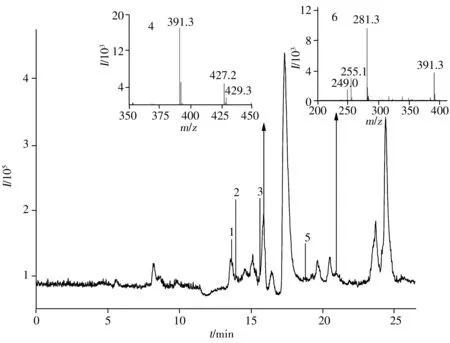
图6 化合物D3细胞裂解液的总离子色谱图和部分代谢成分质谱图Fig.6 The total ion chromatogram of cell lysate spiked with D3 and mass spectrogram of partial metabolites the numbers were the same as those in Table 3
根据细胞裂解液的液相色谱-质谱检测结果发现:化合物D3的细胞代谢途径可能有2条。一条代谢途径为化合物进入细胞后,水解脱去苯磺酰基生成化合物M11,化合物M11分别发生硫酸化反应和葡萄糖醛酸结合反应代谢成M13和M14。另一条代谢途径为D3水解脱去乙基生成化合物M10,M10在UDP-葡萄糖醛酸转移酶作用下代谢成M12。而经M10和 M11路径均可进一步水解生成大豆苷元DD,DD与细胞内葡萄糖醛酸苷结合,生成葡萄糖醛酸苷M6或M6A。化合物D3的细胞代谢途径见图7。
体外细胞培养体系成分相对简单,物质明确,易于代谢途径推断和代谢物质富集、分离、纯化,有利于代谢物的进一步研究。本实验对大豆苷元衍生物的HAVSMCs药物代谢成分进行初步分析,发现在HAVSMCs内,氧化还原酶活性不强,未发现D1~D3的氧化还原产物。但如表1~3,图3、图5、图7所示,在各种细胞内水解酶(比如脂肪酶)的作用下,D1~D3均发生了磺酸酯(乙酸酯)的水解和甲基(乙基)醚的水解生成相应产物,最后水解均生成DD,表明体系中水解酶的活性较强,DD在UDP-葡萄糖醛酸转移酶的作用下,羟基发生葡萄糖醛酸结合反应,生成大豆苷元单葡萄糖醛酸苷M6和/或M6A(m/z429.3)。但是并未发现大豆苷元的硫酸化产物,表明细胞中UDP-葡萄糖醛酸转移酶的活性较强。由于葡萄糖醛酸结合反应和硫酸化反应为竞争性反应,在底物浓度较高时,一般会发生葡萄糖醛酸结合反应[15]。而DD的两个羟基并没有全部葡萄糖醛酸苷化,可能是空间位阻的作用。根据图3和图7发现,代谢产物M2、M11存在—OH,既能在UDP-葡萄糖醛酸转移酶作用下发生葡萄糖醛酸结合反应生成M7(m/z471.1)和M14(m/z457.2),又可在磺基转移酶的作用下发生硫酸化反应分别生成代谢产物M4(m/z375.1)和M13(m/z361.2),表明体系中磺基转移酶也具有一定活性。当体系中底物浓度适中时,可以同时发生葡萄糖醛酸结合反应和硫酸化反应。
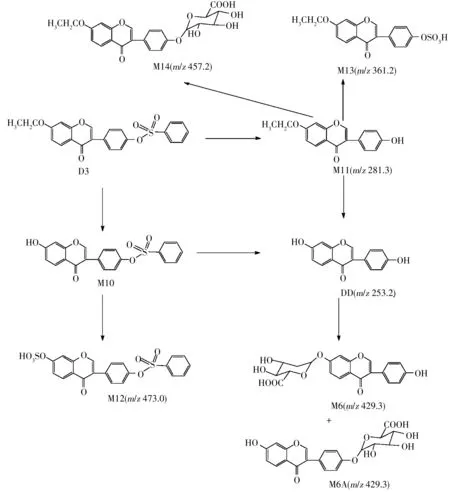
图7 D3的HAVSMCs体外代谢途径Fig.7 The metabolism pathway of D3 in HAVSMCs
3 结 论
本文对大豆苷元苯磺酸酯衍生物D1~D3的体外细胞代谢产物进行了初步研究。结果显示,D1~D3在细胞内的代谢路径和代谢产物由其结构特征所决定。大豆苷元苯磺酸酯衍生物的细胞代谢主要表现在水解、葡萄糖醛酸苷化和硫酸化。化合物D2水解成DD只有一种可能的代谢路径,代谢产物相对比较简单,而其他两种化合物D1、D3则可能经历两种不同的代谢路径生成先导物DD,代谢产物相对复杂且种类较多。实验结果也表明,D1~D3均经历了完全水解为DD,进而与细胞内葡萄糖醛酸苷结合生成葡萄糖醛酸苷产物的过程。

