基于多肽标记物分析的肉制品掺伪定量检测技术
胡文彦,徐道坤,刘 真,杨 军,李春保,冯超彦
(1.南京市食品药品监督检验院,江苏 南京 211198;2.南京农业大学 食品科学与技术学院,江苏 南京 210095)
肉类掺假是一个老生常谈的话题,自古以来就有“挂羊头,卖狗肉”的说法。目前已报道的掺伪方法包含低价肉冒充高价肉、用淀粉或其他材料添加香精后冒充食用肉以及非食用肉冒充食用肉等,这些采用常规的感官方法无法鉴别,严重扰乱了市场秩序,给广大群众身心健康和经济利益造成了重大的损失。
20世纪80年代以来,人们开始研制并建立基于蛋白组学与基因组学的物种鉴别方法,其中包括电泳技术、酶联免疫技术(ELISA)及聚合酶链反应(PCR)等[1-2]。然而,这些方法用于复杂深加工肉制品掺伪的批量检验则显得力不从心。ELISA虽然很灵敏,但由于食品加工过程引起的抗原决定簇的易感性和物种间的交叉酶联反应,导致该方法应用在肉源性鉴别中易产生假阳性。食品加工过程、特别是超过100 ℃的加热过程会导致DNA的降解反应,进而产生非特异性的片段[3]。基于DNA分析的PCR方法不仅耗时长,且存在被其他生物组织DNA污染的风险,同时复杂基质中的DNA提取也存在挑战。与此相比,蛋白质在加热过程中比DNA稳定性更好,它们的一级结构经热处理后相对稳定,从而使蛋白质相关的肉源性鉴别成为可能。
现有的研究报道多针对生肉,对熟肉及其加工品的稳定特征多肽研究较少。本文将胰蛋白酶消化后的蛋白质溶液加载到线性离子阱-静电场轨道阱质谱(LTQ-Orbitrap),并根据UniProt数据库和Proteome Discover 1.4软件搜索原始数据,借助高分辨质谱(HRMS)和生物信息学工具从国内消费量最大的5种肉类(牛、鸡、鸭、猪和羊肉)中分别筛选出特异性多肽标记物,采用模拟加工样品和串联四极杆质谱进一步确认了14种热稳定性高、响应好的多肽标记物。这些多肽标记物在生肉和熟肉中同时存在,其中有12种未见报道。利用高效液相色谱-串联四极杆质谱(HPLC-QQQ-MS)开发了一种无标记的定量方法,高效液相色谱分离后使用多肽标记物碎片离子的信号强度建立标准曲线。与现有的研究成果[4-5]相比,本方法无需合成多肽标准品,节约了检测成本,且前处理相对简单,检测可在2 d内完成,适用于批量测试,具有较高的实用价值。经验证,此方法可作为鉴别肉类加工品真伪、评价掺伪程度的有效工具。
1 实验部分
1.1 仪器、试剂与样品
Nano二维液相色谱LTQ-Orbitrap质谱仪(美国Thermo Fisher公司);Agilent 1290 UPLC-6495QQQ型超高效液相色谱-串联质谱仪,配有电喷雾离子源(美国Agilent公司);XS205型电子天平(瑞士Mettler-Toledo公司);0.22 μm微孔滤膜(上海安谱实验科技有限公司);样品粉碎仪(北京格瑞德曼公司);均质器(德国IKA公司);冷冻离心机(美国Beckman公司)。
甲醇、乙腈(色谱纯,美国Honeywell公司);甲酸(色谱纯,美国ACS公司);二硫苏糖醇(DTT)、胰蛋白酶(德国Sigma-Aldrich公司);尿素、硫脲、3-[(3-胆酰胺丙基)二甲基铵]-1-丙烷磺酸盐(CHAPS)、碘乙酰胺(IAA)和碳酸氢铵(NH4HCO3)(上海阿拉丁生化科技股份有限公司);C18固相萃取小柱(美国Waters Sep-Pak,500 mg/6 mL);BCA试剂盒(Thermo Scientific公司);实验用水为经Milli-Q净化系统(0.22 μm过滤膜 )过滤的超纯水。
从菜场、超市随机购买5种肉类(牛肉、鸡肉、鸭肉、猪肉和羊肉)样品,含牛肉卷、羊肉卷、肉丸等,采用NY/T 3309-2018[6]进行源性成分的确认。确认后的样品去除脂肪,用样品粉碎仪处理后在-20 ℃下保存备用。通过均质器将一种肉与另一种肉分别按质量分数为0、20%、40%、60%、80%和100%混合制备肉类混合物。在热稳定性实验中,分别将10 g肉在沸水中煮15 min以模拟水煮过程;在烤箱中230 ℃烤制5 min以模拟烘烤过程;在锅中用花生油炸3 min以模拟油炸过程,然后进行均质,每种样品平行制作6份。
1.2 蛋白质提取
分别称取上述制备后的样品约1 g,加入5 mL含有2 mol/L硫脲、7 mol/L尿素和4%CHAPS的蛋白质提取溶液,在冰浴条件下均质5 min,保持4 ℃,12 000 g条件下离心15 min,收集上清液。使用BCA试剂盒,根据Bradford蛋白质测定法,以牛血清白蛋白(BSA)为标准,测量蛋白质浓度。
1.3 胰蛋白酶消化
参照测得的蛋白质浓度,取约100 μg当量的蛋白质提取溶液,用50 μL含有100 mmol/L DTT和100 mmol/L NH4HCO3的混合溶液在60 ℃下还原30 min,然后将混合物冷却至室温。在暗处用50 μL含55 mmol/L IAA和100 mmol/L NH4HCO3的混合溶液烷基化20 min。将胰蛋白酶(0.1 mg/mL,溶于25 mmol/L NH4HCO3溶液中)以1 μg胰蛋白酶∶100 μg蛋白质的比例添加到溶液中,混匀后将混合物在37 ℃下孵育过夜。将酶解消化后的溶液通过C18固相萃取柱脱盐,洗脱液经氮气干燥,复溶于含有3%乙腈和1%甲酸的1 mL水中,然后进行质谱分析。
1.4 特征多肽标记物筛选
通过与Nano二维液相色谱结合的LTQ-Orbitrap质谱仪分离得到各种肉类的特征多肽标记物,将采集的数据通过生物信息学软件分析获得每种肉类的肽段信息,再经NCBI蛋白质数据库进行确认,在鸡、鸭、牛、猪、羊肉中分别鉴定出92、142、207、184和126个特异性肽段,选择每种肉类相对响应值最好的20个肽段进行下一步的适用性分析。
1.5 HPLC-QQQ-MS分析
1.5.1 色谱条件色谱柱为安捷伦Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm),柱温为35 ℃,进样量为20 μL,流动相A为0.1%甲酸水溶液,B为乙腈(含0.1%甲酸),流速为0.3 mL/min。梯度洗脱程序为:0~15 min,90%~60%A;15.1~18 min,60%~0%A;18.1~20 min,0%~90%A。单针总运行时间为20 min。
1.5.2 质谱条件离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测(MRM);毛细管电压:3 500 V;干燥气温度:200 ℃;干燥气流速:16 L/min;雾化气压力:172.4 kPa(25 psi);鞘气温度:350 ℃;鞘气流速:11 L/min;碎裂电压:380 V;高压离子漏斗电压:150 V;低压离子漏斗电压:60 V。使用安捷伦Skyline软件包预测所有肽生物标记物的MS分析参数。
2 结果与讨论
2.1 多肽标记物的提取
蛋白质在加工过程中会产生降解,且水溶性差,提取难度较大,一般选择混合比例的缓冲盐溶液进行提取。高浓度的尿素与硫脲的混合溶液可有效提高深加工肉制品中蛋白质的提取效率[7],结合已有方法[8],本实验选择硫脲、尿素和CHAPS为混合提取溶剂。蛋白质分析时,酶的选择也很重要,为保证检测结果的稳定性,应确保所选目标多肽在酶切时无漏切位点。胰蛋白酶通过在赖氨酸和精氨酸残基的C—末端来切割肽,这两种氨基酸也是美拉德反应和蛋白质交联的主要参与者[9],因此胰蛋白酶是获得肉蛋白特征多肽的首选酶。考虑到常规超滤法去盐成本较高,尝试使用反相硅胶C18固相萃取柱净化的方式去除多余的盐,不仅节约成本,还可避免未参与反应的盐对质谱分析造成影响。需要说明的是,采用试剂盒法测量蛋白质仅需在测定同一类产品的首次进行,因同类别样品的蛋白质含量基本在同一水平,在同类型产品的批量测试中均可采用首次测试的预估量进行实验,这可在一定程度上增加本方法的适用性。
2.2 多肽标记物的适用性验证
蛋白质经胰蛋白酶水解后会产生很多肽段,但并非每条肽段均适用于MRM检测。通常在肽段选择时,肽段长度应控制在 8~25个氨基酸,同时避免肽段修饰。除了这些理论判据,还应考虑肽段是否容易离子化及碎裂后碎片离子的质谱响应信号可否满足分析要求[10]。此外,尽管牛、鸡、鸭、猪、羊物种不同,但所有物种可能存在同源蛋白,特定的氨基酸序列可在肌肉组织的各种蛋白质中找到,加上NCBI数据库中某些物种(如鸭和羊)的蛋白质组数据库并不完整,导致通过计算机拟合筛选的特异性肽段在实际样品特别是深加工肉制品中可能不存在,因此非常有必要对上述特征多肽开展适用性验证。
大多数肉类加工方法包含热处理,不可避免地导致蛋白质变性和降解,这在以往研究中得以证实[11]。基于此,本实验优先考察各种加热处理对所选多肽标记物的影响。HPLC-QQQ-MS的MRM模式具有高灵敏度和稳定性,常用于化合物的准确定性与定量,已被用于肽段的分析[12]。首先借助Skyline软件预测这些多肽的碎片离子与裂解能量,优化液相色谱分离方法,通过高效液相色谱串联质谱仪进行分析,对其离子化效率和色谱行为进行评估。按照本文的前处理步骤制作了1批模拟加工肉制品,提取多肽后进行质谱分析。每种肉类选择1种典型的多肽标记物进行分析,生肉、水煮、烘烤和油炸处理后的色谱图如图1所示。结果发现在各种加热处理下,指定标记物的信号只有鸡、猪和羊肉在油炸时有所降低,特征离子响应始终很强烈,无杂峰干扰,容易与其他峰加以区分。通过多次反复实验确认其专属性及热稳定性,将重复分析中不能重现或强度较弱的峰信号剔除。最终筛选出具有相对高响应的14种特异性多肽标记物(见表1),其中每种肉类至少有2种不同的代表性肽段,可用于相互佐证。除了猪的DQGSYEDFVEGLR及牛的FLEELLTTQC已有文献报道外[13],其余12种肽段均为新的多肽标记物。这些多肽标记物是在生肉和熟肉中共有的稳定物质,可用于肉源性的定性鉴别与定量测试。

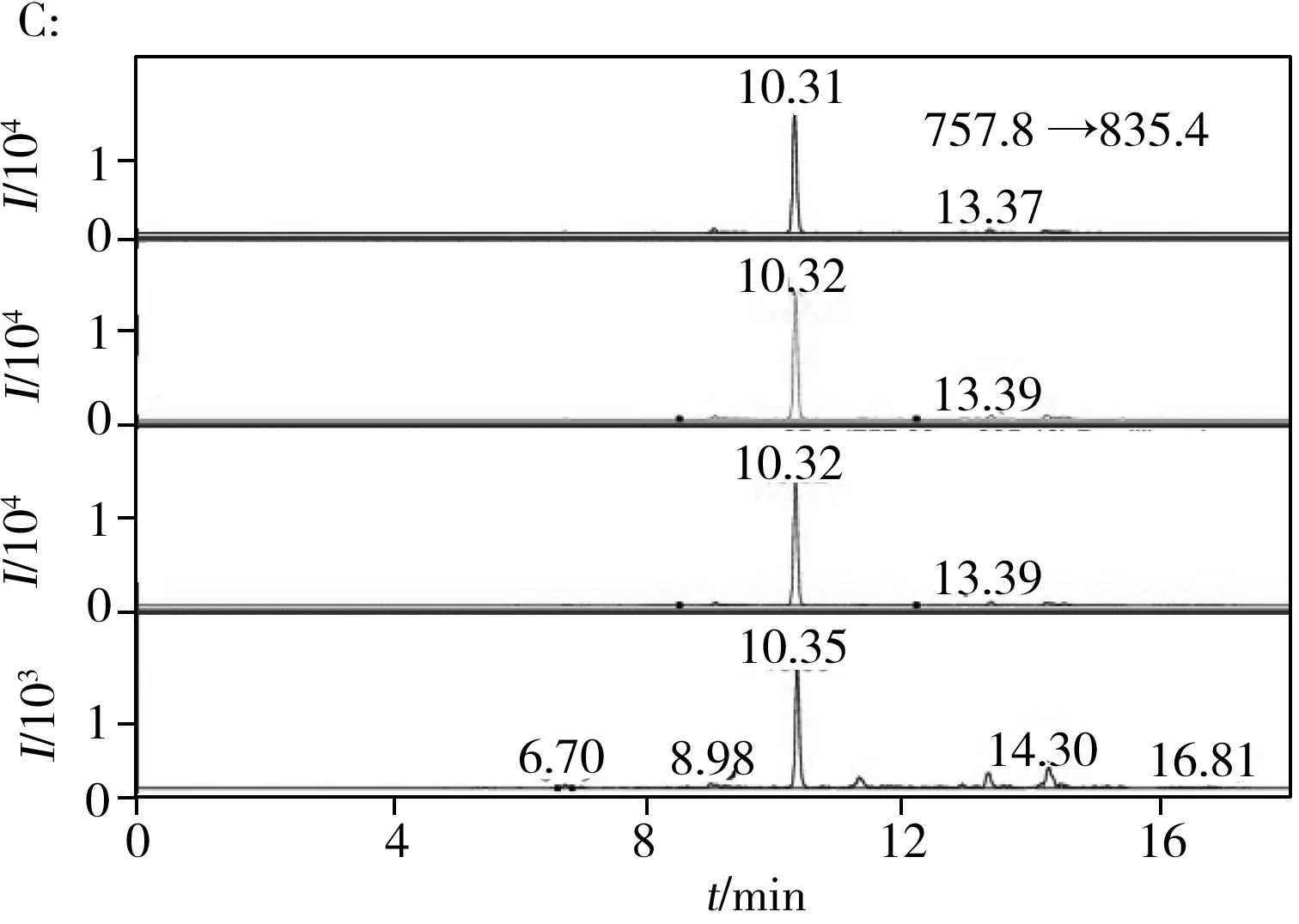
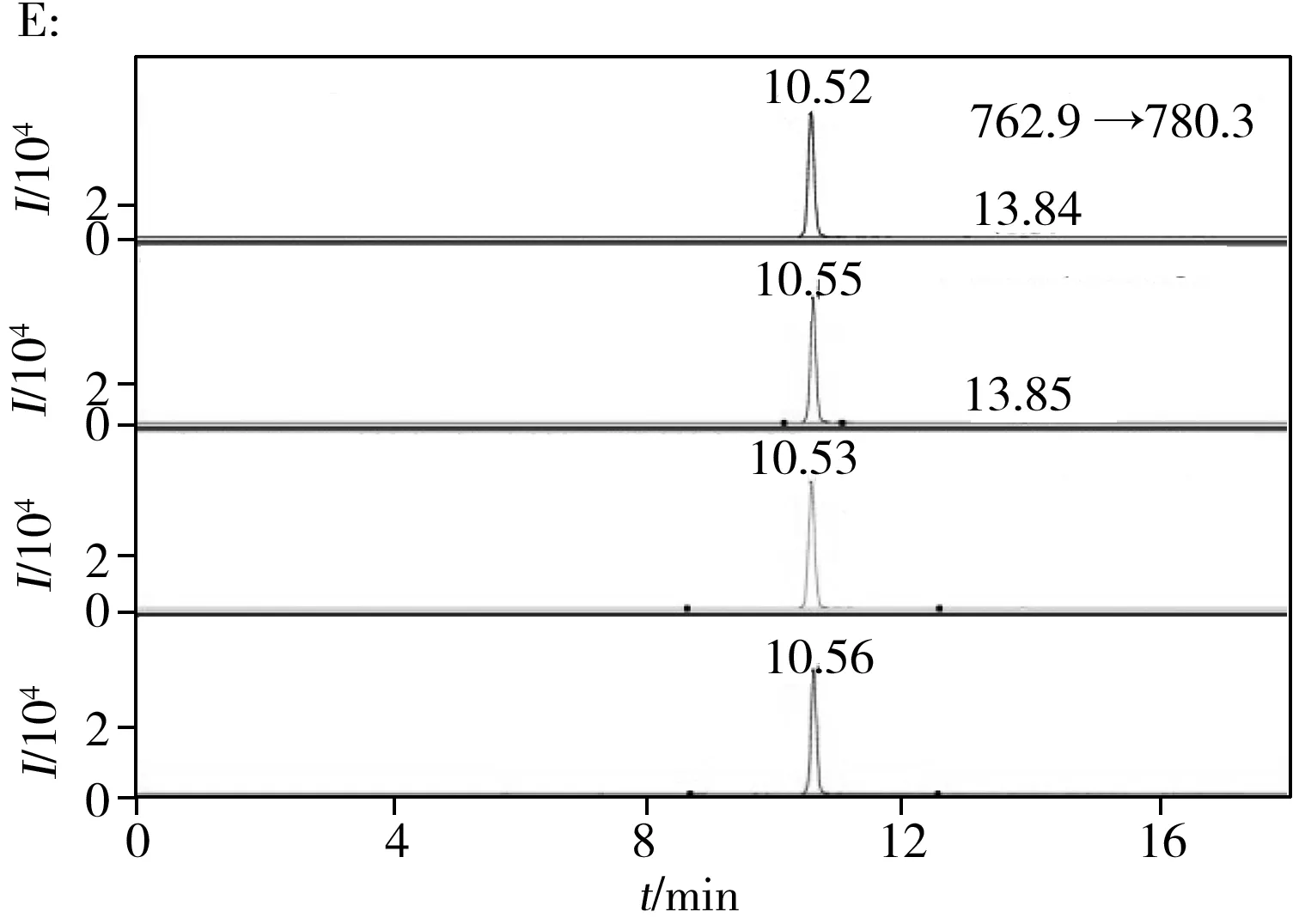
图1 不同前处理下5种肉类多肽标记物的色谱图Fig.1 Chromatograms of five meat peptide markers with different pretreatments A:chicken,B:duck,C:pork,D:sheep,E:beef;from top to bottom:raw meat,boiled,roasted and fried
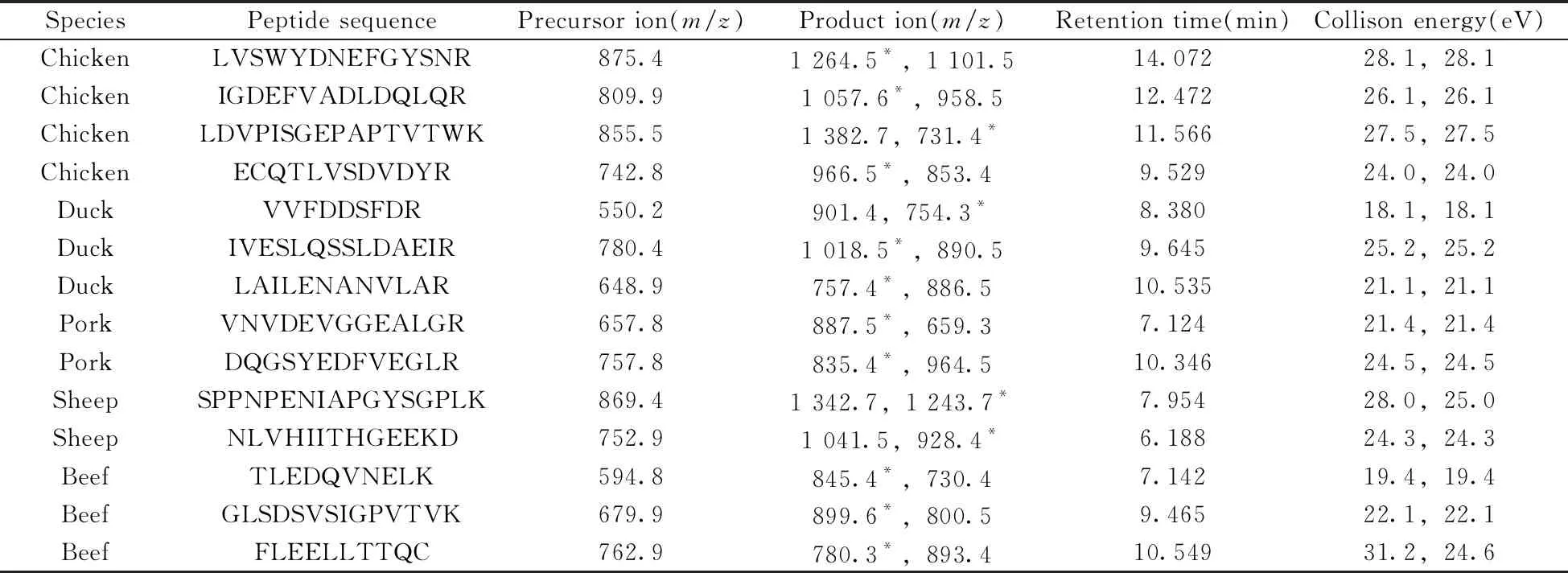
SpeciesPeptide sequencePrecursor ion(m/z)Product ion(m/z)Retention time(min)Collison energy(eV)ChickenLVSWYDNEFGYSNR875.41 264.5*,1 101.514.07228.1,28.1ChickenIGDEFVADLDQLQR809.91 057.6*,958.512.47226.1,26.1ChickenLDVPISGEPAPTVTWK855.51 382.7,731.4*11.56627.5,27.5ChickenECQTLVSDVDYR742.8966.5*,853.49.52924.0,24.0DuckVVFDDSFDR550.2901.4,754.3*8.38018.1,18.1DuckIVESLQSSLDAEIR780.41 018.5*,890.59.64525.2,25.2DuckLAILENANVLAR648.9757.4*,886.510.53521.1,21.1PorkVNVDEVGGEALGR657.8887.5*,659.37.12421.4,21.4PorkDQGSYEDFVEGLR757.8835.4*,964.510.34624.5,24.5SheepSPPNPENIAPGYSGPLK869.41 342.7,1 243.7*7.95428.0,25.0SheepNLVHIITHGEEKD752.91 041.5,928.4*6.18824.3,24.3BeefTLEDQVNELK594.8845.4*,730.47.14219.4,19.4BeefGLSDSVSIGPVTVK679.9899.6*,800.59.46522.1,22.1BeefFLEELLTTQC762.9780.3*,893.410.54931.2,24.6
*quantitative ion
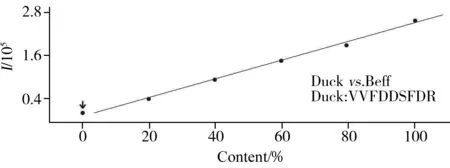
图2 牛肉中添加鸭肉的校正曲线Fig.2 Calibration curve of duck added to beef matrix
2.3 定量方法
市售的肉糜类产品是非常容易掺假的品种,例如商贩在牛肉丸中掺入少量的鸡肉或鸭肉,经过香料增味,消费者在口感上很难分辨。因此建立一种定量评估肉类掺假程度的方法对于市场监管具有重要的现实意义。在蛋白组学研究中,肽段定量的常规方法是使用同位素标记的合成肽段进行基于质谱(MS)的绝对定量(AQUA)[14-15],但该法成本高和费时,本文尝试开发一种适用于肉类掺假的更为简便和实用的无标记蛋白质定量方法。将两种指定的肉类分别按0%、20%、40%、60%、80%、100%(质量分数)比例混合,经过蛋白质提取和胰蛋白酶消化后,用HPLC-QQQ-MS分析获得响应强度。以峰面积为纵坐标(y),混合肉类的比例为横坐标(x)拟合得到校准曲线。图2展示了鸭肉与牛肉按相应比例混匀后,鸭肉目标肽段VVFDDSFDR的校正曲线,线性方程为y=2 516.583 0x-26 250.514 4,相关系数r2=0.99,展示了良好的线性关系。更多常见掺假混合肉的校正曲线见表2,结果可见各种肉类两两混合后的相关系数(r2)均不低于0.95,可用于肉类掺假的定量测试。
2.4 灵敏度与回收率
在色谱分析中,一般采用计算各目标物在空白基质中信噪比(S/N)为3时对应的浓度获得检出限(LOD),10倍信噪比对应的浓度获得定量下限(LOQ)。参考现有的PCR标准方法[6]和文献[16]中规定的最低检测含量,选择几种代表性的掺假情形两两配对,按1%的检出量(如将1 g鸭肉与99 g牛肉混合),提取多肽标记物后进行分析,计算目标多肽标记物在另一种基质肉中的信噪比。结果发现在1%的添加水平下,所有目标肽段的信噪比均超过100。在现实中添加低于1%的廉价肉不能带来经济效益,制定过低的检出限缺乏实际意义,因此本方法最终选择1%作为测定低限,可保证方法灵敏度不低于现有的PCR标准方法,有效打击欺诈行为。
在一种纯肉样品中分别添加1%、5%和10%质量分数的目标肉,混匀后按照本方法平行测定6次,计算回收率和相对标准偏差(RSD),结果见表2。结果显示,选定的几种典型混合肉在3个加标水平下回收率为87.6%~105%,RSD均小于15%,可满足日常批量定量检测要求。
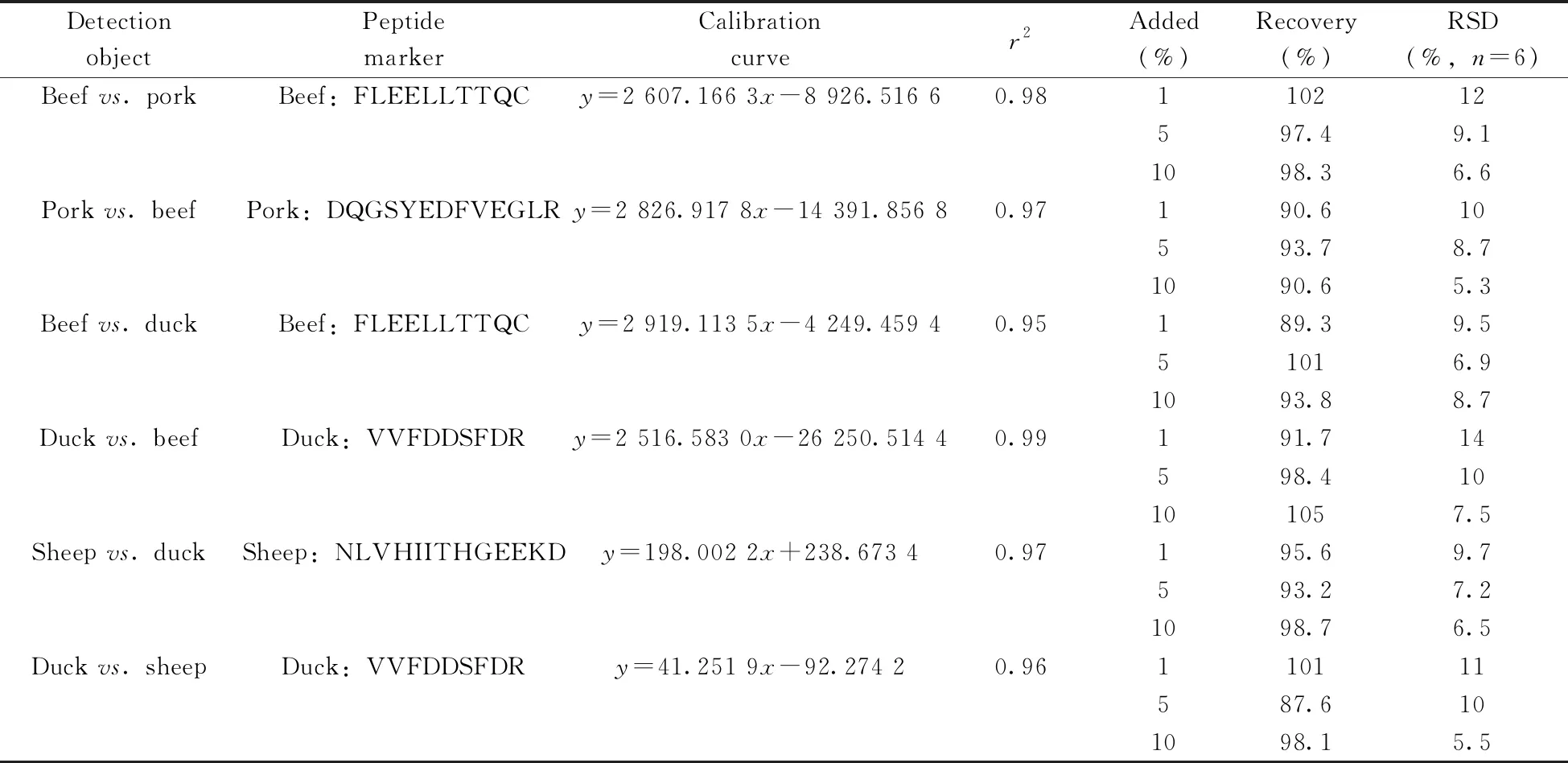
表2 几种典型混合肉的方法学考察结果Table 2 Investigation results of several typical mixed meat
2.5 实际样品测试
为验证方法的应用性,从本地超市及农贸市场购买36批典型的肉类产品,分别为14批牛肉卷、12批羊肉卷及10批标示为牛肉丸的各种火锅产品,重点检查用猪肉、鸡肉或鸭肉冒充的情况。样品经过预处理后,用HPLC-QQQ-MS检测5种肉类的典型多肽标记物。结果显示,1批羊肉卷中未检出羊的多肽标记物,检出鸭的特征信号,这批产品可能是用鸭肉冒充羊肉;1批牛肉丸中检出明显的鸡的肽段信号,经过定量分析,鸡肉含量约占总重量的42%;另有1批牛肉丸中鸡、鸭、牛、猪、羊5种肉类的信号均未检测到,可能为其他不明肉类。以上结果均通过PCR标准方法进行确认,定性结果与本方法完全一致。
3 结 论
本文通过高分辨质谱和数据信息化手段鉴定出鸡、鸭、牛、猪、羊5种肉类的14种热稳定多肽标记物,并建立了一种基于物种特异性多肽标记物的无标记定量方法。该方法可对生肉及加工肉制品的源性进行鉴别和相对含量检测,测定低限低至1%,检测可在2 d内完成,具有良好的稳定性和应用价值。后续将开发其他食用肉类物种的特征性多肽标记物,如鹅、狗、狐狸、貂等,进一步拓展方法的应用范围,为打击肉类产品掺假、维护市场公平竞争提供技术支撑。

