一种基于苯并噻唑的新型过氧亚硝酸盐荧光探针的合成及应用
张春香,王慧平,刘梦琴,申有名,谷 标*
(1.湖南文理学院 化学与材料工程学院,湖南 常德 415000;2.衡阳师范学院 化学与材料科学学院, 功能金属有机化合物湖南省高校重点实验室,湖南 衡阳 421008)
过氧亚硝酸盐(ONOO-)是生命体中一种典型的活性氮物质(RNS),内源性ONOO-由一氧化氮和超氧自由基在体内偶联反应生成[1]。ONOO-在信号传导中扮演着十分重要的角色,并表现消炎和杀菌作用。研究表明,体内异常浓度的ONOO-与各种临床疾病有关,如炎症、心血管疾病、阿尔茨海默病和癌症[2]。另外,由于具有强的氧化性,ONOO-会引起生物分子(包括细胞、蛋白质、脂类和核酸)受损,导致细胞凋亡或坏死[3]。因此,开发高效的生物系统中ONOO-的检测方法对于更好地了解其生理及病理学功能具有重要意义。
在众多方法中,荧光探针因具有灵敏度高、特异性强、无损检测和实时监测等优点,被认为是一种很有前途的活体检测方法[4]。迄今为止,已报道了许多以硼酸酯[5-6]、硒或碲[7-8]、肼[9]、N-(4-羟基苯基)氨基[10-11]、二苯基膦[12-13]、碳氮双键[14]作为ONOO-识别基团的荧光探针。虽然目前已在ONOO-检测与成像方面取得了一些进展,但仍存在一些值得关注的问题。其一,体内ONOO-生命周期短(<10 ms)[15],设计的探针应能在温和的条件下快速响应ONOO-。然而,大多数ONOO-探针在检测时表现出延迟响应(≥5 min)[16-18],难以捕获瞬态的ONOO-,不利于生物系统中ONOO-的实时、原位检测。其二,细胞内ONOO-的稳态浓度估计在nmol范围内,而化学活性相近的其他活性氧物种(ROS,如ClO-和H2O2)的稳态浓度在μmol范围内,构建的探针应对ONOO-具有足够高的选择性和灵敏性。遗憾地是,已报道的一些ONOO-探针表现出对其它RNS/ROS的选择性不足[19],极大地限制了其实际应用[20]。另外,一些探针合成复杂、纯化困难、成本高昂,不利于推广使用。因此,开发一种能解决上述问题的ONOO-荧光探针尤为必要。
2-(2′-羟基苯基)苯并噻唑及衍生物(HBT)作为荧光信号基团具有许多显著的光物理和化学性质,如Stokes位移大、荧光量子产率高、光稳定性好、结构易修饰等[21]。鉴于目前ONOO-荧光探针存在的不足及苯并噻唑衍生物优异的荧光性能,本文制备了一种2-(2′-羟基-3′-(1,1-二甲基腙)-5′-甲基苯基)苯并噻唑(BD)探针,该探针以HBT为荧光基团,1,1-二甲基腙为识别基团。探针BD由于识别基团上的N—N单键旋转产生非辐射能量损失,导致荧光较弱。但在ONOO-氧化下,BD上的腙被水解成醛基,N—N单键脱落,荧光恢复。且探针BD对ONOO-的识别具有响应快、灵敏度高和选择性好的特点。此外,该探针具有良好细胞渗透性,适用于肝癌细胞中内源性ONOO-的荧光成像。本研究为生物体内ONOO-的识别与成像提供了一种可靠、有效的分析方法。
1 实验部分
1.1 仪器及试剂
核磁共振氢谱和碳谱由Bruker AVANCE-500M型核磁共振仪测得。高分辨质谱通过Brucker APEX IV(7.0 T)FTMS型高分辨质谱仪测得。紫外光谱和荧光光谱分别在UV-2600型紫外-可见分光光度计(Shimazu Co,Japan)和RF-5301PC型荧光分光光度计(Shimazu Co,Japan)上测定。细胞成像在共聚焦荧光显微镜(Leica TCS SP8,Germany)下拍摄。

1.2 探针BD的合成与表征
取一洁净的圆底烧瓶(50 mL),向其中依次加入BA(269 mg,1.0 mmol)、1,1-二甲基肼(83 μL,1.1 mmol)、哌啶(100 μL)和乙醇(15 mL),然后将混合物回流反应12 h。待反应结束后,有固体析出,静置1 h 后,用布什漏斗过滤。滤渣用乙醇冲洗3次后,得到纯净的淡黄色化合物BD(283 mg,91%)。1H NMR(500 MHz,CDCl3):δ13.10(s,1H),8.14(d,J=7.6 Hz,1H),8.07~8.05(m,2H),7.70(s,1H),7.55(t,J=8.0 Hz,2H),7.45(t,J=8.0 Hz,1H),7.39(d,J=7.6 Hz,1H),2.98(s,6H),2.53(s,3H)。13C NMR(126 MHz,CDCl3):δ163.6、153.3、151.9、136.0、135.5、132.0、128.6、127.8、126.8、125.4、122.7、122.4、121.5、119.5、43.0、20.6。化合物BD(C17H18N3OS+)的理论相对分子质量为312.116 5,实测值为312.117 4。
1.3 光谱测试
样品溶液的配制:向2 mL测试管中加入20 μLBD母液和适量体积的分析物母液(1 mmol/L),再用PBS溶液(DMSO∶H2O=2∶8,体积比,pH 7.4)稀释至刻度。然后转移至比色皿(1 cm)中进行光谱测试。在测试荧光发射光谱时,激发波长设定为425 nm。
1.4 细胞成像
将HepG2(肝癌细胞)细胞放置在培养液中(含100 g/mL链霉素和100 U/mL青霉素以及10%小牛胚胎血清)培养,细胞培养箱温度设置为37 ℃,CO2含量设定为5%。在进行成像实验之前,将HepG2细胞转移至96孔板中生长24 h。取一部分HepG2细胞与BD(10 μmol/L)共孵育30 min,作为空白组;另取一部分HepG2细胞与BD(10 μmol/L)共孵育30 min后,再与SIN-1(200 μmol/L,一种诱导细胞产生ONOO-的刺激物)共孵育30 min,作为实验组。用温热的PBS溶液(37 ℃,pH 7.4)冲洗细胞外残留的探针。最后,在共聚焦荧光显微镜下观察并拍摄两组细胞的明场图和荧光图。
2 结果与讨论
2.1 光谱表征
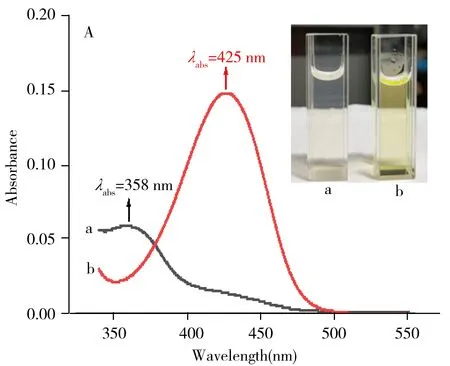
为了考察探针BD对ONOO-的响应情况,测定了BD与ONOO-反应前后的紫外光谱和荧光光谱。结果如图1所示,探针在358 nm处有1个明显的紫外吸收峰(εmax=0.59 ×104L·mol-1·cm-1)。然而,在加入ONOO-后,此处的吸收峰消失,与此同时,在425 nm处产生新的吸收峰(εmax=1.48×104L·mol-1·cm-1),说明探针BD与ONOO-发生了化学反应。探针BD自身荧光较弱(Φ=0.011,硫酸喹啉(Φs=0.58)作为标准物),可能是因为其结构上的N—N单键旋转产生了非辐射能量损失。然而,在探针BD溶液中加入ONOO-后,于528 nm处出现1个明显的荧光发射峰(Φ=0.316,硫酸喹啉(Φs=0.58)作为标准物),这可能是由于探针BD在ONOO-氧化下,识别基团脱落,有效地抑制了N—N单键旋转所产生的辐射能量损失。此外,探针BD与ONOO-反应后,Stokes位移高达103 nm,在荧光测试中可有效避免自身荧光吸收和内滤效应。如图1插图所示,探针BD与ONOO-混合后产生明显的颜色变化,进而证明探针BD与ONOO-反应产生了新的荧光物质。上述实验结果表明探针BD可以用来检测ONOO-。
2.2 检测机理
探针BD以苯并噻唑为荧光基团,1,1-二甲基腙为识别基团,基于BD与ONOO-反应前后的光学变化,推测BD上的腙被ONOO-氧化水解成醛基,最终生成化合物BA。为了证实这一推断,考察了BD与ONOO-反应前后的高分辨质谱,结果如图2所示。BD在m/z=312.117 4处有1个强的分子离子峰。然而,与ONOO-反应后,在m/z=270.059 0处出现1个新的、强的分子离子峰,该数值与化合物BA的理论相对分子质量(m/z=270.058 3)一致,表明探针确实被ONOO-氧化水解成化合物BA。因此,提出如下检测机理(图3):探针BD由于存在N—N单键旋转,荧光较弱;然而在ONOO-存在下,BD上的腙被氧化水解化成醛,N—N单键脱落,荧光恢复。根据检测体系荧光强度与ONOO-浓度的相关性,可实现对ONOO-的定量检测。

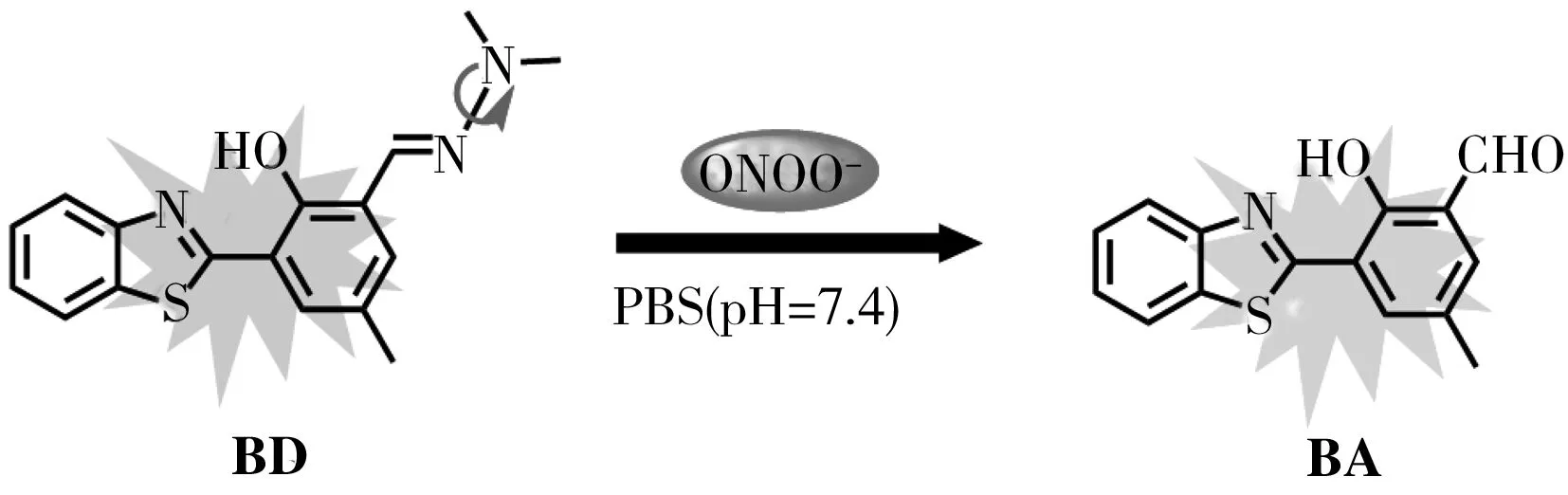
图3 探针BD检测过氧亚硝酸盐的机理示意图Fig.3 The detection mechanism of ONOO- by probe BD
2.3 条件优化
为了获得最佳的灵敏度,对反应时间和溶液pH值进行了优化。如图4A所示,探针BD与ONOO-在25 s内反应完全,如此快的响应为机体内ONOO-的实时、原位检测提供了保障。pH值的影响如图4B所示,在整个pH值范围内,探针BD对ONOO-具有较稳定的荧光响应,表明BD适用于生理pH值范围。因此,在后续实验中,选择25 s作为探针与ONOO-的反应时间,pH 7.4 的PBS 缓冲溶液作为检测介质。

2.4 灵敏性
在最佳检测条件下,测试了探针BD(10 μmol/L)与不同浓度的ONOO-(0~14 μmol/L)反应后的荧光光谱。随着ONOO-浓度的增加,荧光发射光谱不断上升。当ONOO-的浓度超过10 μmol/L后,荧光达到饱和。更重要的是,检测体系在528 nm处的荧光强度(Y)与ONOO-的浓度(X,0~10 μmol/L)呈现良好的线性关系,线性方程为Y=0.090 42X+0.092 27,线性系数为0.999 87。根据检出限计算公式[24],得到方法检出限为7 nmol/L。与文献报道的其他ONOO-探针相比(表1),探针BD具有较低的检出限和较快的反应速度。

表1 检测ONOO-荧光探针的比较Table 1 Comparison of ONOO-fluorescent probes
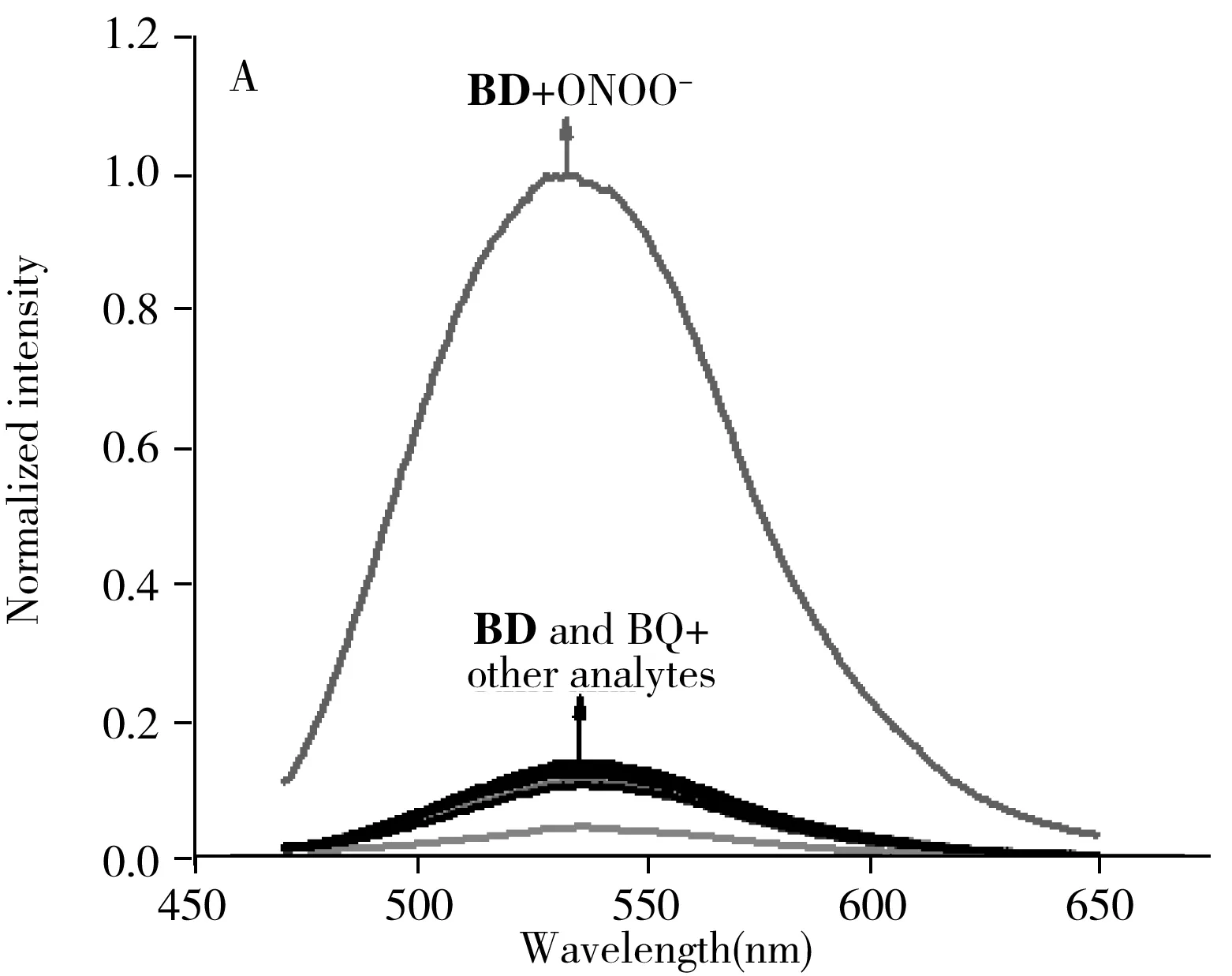
2.5 选择性
2.6 细胞成像
为了探究探针BD的生物应用,进行了活细胞荧光成像实验。结果如图6所示,当HepG2细胞与BD(10 μmol/L)共孵育30 min后,细胞内部荧光较弱(图6A下图)。然而,将负载BD的HepG2细胞与SIN-1(200 μmol/L)继续孵育30 min后,可以观察到明显的绿色荧光(图6B下图)。通过明场成像图(图6B上图)可知,细胞形态正常,说明BD具有优异的生物相容性,可用于活细胞中内源性ONOO-的荧光成像。
3 结 论
本研究以苯并噻唑为荧光基团,1,1-二甲基腙为识别基团,设计并合成了一种新型ONOO-荧光探针BD。该探针简单易得,产率较高(91%),对ONOO-的荧光分析具有响应快速(25 s),检出限低(7 nmol/L)和选择性高的优势。荧光成像结果证实探针BD可用于活细胞中ONOO-的实时、原位检测。本工作为深入研究机体内与ONOO-相关的生理与病理功能提供了一种强有力的方法。

