生物钟在肿瘤调控中的研究进展
高东晓,刘 丹,郭 强,罗 瑛*,刘 静*
(1.昆明理工大学 医学院 衰老与肿瘤分子遗传学实验室, 云南 昆明 650500; 2.云南省第一人民医院消化疾病内科学研究所, 云南 昆明 650011)
生物钟(biological clock)普遍存在于生物体内,并影响着生物的生理、生化和行为活动等。生物钟的紊乱会导致细胞周期、凋亡、免疫功能等异常,而这些与恶性肿瘤的发生、发展密切相关基[1]。本文结合新近国内外关于生物钟的研究,就生物钟对肿瘤发生的重要性和在肿瘤治疗中的应用作一介绍。
1 生物钟概述
机体的生理、代谢和行为活动等都遵从一定的昼夜变化规律,而这种变化是由生物钟调控的。生物钟受多种因素的影响,如光照、进食时间等。哺乳动物体内的生物钟包括:中枢生物钟(俗称母钟)和外周生物钟(俗称子钟)两大类,中枢生物钟通过调节机体的睡眠/觉醒、进食时间等调控外周生物钟。中枢生物钟位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN),主要由3个必需元件组成:中央振荡器、能感知外界的时间并随其变化而重新设置时钟能力的输入通路、与振荡器相关的输出通路[2]。
生物节律的维持主要受生物钟基因的调控。目前发现的主要生物钟基因有:周期蛋白(period,PER)家族(包括PER1、PER2、PER3)、隐花色素(cryptochrome,CRY)家族(包括CRY1、CRY2)、昼夜节律运动输出周期故障(circadian locomotor output cycles kaput,CLOCK)、 脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(brain and muscle ARNT-like protein 1,BMAL1)、酪氨酸激酶1ε(casein kinase 1ε,CK1ε)、永恒蛋白(timeless,TIM)、神经元PAS域蛋白2(neuronal PAS domain protein 2,NPAS2)和视黄酸受体相关的孤儿受体α(retinoic acid receptor-related orphan receptorα,RORα)等。核心时钟基因主要包括编码激活因子CLOCK和BMAL1,以及编码抑制因子PER1、PER2、CRY1和CRY2[3]。生物钟基因通过调控钟控基因(clock control genes,CCGs)来调节下游事件,进而参与细胞凋亡、代谢、内分泌信号和免疫等多种生理活动[4-5]。生物钟调控的转录-翻译反馈回路,其中一个反馈回路为:细胞核中的转录因子BMAL1与CLOCK(或NPAS2)结合形成异二聚体BMAL1/CLOCK(或BMAL1/NPAS2)结合到靶基因的增强子E-box (enhancer box)区域,导致这些基因被激活,如:PER1/2/3和CRY1/2 等,之后PERs和CRYs在细胞质中富集,并进行一系列的翻译后修饰,当积累达到临界值时,就会进入核内抑制BMAL1/CLOCK(或BMAL1/NPAS2)二聚体的活性,从而抑制自身基因的转录[6]。另一个反馈回路为:REV-ERB(REV-ERB/ROR response element)是BMAL1的负调控因子,ROR是正调节因子[7](图1)。不同反馈回路之间的相互作用使生物钟的调控出现近似24 h的周期,随后通过输出系统调节效应器形成昼夜节律。

图1 哺乳动物生物钟的转录/翻译反馈回路Fig 1 Transcriptional/translational feedback loop of the mammalian circadian clock
生物钟基因调控紊乱可导致机体内环境失调,其后果与多种疾病的发生发展有关,包括内分泌紊乱、代谢综合征和肿瘤等。
2 生物钟与肿瘤的相关性
肿瘤的主要特征是细胞周期紊乱、持续地增殖等。由于生物钟基因参与细胞增殖、凋亡等的调控,因此,生物钟与肿瘤密切相关。
2.1 生物钟基因参与细胞周期的调控
细胞受到多种刺激后,是增殖、分裂还是死亡,这些过程皆与生物钟的调节有关[8]。如果生物钟基因表达出现紊乱,可使与细胞增殖相关的基因表达增加,凋亡基因表达下调,从而导致多种与细胞增殖、异常死亡等相关疾病的发生。在MTCL小鼠的胸腺细胞中,PER1、PER2的下调可导致cyclin E、cyclin D1、cyclin C、COX1蛋白表达的增加[9]。因此,生物钟基因下调促进肿瘤的生长,这可能与cyclin E、cyclin D1和COX1表达的增加有着密切的联系。
另外,乳腺上皮细胞中的生物钟基因改变导致细胞周期紊乱,这是由细胞异常分裂引起的,可能与乳腺癌的形成有关[1]。有趣的是,在乳腺癌体外实验中,诱导PERs基因的过表达可引起细胞周期停滞,抑制细胞增殖和凋亡[10]。但是CRYs基因的缺乏可导致WEE-1和cyclin D1表达的紊乱,因此CRYs可能发挥了类似于PERs的作用[10]。综上,生物钟可能通过细胞周期抑制肿瘤的发生。
2.2 生物钟基因的节律性表达与肿瘤的关系
生物体内大部分基因的表达都遵循一定的节律,如:大鼠鼻黏膜中PER1、PER2、CLOCK、BMAL1和P53都是节律性表达的[11]。小鼠体内至少在一种组织中有高达43%的蛋白编码基因呈昼夜节律性表达[12]。另外,在大多数器官中,昼夜节律基因的表达通常以双峰的形式在黄昏或黎明之前的数小时内达到峰值[12]。事实上,大多数基因表达的调控阶段,从转录、剪接、终止、多腺苷酸化、核输出、microRNA调控、翻译到RNA降解都具有节律性。
生物钟基因呈现出节律性表达,且能够调控肿瘤的生长。但是,当生物钟基因表达发生改变时,肿瘤生长节律的周期及振幅都会受到影响。如:PER2的下调会加速肿瘤的生长,且肿瘤生长节律的时间点发生了改变;PER1、PER2的下调,肿瘤生长节律的振幅也发生了改变[9];PER2敲除后乳腺癌细胞增殖的节律延迟了4 h[6]。因此,肿瘤在不同时间点具有不同的生长速度,造就了其在不同时间点大小的不同,提示对肿瘤测量时,选取不同的时间点可能会造成误差。
2.3 生物钟基因转录修饰与肿瘤的关系
基因的突变与其功能及表达密切相关,而哺乳动物转录组的节律性是通过有节奏地招募染色质结构的关键修饰物来实现[13],例如甲基化。但是生物钟基因PER的突变并不会使其蛋白表达下调。在肿瘤细胞中PER基因表达的下调往往表现为启动子的甲基化。人类的癌往往是由于生物钟基因甲基化过度引起的[13],如:结直肠癌患者血液中PER1和PER2经常甲基化[14]。但是在急性T淋巴母细胞中的PER2启动子区观察到低甲基化水平[15]。因此肿瘤细胞中生物钟基因启动子甲基化状态会因个体而有所差异。另外,不同肿瘤细胞系特定生物钟基因启动子位点呈现不同的甲基化频率[13]。有趣的是,DNA甲基化也是存在节律性的[13],核心生物钟基因的异常可能会影响DNA甲基化。
2.4 生物钟基因PERs参与P53通路调控肿瘤的发生
野生型小鼠胸腺细胞在γ射线照射后以P53途径诱导细胞凋亡,但是在γ射线照射后的mPERm/m小鼠却出现诱导凋亡不足的现象。那么mPERm/m小鼠诱导的凋亡是否依赖于P53途径?内源性凋亡途径是细胞凋亡的两大途径之一,线粒体接受凋亡信号后,向细胞质中释放的细胞色素c(Cyt c)与APAF-1和caspase-9结合形成凋亡复合体,进一步激活下游的级联反应。γ射线照射后,野生型小鼠线粒体中的Cyt c低于mPERm/m小鼠,但细胞质中的Cyt c高于mPERm/m小鼠。因此,猜测mPERm/m诱导的凋亡不足是由于线粒体中Cyt c释放不足引起的[16]。由于P53竞争性地与PER2结合,可能会阻止MDM2介导的P53泛素化和蛋白酶体降解[17]。因此,mPERm/m所引起的凋亡不足可能是抑制了P53调节的线粒体信号通路。
另外,mPER2-/-小鼠表现出细胞增殖和凋亡相关基因的异常表达,如cyclin A和MDM2。因为MDM2参与了P53的负转录后调控,而生物钟基因又会直接影响P53的表达[18],推测PER2可能通过P53参与肿瘤抑制。C-myc作为PER2下游的钟控基因,在mPERm/m小鼠中表达增加[16]。因此,ER2也可能通过c-myc途径参与肿瘤的抑制(图2)。
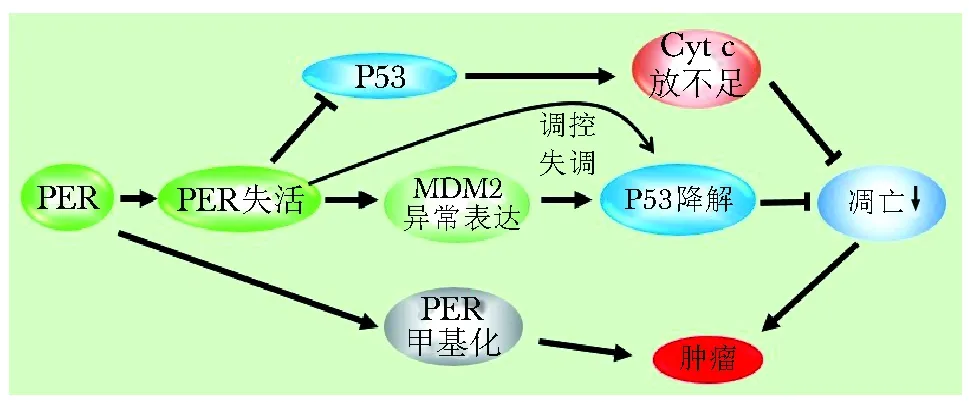
图2 PERs与肿瘤的发生Fig 2 PERs and tumorigenesis
3 讨论与展望
昼夜节律的紊乱促进肿瘤的发生,探究昼夜节律机制可能对肿瘤的治疗和干预提供有用的价值。有统计发现美国市场上大多数畅销药的靶标都会受到生物钟的调节[12]。由于生物钟基因表达的节律性,使得在用生物钟靶向药物时的最佳给药时间被认为可以最大限度的发挥抗肿瘤作用和最小的毒副作用。例如,mTOR的表达是有节律的,在mTOR表达的高峰期给予抗癌药物mTOR抑制剂-依维莫司(everolimus)可以提高小鼠的存活率[19];鸦胆子油(bruceae fructus oil)抗肿瘤的作用也是有时间节律性,晚上22∶00给药,抗肿瘤作用最佳,不良反应较少,能明显改善小鼠的生活质量[20]。
不管是通过药物,还是技术手段调控生物钟基因的表达,如果简单地改变生物钟基因的蛋白表达水平,可能并不会达到预期的效果,毕竟生物钟是多种基因参与调控的整体系统,只改变其中一个或几个基因的表达可能会造成整个生物钟调控系统的紊乱。但是,如果生物钟基因蛋白发挥生物节律功能和抑制肿瘤功能位于不同的结构域上,那么或许可以在不影响生物钟基因的蛋白生物节律的前提下,增加其抑制肿瘤的功能[9]。
生物钟的重要性已为人熟知,但是仍有很多重要的问题并未得到解决。例如:PER蛋白是如何调节基因转录的?中枢生物钟是如何调控外周生物钟的?在众多未知问题面前,目前的研究仍显得不够深入,因此,关于生物钟的研究还有更广阔的天地。

