BDNF在ALS转基因小鼠活化星形胶质细胞中表达升高
丁 康,张烽萍,王淑坤,刘美逸,蒋 欣,陈燕春,周风华*
(潍坊医学院 1.临床病理系; 2.生命科学与技术学院; 3.组织学与胚胎学教研室, 山东 潍坊 261053)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种致死性神经退行性疾病,主要引起脑干、脊髓运动神经元退变,具有遗传和临床异质性的特点[1]。目前尚无治疗本疾病的有效方法。ALS的发生与多种机制有关,神经元自主机制与星形胶质细胞(astrocyte,AS)介导的非细胞自主机制成为关注的焦点[2],研究发现活化的星形胶质细胞是造成ALS运动神经元退变的重要因素[3]。
脑源性神经营养因子(brain derived neurotrophic factor,BDNF)属于神经营养素家族成员,对运动神经元的存活至关重要[4]。前期实验发现BDNF在ALS转基因小鼠脊髓组织的表达增加[5],而BDNF增加的机制尚不明确,本实验选用ALS转基因小鼠、胚胎小鼠运动神经元样杂交细胞系(mouse motor neuron-like hybrid cell line,NSC34)及原代星形胶质细胞作为动物及细胞模型,从BDNF表达变化的角度进一步阐明神经元自主机制与非细胞自主机制在ALS发病中的作用。
1 材料与方法
1.1 材料
1.1.1 动物及细胞:野生型(wild type,WT)及SOD1-G93A突变型转基因小鼠由美国Jackson Laboratories提供,将携带人突变SOD1-G93A的转基因小鼠和野生型人SOD1的小鼠配对杂交,用PCR技术对同窝小鼠尾组织进行基因分型,分为WT组和ALS组。分别于转基因小鼠发病不同时间点(95、108和122 d)取材。所有实验动物均按照潍坊医学院实验动物规范条例实施。NSC34细胞由美国哈佛大学王欣实验室馈赠。原代星形胶质细胞由本实验室培养。
1.1.2 主要试剂:兔抗BDNF、鸡抗胶质纤维酸性蛋白(GFAP)和鸡抗β-tubulin Ⅲ多克隆抗体(Abcam公司),Cy3标记的羊抗兔荧光二抗、Alexa Fluor-488标记的羊抗小鼠荧光二抗、HRP标记的羊抗兔和羊抗小鼠二抗(Jackson公司);小鼠抗GAPDH单克隆抗体(Proteintech Group公司);DMEM/F12培养基(HyClone公司);胎牛血清(Gibco公司);BCA、ECL、Lipoectamine 2000(Thermo Fisher Scientificals公司);pEGFP-WT-SOD1、pEGFP-G93A-SOD1质粒由意大利Angelo Poletti博士友情馈赠。
1.2 方法
1.2.1 细胞培养及分组处理:取2~3 d新生转基因小鼠提取星形胶质细胞,分离脊髓及大脑皮质组织剪碎、过滤、离心后置于含20%胎牛血清DMEM/F12培养基中,于37 ℃、5% CO2培养箱倒置孵育1 h差速贴壁,24 h后半量更换培养基,待10 d左右恒温摇床振荡18 h进行细胞纯化,将细胞传代培养。同时提取小鼠尾组织DNA进行基因分型,分为野生型(wild type,WT)组和ALS组。将NSC34细胞置于含10%胎牛血清的高糖DMEM培养基,于37 ℃、5% CO2培养箱培养。按照Lipofectamine 2000试剂盒说明将处于对数增殖期的细胞进行质粒转染。实验组转染pEGFP-G93A-SOD1质粒,对照组转染pEGFP-WT-SOD1质粒。
1.2.2 免疫荧光检测:取脊髓冰冻切片室温晾2 h,PBS清洗3次/5 min,10%羊血清37 ℃封闭30 min,分别加入兔抗BDNF(1∶100)+鼠抗GFAP(1∶300),兔抗BDNF(1∶100)+鼠抗β-tubulin Ⅲ(1∶200)的一抗混合液于4 ℃过夜;滴加 Cy3 标记的羊抗兔和Alexafluor 488标记的羊抗鼠荧光二抗,避光37 ℃孵育50 min;避光染核,荧光防淬灭封片剂封片。荧光显微镜下观察,应用Image-Pro Plus 6.0软件比较神经元内BDNF平均吸光度值(A),计数BDNF/GFAP双阳性细胞数。
1.2.3 蛋白免疫印迹检测:分别提取NSC34细胞及AS细胞蛋白质,BCA法检测蛋白浓度。取每组蛋白质样品于12% SDS-PAGE进行电泳,转PVDF膜,5%脱脂奶粉封闭PVDF膜2 h,兔抗BDNF(1∶500)、小鼠抗GAPDH单克隆抗体(1∶2 000),4 ℃孵育过夜;HRP标记的羊抗兔或羊抗小鼠二抗室温孵育2 h,漂洗后ECL化学发光,凝胶图像分析系统观察拍照。应用Image J软件分析Western blot条带吸光度值,以BDNF与GAPDH条带吸光度值代表BDNF相对水平。
1.3 统计学分析

2 结果
2.1 BDNF在ALS转基因小鼠脊髓组织的定位及表达变化
在95、108和122 d转基因小鼠脊髓组织中BDNF免疫阳性细胞主要定位于脊髓前角,WT组中BDNF阳性细胞大多与β-tubulin Ⅲ标记的神经元共表达,几乎检测不到BDNF与GFAP标记的星形胶质细胞共表达;在ALS组,BDNF在神经元中表达减弱(P<0.05),而BDNF/GFAP双阳性细胞明显增多,BDNF/GFAP双阳性细胞占总活化星形胶质细胞的比率为43%(图1)。
2.2 BDNF在NSC34细胞中的表达变化
与转染pEGFP-WT-SOD1质粒相比,BDNF在转染pEGFP-G93A-SOD1质粒的NSC34细胞中表达下调(P<0.05)(图2)。
2.3 BDNF在原代星形胶质细胞中的表达变化
与WT组相比,BDNF在ALS组星形胶质细胞中表达上调(P<0.05)(图3)。
3 讨论
ALS是一种由上、下运动神经元选择性缺失引起的进行性神经退行性疾病,以胶质细胞介导的非细胞自主机制导致的运动神经元死亡是目前关注的焦点。有证据表明在突变型SOD1诱导的ALS发病机制中,非细胞自主变性是重要的机制之一[2,6]。星形胶质细胞增殖活化后会通过释放细胞因子/神经毒性因子/ROS、谷氨酸摄取和Ca2+信号受损等方式造成神经元毒性[3]是非细胞自主机制的主要方面。

A.expression of BDNF in astrocytes;B.BDNF expression in neurons;C.statistical analysis of mean absorbance of BDNF in neurons(bar=50 μm);*P<0.05 compared with WT group
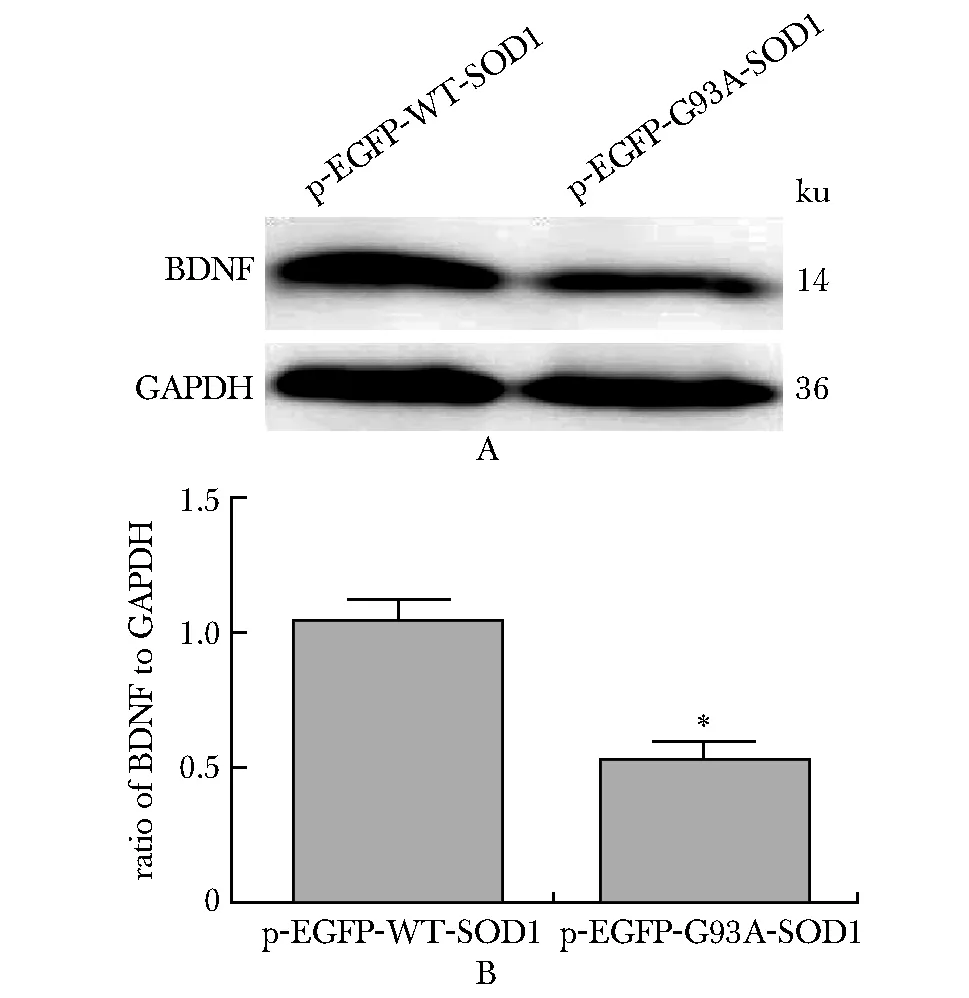
A.representative results of Western blot;B.statistical analysis of BDNF protein expression level;*P<0.05 compared with pEGFP-WT-SOD1 group图2 Western blot检测NSC34细胞模型中 BDNF表达水平Fig 2 Western blot detected BDNF expression in NSC34 cells

A.representative results of Western blot;B.statistical analysis of BDNF protein expression level;*P<0.05 compared with WT group图3 Western blot检测原代星形胶质细胞中 BDNF表达水平Fig 3 Western blot detected BDNF expression
在神经系统中,AS可分为两种不同的表型:A1和A2。A1星形胶质细胞上调补体炎性信号通路相关基因的表达,可归类为“有害的”星形胶质细胞。A2星形胶质细胞上调部分神经营养因子的表达,可作为神经保护细胞。鉴于炎性A1和保护性A2星形胶质细胞群体之间的功能差异,反应性星形胶质细胞可能在ALS疾病病理中发挥双重作用[2-3,7]。
BDNF是神经营养素家族中的一员,通过调节大脑细胞的存活、增殖和突触生长来维持神经可塑性[8]。前期实验已证实BDNF在ALS转基因小鼠脊髓组织中表达上调[5],本实验进一步发现在野生型ALS转基因小鼠脊髓组织内BDNF主要表达于神经元,在突变型ALS转基因小鼠脊髓组织内BDNF在神经元内表达强度降低,同时SOD1-G93A突变型NSC34细胞中BDNF表达也呈下降趋势,提示SOD1突变造成了运动神经元的损伤,神经元自主机制在ALS的发生中发挥了作用;同时还发现BDNF在转基因小鼠脊髓组织主要表达在一些非神经元细胞,通过GFAP与BDNF免疫荧光双标记,显示这些表达BDNF的非神经元细胞是活化的星形胶质细胞,而BNDF/GFAP双阳性细胞占活化星形胶质细胞的43%,原代星形胶质细胞培养的结果发现在SOD1-G93A突变型星形胶质细胞中BDNF表达明显上调,提示SOD1突变导致了星形胶质细胞的活化,而表达SOD1突变的星形胶质细胞可能与ALS的运动神经元损伤有关[9]。同时部分活化的星形胶质细胞通过合成BDNF对退变神经元进行保护,而大部分活化星形胶质细胞对神经元发挥毒性作用[7],由此推断SOD1突变造成了运动神经元退变及星形胶质细胞的活化,活化的星形胶质细胞对神经元的作用具有两面性,而最终的作用可能是损伤性,神经元自主机制及非细胞自主机制在ALS运动神经元退变中均发挥了作用。

