miR-618靶向SOCS1对肝癌患者中树突状细胞表型及功能的调控机制
张壮苗 张 岩
(三亚市人民医院血液肿瘤科,三亚 572000)
肝癌为当前最常见的恶性肿瘤之一,该病起病隐匿、术后易复发且对放化疗敏感性均较差,总体治疗效果仍有待提高[1]。近年来生物免疫治疗在癌症治疗中的作用被逐渐发现,树突状细胞(dendritic cell,DC)是目前已知的最强大的抗原提呈细胞,其能够有效激活静息期T细胞,同时促进患者免疫功能的恢复、提高抗肿瘤能力,已成为肿瘤免疫治疗的热点[2]。
细胞因子信号转导抑制因子-1(suppressors of cytokine signaling 1,SOCS1)经研究证实能够对多种细胞因子进行调节,同时与DC分化、T细胞功能以及肿瘤的发生和进展存在关联[3]。有研究证实SOCS1沉默能够促进DC抗原提呈、增强细胞免疫功能并且促进IFN-γ以及TNF-α的分泌水平[4]。同时,SOCS1拮抗物能够显著增强树突状细胞的抗肿瘤能力[5]。越来越多的研究表明miRNA以及基因在DC的发育、分化以及功能调控发挥重要作用[6]。如有研究发现miR-146a能够靶向CD40L基因进而调控氧化修饰低密度脂蛋白刺激的DC的成熟以及炎症因子的分泌[7]。此外也有研究证实抑制miR-148a能够调节DC以及T细胞,可作为一种新的抗癌免疫治疗的手段[8]。miR-618经研究证实在甲状腺癌以及前列腺癌中发挥抑癌因子的作用[9,10],但是其在肝癌的发病中是否发挥作用尚未明确,我们通过生物信息学在线预测网站发现miR-618与SOCS1存在结合位点,因此选定miR-618作为SOCS1的靶向miRNA,旨在进一步探讨其是否能够影响肝癌DC免疫调控功能,同时探讨其具体调控机制,希望为肝癌的免疫治疗提供新的靶点。
1 材料与方法
1.1材料 RIPA裂解液、BCA试剂盒购自上海碧云天生物技术有限公司;LipofectamineTM3000试剂盒、RPMI1640培养基、Gibco Opti-MEM培养基和NanoDrop-1000购自赛默飞世尔公司;pmirGLO质粒购自ADDgene公司;质粒提取试剂盒Sigma、双荧光素酶试剂盒购自Promega公司;TransScriptⅡ Green One-Step qRT-PCR SuperMix试剂盒购自全式金公司;TNF-γ、IL-6和IFN-α ELISA试剂盒购自齐一生物科技(上海)有限公司;所有抗体均购自Abcam公司;HEK-293T细胞购自武汉普诺赛公司;TRIzol试剂盒购自Invitrogen公司;CytoFLEX流式细胞仪和UniCel DxI800全自动免疫分析系统购自贝克曼库尔特公司;荧光定量PCR仪购自Bio-Rad公司;所有序列均由华大基因合成。
1.2方法
1.2.1DC诱导分离 采集我院58例肝癌患者外周血,通过淋巴细胞分离液离心得到外周血单核细胞(peripheral blood mononuclear cells,PBMC),培养于RPMI1640全培基中(RPMI1640+10%胎牛血清+2 mmol/L-谷氨酰胺+100 U/ml 青霉素+100 μg/ml 链霉素+1 g/L 非必需氨基酸+1 mmol/L 丙酮酸钠+5×105mol/L的巯基乙醇)。待培养至第3天换液,吸去原培养液,加入等量含有IL-4 和GM-CSF 的新鲜RPMI1640培养液和适量肝癌细胞裂解液作为抗原刺激物,置CO2孵箱中培养。培养7 d左右使其分化成DC,但并未成熟。此时轻轻吸去含有IL-4和GM-CSF的RPMI1640培养液,更换等量的含有IFN-α的RPMI1640培养液,继续置于5%CO2孵箱中37℃培养,至第9天时可获得成熟的DC。
1.2.2T细胞分离 取PBMC,用含10%小牛血清的RPMI1640培养液将细胞配成2×107个/0.5 ml。融化冻存的尼龙毛柱,以5~7滴/min的速度放出Hanks液。用5 ml预温至37℃的细胞培养液洗涤尼龙毛柱。将0.5 ml的PBMC悬液加入尼龙毛柱中,待细胞悬液全部进入尼龙毛柱后,立即加0.2 ml细胞培养液,夹住塑料管。在37℃、5%CO2饱和水汽CO2培养箱中培养1 h,使细胞与尼龙毛充分黏附。用5 ml预温至37℃的细胞培养液洗脱尼龙毛柱。洗脱液中含有纯的T细胞。收集洗脱液并于2 230 r/min 转速下离心10 min,去上清,进行常规培养。
1.2.3DC细胞及T细胞表面标志物检测 用适量的培养基重悬细胞,调整其浓度为2×106个/ml。DC细胞表面标志物检测:在每个流式细胞管中加入50 μl稀释后的CD83-FITC或CD1a-PE。T细胞表面标志物检测:在每个流式细胞管中加入50 μl稀释后的CD3-APC、CD4-FITC或CD8-PE。随后在各管中加入50 μl细胞(约4×107个细胞),轻轻混匀后避光冰浴20 min。随后于4℃下2 000 r/min离心 10 min,弃去上清,在细胞沉淀中加入500 μl PBS缓冲液轻轻吹洗,再置于4℃下2 000 r/min离心10 min,此步骤重复2次。最后400 μl PBS悬浮细胞沉淀上机检测。Cellquest分析流式结果。
1.2.4双荧光素酶报告系统鉴定miR-618与SOCS1靶向关系 设计SOCS1的野生型及定点突变的3′UTR 片段并交由华大基因合成,随后分别克隆到含有荧光素酶报告基因pmirGLO上游。挑菌、测序后提纯质粒备用。miR-618 mimic和阴性对照序列(由赛默飞世尔合成)分别与野生型及突变型3′UTR片段按LipofectamineTM3000说明书两两共转染至HEK-293T细胞。转染后4 h换液,在37℃、5%CO2的培养箱中培养48 h后,收获细胞。双荧光素酶试剂盒和全自动化学发光仪检测细胞相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.2.5细胞分组及转染 将DC分为如下几组:mimic NC组(细胞转染含mimic NC脂质体)、miR-618 mimic组(细胞转染含miR-618 mimic脂质体)、sh-SOCS1组(细胞转染含SOCS1 shRNA质粒的脂质体)、sh-NC组(细胞转染含shRNA NC质粒的脂质体)、miR-618 mimic+sh-SOCS1组(细胞共转染含SOCS1 shRNA和miR-618 mimic的脂质体),转染和细胞培养步骤依据lipofectamin 3000说明书进行。
1.2.6荧光定量PCR检测DC中miR-618表达 按TRIzol试剂盒提取DC中总RNA。DEPC处理的超纯水溶解RNA,使用ND-1000测量260 nm和280 nm 下吸光值,对总RNA的质量进行鉴定及测定浓度。利用TransScript Ⅱ Green One-Step qRT-PCR SuperMix试剂盒一步完成RT-PCR合成及qPCR。反应体系和反应条件均依据试剂盒说明书进行。使用实时荧光定量PCR仪进行扩增,测定miR-618表达水平(上游引物:5′-GGGGAAACTCTA-CTTGTCCTT-3′,下游引物:5′-TCGTATCCAGTGC-GTGTCGT-3′),相对表达水平以U6为内参(上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物:5′-CGCTTCACGAATTTTGCGTGTCAT-3′),引物序列由华大基因合成。采用溶解曲线评价PCR结果的可靠性,2-ΔΔCt法计算miR-618表达量。
1.2.7Western blot检测SOCS1蛋白表达 RIPA裂解液使用前5min加入PMSF,使PMSF终浓度为1 mmol/L。弃去细胞培养基,PBS洗涤细胞2次,将适当的RIPA裂解液加入DC中(2×107细胞中加入1 ml裂解液)并于冰上孵育5 min。裂解物于12 000 g、4℃下离心5 min。BCA试剂盒测定蛋白浓度并用去离子水调整,随后进行SDS-PAGE凝胶电泳并转至PVDF膜上。含5%牛血清蛋白的TBST在摇床上室温封闭1 h。弃去封闭液,加入鼠一抗SOCS1。GAPDH作为内参。转膜后置于4℃冰箱过夜。次日,用TBST漂洗,加入稀释后的山羊抗鼠IgG二抗,4℃孵育4~6 h后,TBST洗膜。PVDF膜与ECL液在室温下反应1 min。吸去液体,覆盖保鲜膜,拍摄X光片,观察结果。以目标条带与内参照条带的灰度值之比作为蛋白质的相对表达量。
1.2.8DC活化表面抗原检测 于Falcon管中加入CD11c-FITC、HLA-DR-ECD、CD86-PE、CD4-APC,在各管加入含DC的培养液,在2 000 r/min下离心20 s,待DC被完全标记后避光反应20 min,随后每管加入生理盐水100 μl,充分混匀后2 500 r/min离心2 min,取细胞沉淀置于流式管,在5 min内上流式细胞仪检测,CellQuest分析流式结果。
1.2.9ELISA检测DC上清液中TNF-γ、IL-6和IFN-α水平 离心3 000 r/min,20 min收集DC上清液,随后分别根据TNF-γ、IL-6和IFN-α细胞因子试剂盒测定上清中TNF-γ、IL-6和IFN-α浓度。
1.2.10细胞划痕实验 使用marker笔在6孔板背后,用直尺比着均匀划横线,每隔0.5~1 cm 1条,横穿过孔。每孔至少穿过5条线。在孔中加入约5×105个DC,待过夜铺满。使用时枪头尽量垂直于背后的横线划痕,不能倾斜。PBS洗涤细胞3次,去除划下的细胞,加入无血清培养基,在孔板中央滴加少量分离得到的T细胞进行迁移诱导。放入37℃、含5%CO2培养箱中培养。72 h取样,拍照,计算迁移率。

2 结果
2.1CD3+CD4+和CD3+CD8+T细胞纯度 流式细胞术检测尼龙毛柱分离后的T淋巴细胞亚型情况。结果显示(图1),含有T细胞表面标志分子CD3+的细胞约占93%,说明分离得到的T细胞纯度较高。检测其T细胞亚群情况,其中CD3+CD4+细胞约占35%,而CD3+CD8+T细胞约占49%。
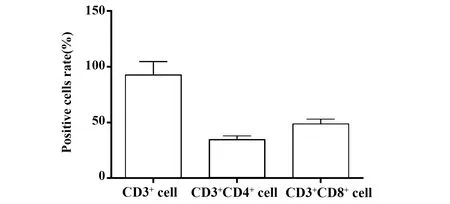
图1 T淋巴细胞亚群检测情况Fig.1 Detection of T lymphocyte subsets
2.2DC细胞鉴定 经过肝癌细胞裂解液处理后的DC,光镜下可见细胞聚集现象,聚集细胞多呈圆形,星形,细胞膜清晰且光滑。大多数细胞失去树突状外观,少部分细胞周围产生多个不等的突起,有的较长,但仍见梭形(图2A)。CD1a和CD83分别为DC特异性和成熟的细胞标志物,流式细胞术检测发现,CD1a+细胞比例约为92%,同时CD1a+CD83+细胞约占83%(图2B)。
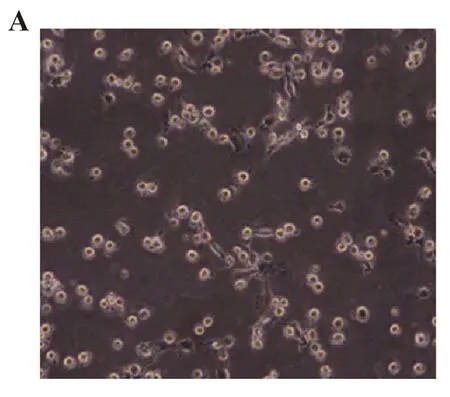
图2 DC鉴别Fig.2 Identification of DCNote: A.Morphology of dendritic cells under inverted microscope;B.DC purity assay.
2.3DC中miR-618表达情况 在DC诱导第0、2、4、6、8天荧光定量PCR检测细胞中miR-618表达,结果发现(图3),在诱导0、2、4 d,miR-618表达无显著变化,但经肝癌细胞多种抗原刺激后,在第4天miR-618表达呈时间依赖性下调(P<0.05)。

图3 DC诱导分化期间miR-618表达情况Fig.3 miR-618 expression during the induction of DCNote:Compared with 0 d,*.P<0.05;compared with 6 d,#.P<0.05.
2.4miR-618靶向下调SOCS1表达 RNA22靶向关系预测网站显示,miR-618与SOCS1存在多个结合碱基位点(图4A),与此同时,双荧光素酶报告系统也验证了它们之间的靶向关系(P<0.05)(图4B)。此外,检测miR-618过表达后,HEK-293T细胞中SOCS1表达情况,结果表明与mimic NC相比,SOCS1蛋白表达显著下调(P<0.05)(图4C、D)。
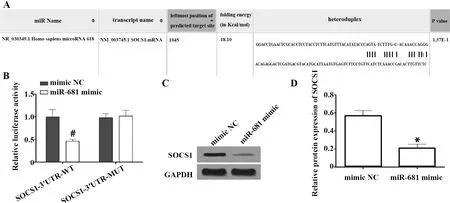
图4 SOCS1与miR-618靶向关系Fig.4 Targeting relationship between SOCS1 and miR-618Note:A.Binding sites between miR-618 and SOCS1;B.Luciferase activity of HEK-293T cells in each group;C.Protein bands of SOCS1;D.Relative expression of SOCS1 protein.Compared with HEK-293T cells co-transfected with mimic NC and SOCS1-3′UTR-WT,#.P<0.05;compared with mimic NC group,*.P<0.05.
2.5miR-618靶向下调SOCS1促进DC活化 流式细胞术检测成熟DC表面抗原CD11c、 HLA-DR、CD86、CD4的表达,结果表明(图5),与各组对照相比,miR-618 mimic组和SOCS1 shRNA组CD11c、HLA-DR和CD86阳性细胞显著增多,但CD4阳性细胞无显著变化。且miR-618 mimic+SOCS1 shRNA组CD11c、HLA-DR、CD86阳性细胞数目增多更为显著(P<0.05)。
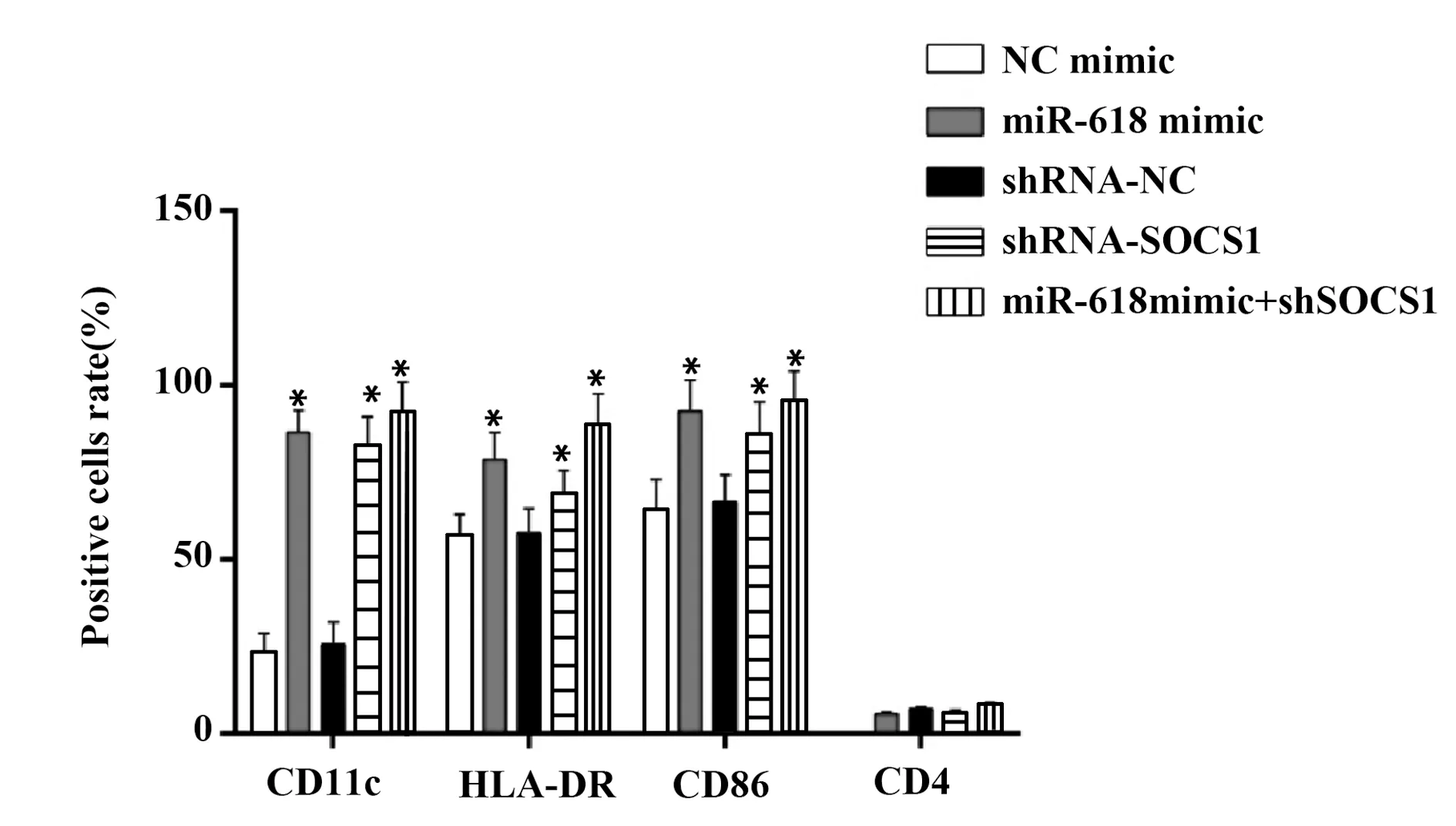
图5 DC表面抗原分子的表达Fig.5 Surface antigens expression on DCNote:Compared with control group of each treatment group,*.P<0.05.
2.6miR-618靶向下调SOCS1促进DC中TNF-γ、IL-6和IFN-α细胞因子分泌 结果表明(图6),与各组对照相比,miR-618过表达组和SOCS1沉默组TNF-γ、IL-6和IFN-α表达显著上调,联合组上述因子上调更加显著(P<0.05)。

图6 各组DC中TNF-γ、IL-6和IFN-α水平Fig.6 Expression levels of TNF-γ,IL-6 and IFN-α in each group of DCNote:Compared with control group of each treatment group,*.P<0.05.
2.7miR-618靶向下调SOCS1促进DC迁移能力 划痕实验检测T细胞诱导下的各组DC的迁移能力,结果显示(图7),与各组对照相比,miR-618过表达组和SOCS1沉默组DC迁移能力显著升高,miR-618 mimic+SOCS1 shRNA组更加显著(P<0.05)。

图7 各组DC迁移率比较Fig.7 Comparison of mobility in each group of DCNote: A.Cell scratch test results in each group at 0 h and 72 h;B.Migration rate in each group.Compared with control group of each treatment group,*.P<0.05.
3 讨论
近年来表明研究DC为启动、调控以及维持免疫应答机制的中心环节,基于DC的基因免疫治疗在多种肿瘤相关的动物实验以及临床试验中也取得了越来越多的成果[11-13]。本研究从DC基因免疫治疗在肝癌中的应用角度出发,探讨了miR-618靶向SOCS1对肝癌患者DC表型以及功能的影响,结果表明miR-618能够靶向抑制SOCS1进而促进肝癌患者DC活化,促进免疫调控功能的提高。
首先本研究组发现,miR-618在DC诱导期间呈时间依赖性下调。前人的研究早就证实miRNA参与了DC的分化,同时与肿瘤的生长和免疫调控有关,将miRNA作为靶点进而增强DC的免疫功能也被越来越多的应用于癌症的免疫治疗中[14,15]。如有研究发现miR-128能够通过靶向p38进而增强DC介导的抗肿瘤免疫[16]。miR-618以往被发现在甲状腺癌以及前列腺癌等癌症中发挥抑癌因子的作用[9,10],但是其在肝癌中是否发挥作用以及具体的作用机制尚未明确。Rossato等[17]在关于系统性硬化的研究中发现,相对于健康对照组,系统性硬化患者浆细胞样DC中miR-618的表达显著减少,miR-618可能是对系统性硬化患者免疫系统稳态进行调节的重要靶点。本研究进一步探究了其在肝癌免疫中的作用并且发现其在DC诱导分化期间的表达变化。
本研究通过生物信息学靶向关系预测网站发现SOCS1与miR-618之间存在靶向结合位点。细胞因子是一种由细胞分泌的,能够对细胞的生长、分化和增殖进行调控的多肽小分子,其主要通过信号转导途径进而实现生物学效应的发挥[18]。SOCS家族为JAK/STAT信号通路的负性调控分子家族,研究证实其能够调控DC以及巨噬细胞的活化,同时对于T细胞的生长和分化过程必不可少[19]。SOCS1是SOCS家族的重要成员,研究证实SOCS1能够对DC活化过程中的IL-6,IL-12、TNF-α以及IFN-γ等细胞因子进行调节[20]。同时,SOCS1缺陷的DC能够诱导更强的抗肿瘤免疫效应。如Guenterberg等[21]在研究中表明,SOCS1缺陷的小鼠具有更高的IFN-α表达水平,其抗肿瘤免疫功能也显著增强。以上研究均表明了SOCS1在DC功能调节以及抗肿瘤免疫中的重要价值。我们在本研究中也同样证实了沉默SOCS1在肝癌免疫调节中的重要价值并且表明SOCS1功能的发挥受其靶向miRNA的调控。流式细胞术检测DC表面抗原发现,过表达miR-618或沉默SOCS1能够促进DC活化且二者联合效果更明显,这也进一步证实了miR-618靶向SOCS1参与了肝癌患者中DC的活化。T细胞在机体的抗肿瘤免疫调节中发挥重要作用[22]。本研究通过ELISA法对各组促进T细胞分化成熟相关因子的表达进行检测发现,过表达miR-618或沉默SOCS1能够显著促进DC中TNF-γ、IL-6和IFN-α等细胞因子的表达。进一步检测各组DC的迁移能力发现miR-618过表达组和SOCS1沉默组DC迁移能力显著增强且联合组效果更显著,说明了miR-618通过对DC进行调节进而参与肝癌免疫。
综上所述,miR-618能够靶向抑制SOCS1的表达进而促进肝癌患者中DC活化,增强其免疫调控能力,miR-618有望成为肝癌免疫治疗中的一个重要靶点。