41例横纹肌肉瘤临床病理特征分析
张晓亮 吴海波
横纹肌肉瘤(rhabdomyosarcoma,RMS)是婴幼儿和青少年常见的一种显示骨骼肌分化的恶性软组织肿瘤[1],其包括胚胎性横纹肌肉瘤(Embryonal Rhabdomyosarcoma,ERMS)、腺泡状横纹肌肉瘤(Alveolar Rhabdomyosarcoma,ARMS)、多形性横纹肌肉瘤(Pleomorphic Rhabdomyosarcoma,PRMS)和梭形细胞(Spindle Cell Rhabdomyosarcoma,SCRMS)/硬化性横纹肌肉瘤(Sclerosing Rhabdomyosarcoma,SRMS)[2]及近期文献[3]报道的上皮样横纹肌肉瘤(Epithelioid Rhabdomyosarcoma,EpRMS)5种亚型,RMS的诊断主要依靠病理组织形态和免疫组化表型确诊。由于RMS亚型较多,病理形态特征多样,易造成误诊、漏诊,目前有关RMS临床病理特征研究的报道较少,为此本文回顾性分析41例RMS的临床病理特征,旨在提高对该肿瘤的认识及诊断水平。
1 资料与方法
1.1 一般资料 回顾性分析2011年1月至2019年4月中国科学技术大学附属第一医院(安徽省立医院)临床确诊的41例RMS患者临床资料,其中男性22例,女性19例,年龄2~79岁。RMS病理亚型[4]包括ERMS、ARMS、PRMS、SCRMS/SRMS及EpRMS 5种类型。纳入标准:所有患者符合2013版世界卫生组织软组织肿瘤学分类诊断标准[5],病理切片均经2位高年资病理医师重新阅读诊断无误。排除临床资料不全、病理切片缺损及免疫组化表达欠满意者。
1.2 方法 统计分析患者的临床特征(年龄、性别、发病部位)及病理特征(病理形态特征和免疫组化表型)。
1.2.1 RMS病理形态特征 所有标本均经10%中性甲醛固定,常规脱水石蜡包埋后进行4 μm厚切片,HE染色,光镜观察肿瘤细胞形态、排列方式、细胞异型性、肿瘤背景。
1.2.2 RMS免疫组化表型 将4 μm厚切片在莱卡全自动免疫组化仪器中行免疫组化EnVision两步法染色。光镜下观察分析免疫组化染色结蛋白(Desmin)、肌调节蛋白(MyoD1)、肌浆蛋白(Myogenin)、神经细胞黏附分子(CD56)。
2 结果
2.1 临床特征 41例RMS患者中,男女发病比例1.16∶1。发病年龄2~79岁,中位年龄30岁,年龄<40岁者25例(60.97%),其中ARMS 发病年龄2~26岁,ERMS 发病年龄14~69岁,PRMS 发病年龄43~73岁,SCRMS/SRMS发病年龄21~72岁,EpRMS 发病年龄为79岁。发病部位:头颈部23例(56.09%),四肢9例(21.95%),腹腔、后腹膜、前列腺各2例(4.88%),附睾1例(2.44%),骨髓中2例(4.88%)。病理亚型:ARMS 20例(48.78%),ERMS 10例(24.39%),PRMS 6例(14.63%),SCRMS/SRMS 4例(9.76%),EpRMS 1例(2.44%)。
2.2 RMS病理形态特征
2.2.1 大体形态 肿瘤直径0.6~23.0 cm,与周围组织界限不清,肿瘤切面灰白色或稍红,呈鱼肉状或胶冻状,可伴有出血、坏死或囊性变。见图1。
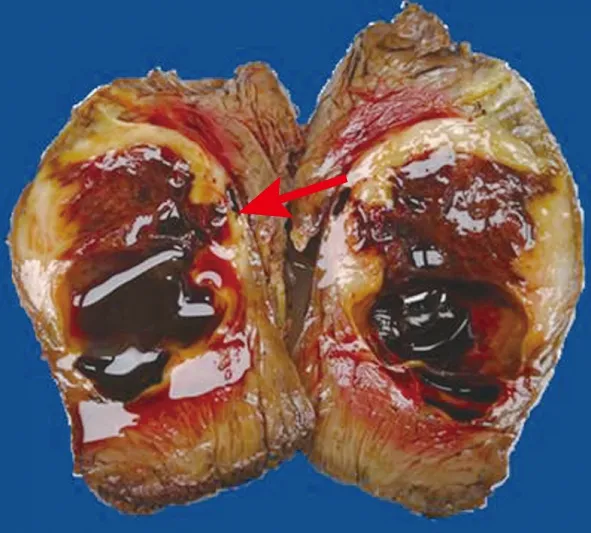
图1 ARMS手术切除标本
2.2.2 组织形态 ERMS由原始间叶小圆细胞和不同分化程度的横纹肌母细胞以不同比例混合组成。原始间叶小圆细胞核圆形或卵圆形、深染,胞浆较少,核分裂象多见;横纹肌母细胞胞浆丰富、嗜酸性,部分可见横纹,核常见偏位。肿瘤细胞常围绕血管生长,分布不均,背景常伴有黏液变性,在小组织活检时,细胞易造成挤压(图2A箭头示)。ARMS的瘤细胞排列成巢片状,瘤细胞巢中央可因发生坏死、脱落而形成特征性腺泡状结构,腺泡之间为纤维血管间隔;肿瘤细胞由原始间叶细胞和少量早期分化的横纹肌母细胞组成(图2B);当ARMS侵及骨髓时,肿瘤细胞分布于骨小梁之间,呈簇状或单个细胞分布,细胞较小,呈母细胞样,胞质嗜酸性颗粒呈簇状(图2C)。PRMS的肿瘤细胞异型性大,形态怪异(图2D箭头示),常显示横纹肌母细胞分化,易见肿瘤性坏死。SCRMS/SRMS由长梭形细胞构成,交错排列,瘤细胞胞浆嗜伊红色,核分裂象不多见(图2E);在SCRMS中常可见SRMS的区域,肿瘤细胞由小的梭形细胞构成,排列成条索样、微小腺管状,埋藏于大片的嗜伊红玻璃样变的背景基质中,部分甚至呈现出黏液样、原始软骨样/骨样基质。EpRMS由成片的上皮样细胞构成,瘤细胞大小、形态较一致,核染色质空泡状,核仁明显,核分裂象易见,易见凝固性坏死(图2F)。

图2 RMS 5种亚型病理组织形态特征
2.3 免疫组化 41例RMS组织切片均采用EnVision法行免疫组化染色,结果 Desmin、MyoD1、Myogenin、CD56在RMS 5种亚型中均有表达(图3)。其中MyoD1在ERMS中多呈弥漫强阳性(图3A),而在ARMS中呈灶性阳性;Myogenin在ERMS中与ARMS相比表达较弱,可呈弱阳性或部分阳性(图3B),甚至阴性。本组41例RMS患者,CD56阳性表达39例,Desmin阳性表达40例。见表1。
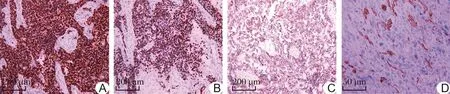
图3 RMS病理亚型免疫组化染色(EnVision法)
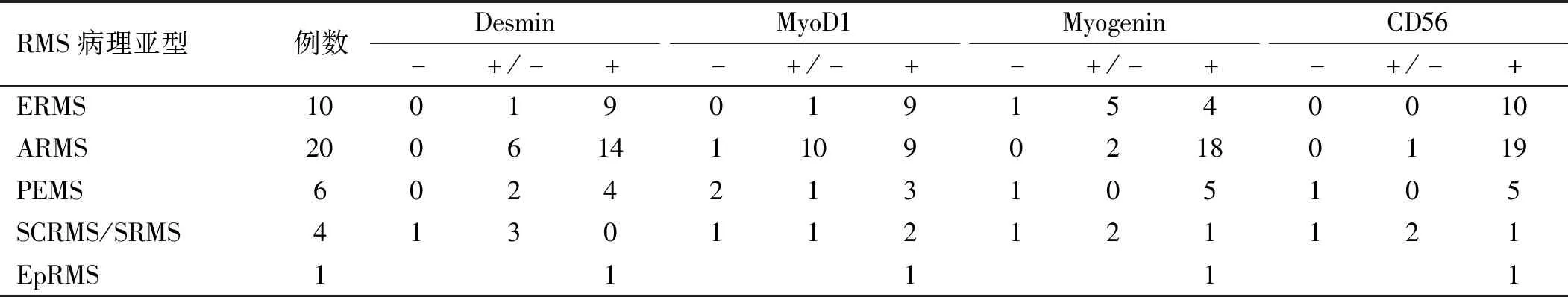
表1 RMS病理亚型免疫组化表达(例)
3 讨论
3.1 RMS的临床病理特征 文献[6-7]报道,RMS是儿童和中青年常见的软组织肿瘤之一,也可发生于老年人,本组41例RMS患者发病年龄2~79岁,此与上述文献报道较为一致。本组病例好发部位依次为头颈部(56.09%)、四肢(21.95%)、腹腔/后腹膜(9.76%)、泌尿生殖系统(7.32%)、骨髓(4.88%),此与Pappo等[8]报道RMS较易发生的部位依次是头颈部、四肢、泌尿生殖道、腹腔/后腹膜较类似。本组RMS病理亚型依次为ARMS(48.78%),ERMS(24.39%),PRMS(14.63%),SCRMS/SRMS(9.76%)及EpRMS(2.44%),主要为ARMS及ERMS,占比73.17%。本组资料的病理组织形态结果显示,ERMS由原始间叶小圆细胞和横纹肌母细胞构成,围绕血管生长,瘤细胞容易受挤压,此可作为ERMS诊断的特征之一;ARMS因其特征性的腺泡状结构,临床易诊断,不易漏诊;PRMS、SCRMS/SRMS及EpRMS因形态学上无明显特异性,难以与其他软组织肿瘤鉴别,需与临床其他指标综合考虑加以鉴别。本组RMS免疫标记表达Desmin、MyoD1、Myogenin及CD56,是其诊断的重要依据;MyoD1在ERMS中比ARMS表达更弥漫,强度更强,而Myogenin却在ARMS中阳性率表达更高,强度更强,以上2种标志物的表达差异可助其病理分型鉴别;本组资料显示CD56和Desmin在RMS中表达的敏感性较高。
3.2 RMS的鉴别诊断 RMS病理亚型繁多,形态多样,需与其他肿瘤相鉴别。ERMS需与一些小圆细胞肿瘤鉴别:①骨外尤文肉瘤,好发于儿童及青少年,一般表达CD99和Fli1,不表达MyoD1和Myogenin,分子上有EWSR1-ETS融合基因。②嗅神经母细胞瘤:多见于鼻腔鼻窦,常见菊形团样结构,表达NSE和Syn,不表达MyoD1和Myogenin,有助于鉴别。③神经内分泌肿瘤:多见于中老年人,表达细胞角蛋白(Cytokeratin,CK)和神经内分泌标志物Syn、CgA、CD56等,不表达肌源性标志物。④促结缔组织增生性小圆细胞肿瘤:多见于腹腔,由不规则的小圆细胞构成,周围有大量的致密结缔组织,瘤细胞显示多向分化,但不表达MyoD1和Myogenin,可资鉴别。ARMS需与一些有腺泡状结构的肿瘤鉴别:①差分化的腺癌,表达上皮性标志物[CK、上皮细胞膜抗原(Epithelial membrane antigen,EMA)],不表达肌源性标志物可资鉴别。②血管肉瘤:表达CD34、CD31、Fil1、E26转录因子相关基因(ETS-related gene,ERG)等血管内皮标志物,而不表达肌源性标志物。③单向性滑膜肉瘤:有时可见由腺样排列的上皮样细胞构成,表达CK、EMA、CD99和Bcl2,不表达肌源性标志物。PRMS需与以下肉瘤相鉴别:①多形性未分化肉瘤,肿瘤内有大量的嗜伊红细胞,胞质空泡状,并常含有泡沫样组织细胞、多核巨细胞、炎细胞,可表达vimentin和平滑肌肌动蛋白(smooth muscle actin,SMA),但不表达MyoD1和Myogenin 。②多形性平滑肌肉瘤:也是由多形性细胞组成,且表达肌源性标志物SMA和Desmin,但不表达MyoD1和Myogenin 。③多形性脂肪肉瘤:常见多形性脂肪母细胞,表达S100、MDM2和CDK4,不表达MyoD1和Myogenin。SCRMS/SRMS需与多种梭形细胞肿瘤相鉴别,其中SRMS因肿瘤细胞会排列成条索样、微小腺管状,还需与ARMS相鉴别,SRMS常伴随SCRMS出现,嗜伊红玻璃样变基质或黏液样、原始软骨样/骨样基质出现,并无ARMS特征性的纤维血管间质和花环状的瘤巨细胞。EpRMS需与恶性黑色素瘤、上皮样肉瘤、硬化性上皮样纤维肉瘤等鉴别。以上肿瘤需综合分析患者发病年龄、部位、临床特征和病理学形态以及免疫组化表型,以利于与RMS的5种亚型区分。
3.3 RMS的侵袭性 RMS易发生浸润和转移,其中ARMS侵袭性最强,约25%~30%的病例发现累及骨髓[9]。ARMS侵及骨髓时,肿瘤细胞会吞噬红细胞并抑制造髓组织[10],有类似白血病样的临床症状[11]。本组41例RMS患者中有2例因首发类似白血病的临床症状而就诊,并在骨髓活检中发现转移性ARMS肿瘤细胞,印证了ARMS是侵袭性较高的一种亚型,容易累及骨髓。故临床在骨髓病理活检中发现形态一致的小圆细胞肿瘤时,若免疫组织化学标志物不支持淋巴造血系统原发肿瘤,而CD56又呈阳性时,在排除转移癌后,要考虑到软组织肿瘤累及骨髓可能,特别是RMS和神经母细胞瘤及相关分化肿瘤(节细胞神经母细胞瘤和节细胞神经瘤)。
3.4 RMS的治疗和预后 RMS治疗主要以手术切除联合放化疗为主[12]。肿瘤位于眼眶或者泌尿生殖道,体积较小,无转移并可完整切除的肿瘤,预后相对较好;成年人,肿瘤位于头颈部、四肢以及腹腔/腹膜后,体积较大,局部有浸润无法完整切除者,且组织学类型为ARMS和PRMS的患者预后较差[13]。
综上所述,RMS是一种好发于儿童和中青年人群的软组织肿瘤,常见于头颈部和四肢,其5种病理亚型组织形态多样,但以ARMS和ERMS最为常见,并共同表达肌源性标志物Desmin、MyoD1、Myogenin及CD56,而MyoD1及Myogenin表达的差异可帮助鉴别诊断ERMS和ARMS,ARMS易累及骨髓引起类白血病样症状。RMS病理诊断与分型需结合临床特征、显微镜下病理形态特征及免疫组化表型,有时还需结合细胞遗传学和分子生物学检测综合判断。
——一对性格习性迥异的兄弟

