乳腺浸润性导管癌合并广泛导管内癌成分患者的临床特征及预后的影响因素分析
罗铦,许思哲,李凡
广安市人民医院烧伤整形甲状腺乳腺外科,四川 广安 638000
浸润性导管癌包括球形细胞癌、单纯癌、硬癌等,起源于乳腺导管上皮[1],且形态各异,无规律性结构特征。保乳手术治疗浸润性导管癌的效果较好,且保乳手术患者术后4年内复发率约为2%~3%。研究发现,广泛导管内癌成分(extensive intraductal components,EIC)是乳腺浸润性导管癌复发的高危因素。本研究探讨乳腺浸润性导管癌合并EIC患者的临床特征及预后的影响因素分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年4月至2015年2月广安市人民医院收治的女性乳腺浸润性导管癌患者。纳入标准:符合世界卫生组织(WHO)制定的乳腺浸润性导管癌的诊断标准[2];经病理检查、磁共振成像(MRI)检查确诊为乳腺浸润性导管癌,且为单侧发病;术后病理证明完全切除病灶,无阳性切缘;无其他恶性肿瘤。排除标准:临床资料缺失或失访;初诊时已出现远处转移;导管原位癌或其他浸润性癌。依据纳入和排除标准,本研究共纳入120例女性乳腺浸润性导管癌患者,年龄27~71岁,平均(46.8±3.2)岁。根据病理结果EIC阳性情况(EIC阳性诊断标准:健康组织中出现散在灶性分布导管原位癌或在浸润性癌邻近组织内出现导管原位癌;乳腺浸润性导管癌内导管原位癌占比超过25%;导管原位癌合并微浸润)分为EIC阳性组(n=62)和EIC阴性组(n=58)。EIC阳性组患者年龄27~71岁,平均(46.7±3.1)岁;EIC阴性组患者年龄27~71岁,平均(46.8±3.3)岁。两组患者年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法和判定标准
所有患者均接受保乳手术治疗,完整切除原发病灶,原发灶切除时,距离肿瘤边缘>5 mm处离断取材组织,切取2~3 mm厚组织做成标本,显微镜下观察切缘受累情况,保证切缘阴性。腋窝淋巴结阳性患者需清扫腋窝淋巴结,前哨淋巴结活检腋窝淋巴结阴性者,需豁免腋窝淋巴结清扫。病理检查评估腋窝淋巴结清扫结果,评估腋窝淋巴结转移状态。En Vision免疫组织化学法检测两组患者的ER、CK5/CK6、HER2、PR阳性表达情况,柠檬酸抗原修复,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素对比染色,评估免疫分型。细胞质或细胞膜着色判定为CK5/CK6阳性。免疫分型判定标准:管腔A型,雌激素受体(estrogen receptor,ER)阳性和(或)孕激素受体(progesterone receptor,PR)阳性,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性;基底细胞样型,PR阴性、ER阴性、HER2阳性,CK5/CK6阳性;无法分型,ER阴性、PR阴性、HER2阴性、CK5/CK6阴性。
1.3 随访方法
按照中国抗癌协会乳腺癌诊治指南与规范和美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南为患者制订靶向治疗、个性化内分泌治疗、化疗、放疗方案,乳腺癌手术当天开始,采用门诊、电话、信访定期复查方式对两组患者进行随访,术后前2年每3个月随访1次,术后第3~4年每半年随访1次,评估两组患者的复发、转移情况及影响因素。
1.4 统计学方法
采用SPSS 18.0软件对所有数据进行统计分析,计数资料以例数和率(%)表示,比较采用χ2检验;乳腺浸润性导管癌患者术后4年内复发影响因素采用Logistic回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1 EIC阳性组和EIC阴性组乳腺浸润性导管癌患者临床特征的比较
EIC阳性组和EIC阴性组乳腺浸润性导管癌患者年龄、化疗情况、HER2表达情况、肿瘤大小、组织学分级、脉管侵犯情况、Ki-67表达、PR表达、ER表达情况比较,差异均无统计学意义(P>0.05);两组乳腺浸润性导管癌患者淋巴结转移情况、CK5/CK6表达情况、免疫分型情况比较,差异均有统计学意义(P<0.05)。(表1)
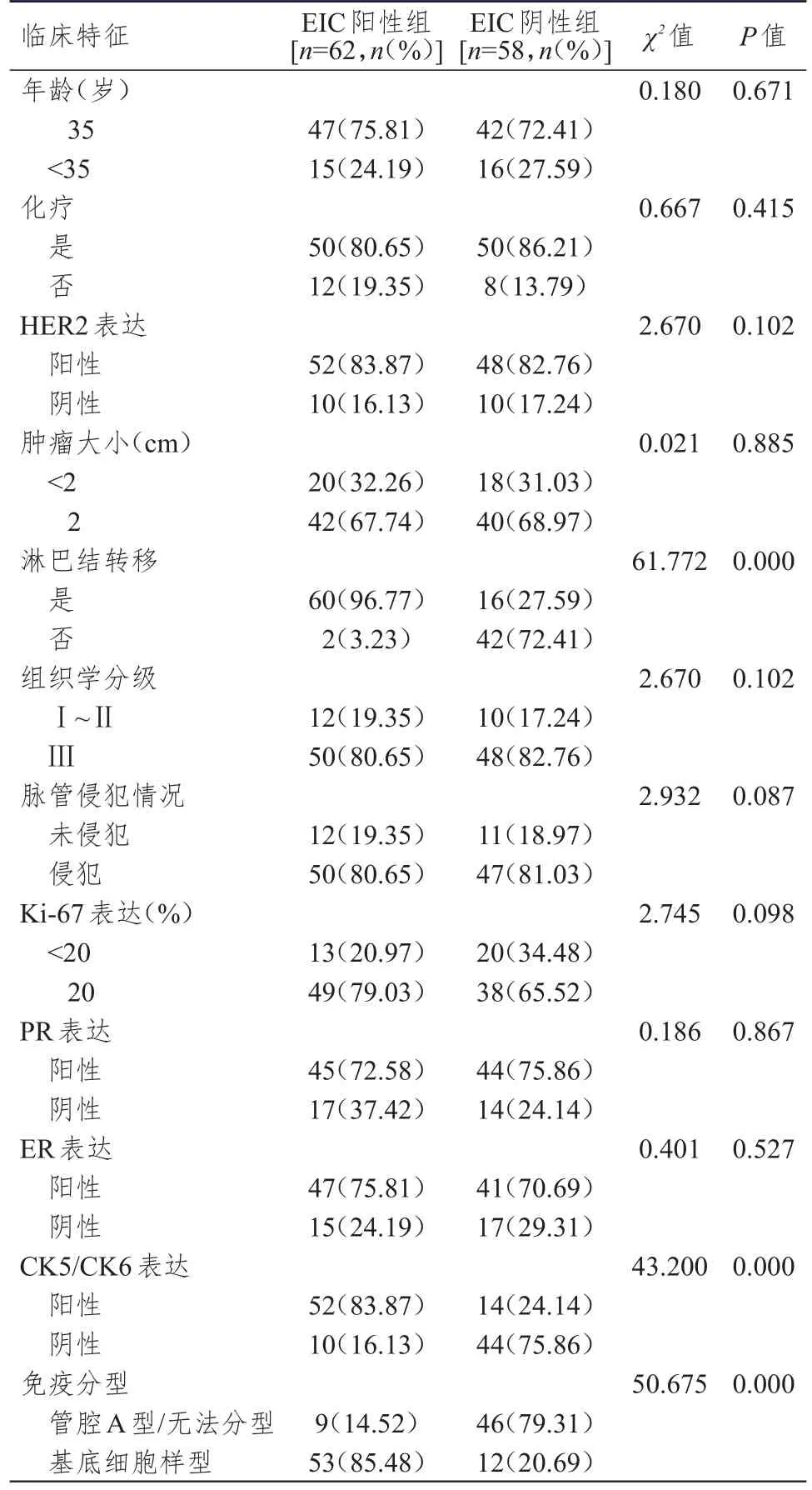
表1 EIC阳性组和EIC阴性组乳腺浸润性导管癌患者临床特征的比较
2.2 乳腺浸润性导管癌患者4年内复发影响因素的单因素分析
120例乳腺浸润性导管癌伴EIC患者中,术后4年内复发26例,复发率为21.67%。单因素分析结果显示,不同年龄、化疗情况、HER2表达情况、肿瘤大小、组织学分级情况、脉管侵犯情况、PR表达和ER表达情况乳腺浸润性导管癌患者术后4年内复发率比较,差异均无统计学意义(P>0.05)。有淋巴结转移、合并EIC、CK5/CK6阳性、免疫分型为基底细胞样型乳腺浸润性导管癌患者术后4年内复发率均高于无淋巴结转移、未合并EIC、CK5/CK6阴性、免疫分型为管腔A型或无法分型患者,差异均有统计学意义(P<0.05)。(表2)
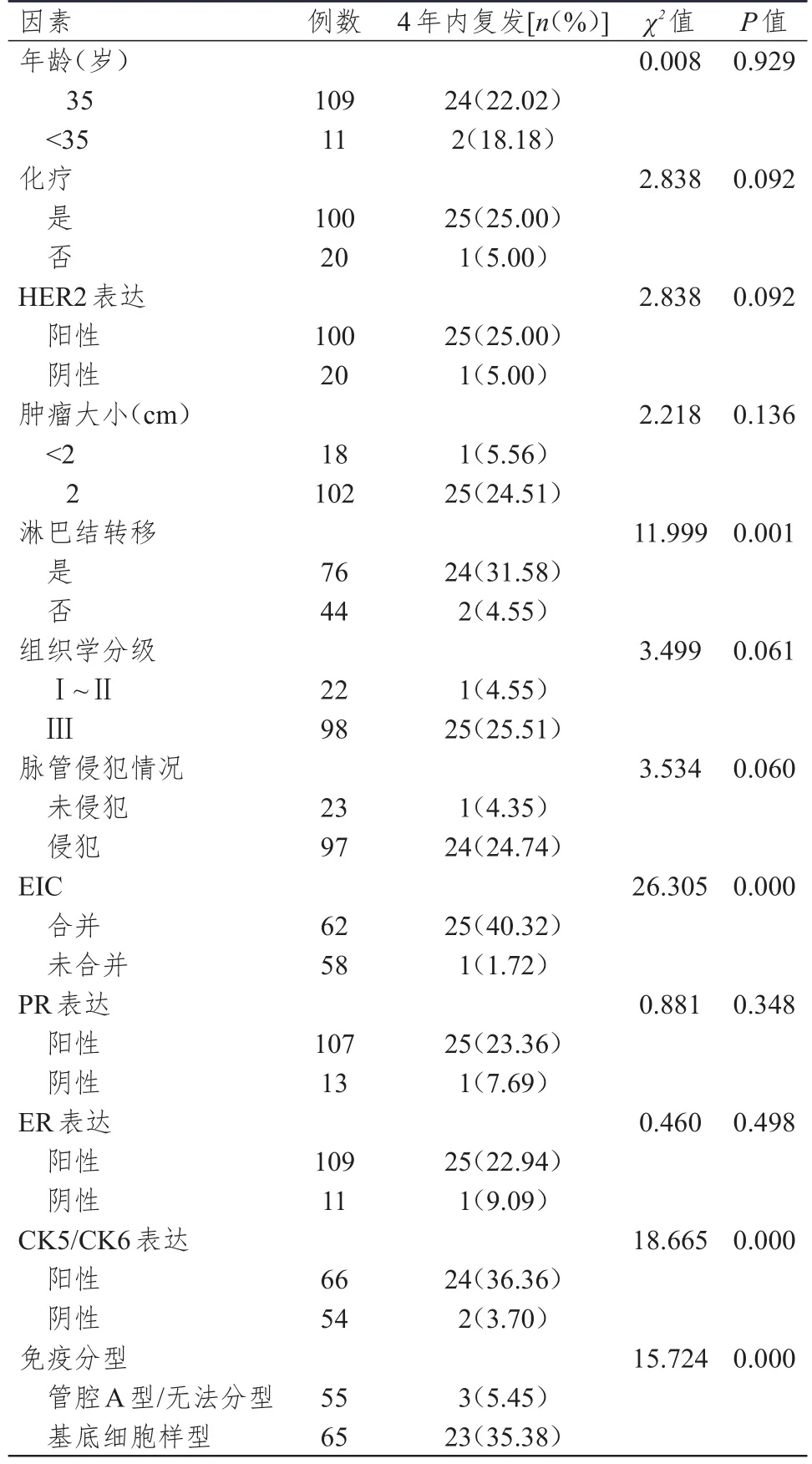
表2 乳腺浸润性导管癌患者术后4年内复发影响因素的单因素分析
2.3 乳腺浸润性导管癌患者术后4年内复发影响因素的多因素分析
将单因素分析中差异有统计学意义的淋巴结转移情况、EIC情况、CK5/CK6表达情况、免疫分型情况作为自变量,术后4年复发情况作为因变量纳入Logistic回归分析,结果显示,淋巴结转移、合并EIC、CK5/CK6表达阳性、免疫分型为基底细胞样型是乳腺浸润性导管癌患者术后4年复发的独立危险因素(P<0.05)。(表3)
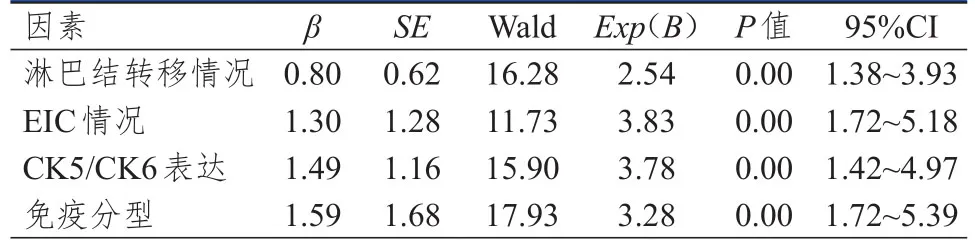
表3 乳腺浸润性导管癌患者术后4年内复发影响因素的Logistic回归分析
3 讨论
乳腺浸润性导管癌肿瘤细胞形态不一,部分病理类型为非特殊性导管癌的亚型,即浸润性导管癌伴EIC浸润[3]。部分肿瘤间质可表现为明显的玻璃样变性、结缔组织较少或纤维母细胞增生[4-5]。血管或导管周围出现局灶性弹性纤维变性,偶尔出现广泛性坏死,也可出现局灶性坏死,而出现淋巴浆细胞浸润的患者较少[6-7]。目前,对于乳腺浸润性导管癌伴EIC患者临床特征和预后的影响因素和已成为医学热点研究课题[8-9]。
研究显示,乳腺癌的进展易受分化程度、淋巴结转移情况等多种因素的影响[10]。本研究探讨乳腺浸润性导管癌伴EIC患者临床特征和预后的影响因素,结果显示,EIC阳性组乳腺浸润性导管癌患者淋巴结转移阳性、CK5/CK6阳性、免疫分型为基底细胞样型均高于乳腺浸润性导管癌EIC阴性组患者,差异均有统计学意义(P<0.05)。120例乳腺浸润性导管癌伴EIC患者,术后4年内复发26例;Logistic回归分析显示,淋巴结转移、合并EIC、CK5/CK6表达阳性、免疫分型为基底细胞样型是乳腺浸润性导管癌患者术后4年复发的独立危险因素(P<0.05),与de Boer等[11]的研究结果一致,乳腺浸润性导管癌伴EIC的发病机制尚未明确,有研究认为可能与染色体1q21~23区域杂合子丢失和出现EIC密切相关[12]。
乳腺浸润性导管癌病理分化程度,一般与临床分期、肿瘤大小有关,且低中分化与高分化的浸润性导管癌淋巴结转移更高、临床分期更差[13]。CK5/CK6是高分子量的基底细胞角蛋白(56 Kd和58 Kd),在正常组织中导管上皮及鳞状上皮的基底细胞和部分鳞状上皮生发层细胞、间皮细胞、肌上皮细胞中呈阳性表达,在腺上皮细胞表达为阴性。基底细胞样乳腺癌的确诊标记物之一,也可用于乳腺UDH与导管上皮异性增生的鉴别。CK5/CK6检测常用于辅助判断浸润性乳腺癌的基底样亚型,CK5/CK6阳性乳腺导管内癌患者的预后较差。本研究结果显示,乳腺浸润性导管癌伴EIC患者的CK5/CK6阳性表达率和复发率均较高。本研究发现,免疫亚型为基底细胞型患者的复发率较高,预后较差,基底细胞型的乳腺癌家族史、年轻患者比例较高,呈现分化较差、组织学分级较高趋势,核分裂象较多,细胞异型性较明显,短期极易转移或复发。表明不同病理分化程度对乳腺浸润性导管预后的影响是不同的。EIC的发生与肿瘤上皮细胞内组织蛋白酶D高表达密切相关,蛋白酶D可促使肿瘤上皮细胞出现高表达,并影响肿瘤生长[14]。EIC不易被相关体格检查和辅助检查发现是乳腺浸润性导管癌伴EIC术后局部复发率较高的因素,术中评估肿瘤病灶范围缺失准确性,肿瘤残留阳性切缘。
综上所述,EIC是导致乳腺浸润性导管癌患者术后复发的高危因素。

