C 型凝集素Dectin-2 对动脉粥样硬化M2 型巨噬细胞活化和凋亡的作用及机制研究
徐玉顺 郑 丹 宋 伟
动脉粥样硬化是一种动脉壁慢性炎性疾病,由免疫细胞的侵入、增殖和激活驱动和维持,巨噬细胞在其中发挥着至关重要的作用[1]。巨噬细胞的活化分为经典激活(M1)型和交替活化(M2)型,M2 型巨噬细胞在人类和小鼠动脉粥样硬化的发展中起预防作用[2]。在白介素4(IL-4)刺激下,巨噬细胞发生M2 型活化,抵抗氧化修饰低密度脂蛋白(ox-LDL)的摄取以及转变为泡沫细胞,进而减小噬斑大小和增强噬斑稳定性[3]。然而M2 型巨噬细胞活化机制尚不明确。树突状细胞相关凝集素-2(Dectin-2)是C 型凝集素受体家族成员,此前研究发现Dectin-2 在固有巨噬细胞(称为Kupffer 细胞)中发挥功能,以介导癌细胞的摄取和清除[4]。研究表明,敲除造血细胞Dectin-2 可以明显降低动脉粥样硬化区域炎症反应,提示Dectin-2 可能参与调控巨噬细胞炎症反应[5]。然而Dectin-2 对M2 型巨噬细胞的具体作用以及调控机制尚不明确,基于此,本研究将探讨Dectin-2 对M2型巨噬细胞活化的影响。
1 实验材料
1.1 动 物 C57BL/6 小鼠(6~8 周龄,雄性,SPF级)购自维亚生物科技(上海)有限公司,使用许可证号:SYXK(沪)2020-0001。
1.2 试 剂 巨噬细胞集落刺激因子(M-CSF)(批号121357)购自赛业生物科技有限公司;胎牛血清(批号12484010)、DMEM/F12(批号11320033)购自赛默飞世尔科技(中国)有限公司;鼠IL-4 因子(批号PRP100498)购自艾美捷科技有限公司;红细胞裂解液(批号155246)购自上海碧云天生物技术有限公司;RNA 逆转录试剂盒(批号QP056)及荧光定量PCR 试剂盒(批号QP076)均购自广州易锦生物技术有限公司;细胞凋亡测定试剂盒(批号23185)购自美国Invitrogen Life Technologies Inc.,Carlsbad,CA;兔单抗Dectin-2(批号ab107572)购自艾博抗(上海)贸易有限公司;兔单抗信号传导及转录激活蛋白6(STAT6)(批号5397)、兔单抗磷酸化信号传导及转录激活蛋白6(p-STAT6)(批号56554)、山羊抗兔Alexa Fluor 488 偶联二抗(批号265121)均购自赛信通(上海)生物试剂有限公司。
1.3 主要仪器 CFX96 Touch 荧光定量PCR 检测系统[BIO-RAD 仪,伯乐生命医学产品(上海)有限公司];FACSAriaTMⅢ流式细胞仪(美国BD 公司);酶标仪SpectraMax 5 [美谷分子仪器(上海)有限公司]HerasafeTM2030i Biological Safety Cabinets 生物安全柜(美国赛默飞公司);Odyssey 双色红外荧光成像系统(美国LI-COR 公司);VE 680 微型垂直电泳设备(上海天能科技有限公司);-80℃超低温冰箱(美国赛默飞公司);CelMate 二氧化碳培养箱(Esco Lifesciences,新加坡艺思高科技有限公司)。
2 实验方法
2.1 骨髓来源巨噬(BMDM)的分离和培养 小鼠采用椎脱臼处死后,利用75%酒精消毒,取小鼠后肢股骨,用1mL 注射器吸取含有1%双抗的DMEM/F12培养基插入股骨处反复冲洗,收集冲洗液离心沉降细胞。加入红细胞裂解液破红后再次离心,750rpm 离心5min,加入含巨噬细胞M-CSF 的DMEM/F12 完全培养基培养,加50U/mL 青霉素和链霉素。7 天后即可得到成熟的骨髓来源巨噬细胞。为敲降巨噬细胞Dectin-2,细胞铺板后转染siDectin-2 或及其对照siNC,6h 后换液,24h 检测敲降效率。对于M2 极化,BMDM 用IL-4(20ng/mL)处理24h 即可检测M2 极化标志物,对照组加入等体积PBS。
2.2 荧光定量PCR 巨噬细胞经上述IL-4 刺激后,利用trizol 法提取RNA,逆转为cDNA。RT-PCR 引物均购自北京擎科新业生物技术有限公司,引物序列如下:GAPDH:上游引物5'-TGGATTTGGACGCATTGGTC-3';下游引物5'-TTTGCACTGGTACGTGTTGAT-3';Dectin-2:上游引物5'-AAGCGGAGCAGAATTTCATCA-3’;下游引物5'-CCATTTGCCATTACCTTGTGGA-3';Arg1:上游引物5'-CTCCAAGCCAAAGTCCTTAGAG-3';下游引物5'-AGGAGCTGTCATTAGGGACATC-3';Ym1:上游引物5'-TCTCTACTCCTCAGAACCGTCAGA-3';下游引物5'-ATGTTTGTCCTTAGGAGGGCTTC-3';FIZZ1:上游引物5'-TACTTGCAACTGCCTGTGCTTACT-3';下游引物5'-TATCAAAGCTGGGTTCTCCACCTC-3'。RT-PCR 程序为:94℃,2min 预变形;98℃,10s 变性;60℃,30s 退火;72℃,30s 延伸;循环数:35 个。
2.3 细胞免疫荧光 巨噬细胞铺板于细胞爬片上,经上述步骤加入IL-4 刺激后,取出经4%PAF 固定,0.5% triton 破膜后,利用5% BSA 封闭液封闭,兔单抗Dectin-2(稀释于5%BSA 中,稀释比1:200)4℃孵育过夜。PBS 洗去一抗后室温孵育山羊抗兔Alexa Fluor 488 偶联二抗(稀释于5%BSA 中,稀释比1:400)1h。利用DAPI 室温孵育10min 标记细胞核。通过Nikon A1R 共聚焦显微镜成像分析。
2.4 流式细胞术检测细胞凋亡 将siDectin-2 或及其对照siNC 转染的巨噬细胞(1.5×105/孔)铺板并与ox-LDL 孵育24h,然后在收集前用胰蛋白酶消化。通过膜联蛋白V/PI 双重染色,通过细胞凋亡测定试剂盒确定凋亡细胞。流式细胞仪分析染色的细胞。
2.5 蛋白免疫印迹(WB)法检测STAT6 磷酸化 将siDectin-2 或及其对照siNC 转染的巨噬细胞(1.5×105/孔)铺板并加入IL-4(20ng/mL)刺激24h。收集细胞蛋白后进行SDS-PAGE 电泳。4℃过夜孵育一抗(抗体稀释比均为1:1000),荧光二抗室温孵育1h。扫膜仪进行显影。
2.6 统计学方法 应用GraphPad Prism 6 软件进行统计分析,计量资料均采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P<0.05 表示差异具有统计学意义。
3 实验结果
3.1 IL-4 刺激促进巨噬细胞Dectin-2 表达 利用IL-4 刺激BMDM 24h 后检测Dectin-2 表达,结果显示,IL-4 在10、20ng/mL 的浓度下均促进Dectin-2 的表达(见表1),同时IL-4(20ng/mL)刺激巨噬细胞后,通过细胞免疫荧光法检测也观察到Dectin-2 在巨噬细胞中表达升高,见插页图1。

图1 IL-4 刺激巨噬细胞Dectin-2 表达上调(免疫荧光X800)
表1 各组Dectin-2 mRNA 相对表达量()
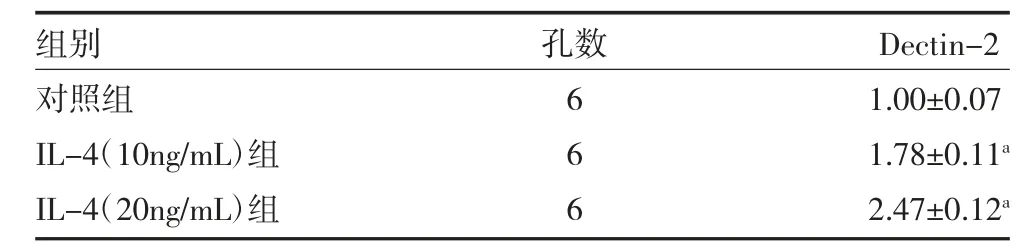
表1 各组Dectin-2 mRNA 相对表达量()
注:对照组为巨噬细胞加入PBS 培养24h;IL-4(10ng/mL)组为巨噬细胞加入10ng/mL IL-4 培养24h;IL-4(20ng/mL)组为巨噬细胞加入20ng/mL IL-4 培养24h;Dectin-2 为树突状细胞相关凝集素-2;IL-4为白介素4;与对照组比较,aP<0.05
3.2 Dectin-2 缺失抑制M2 型巨噬细胞活化 通过siRNA 敲降BMDM 中Dectin-2 后,利用IL-4(20ng/mL)刺激24h 检测巨噬细胞M2 型活化标志物,结果显示,与IL-4+siNC 组相比,IL-4+siDectin-2 组中巨噬细胞M2 型标志物精氨酸酶1(Arg1)、抵抗素样分子α(FIZZ1)、几丁质酶3(Ym1)的表达均明显下调(P<0.05)。见表2。
表2 各组Arg1、FIZZ1、Ym1 mRNA 相对表达量()
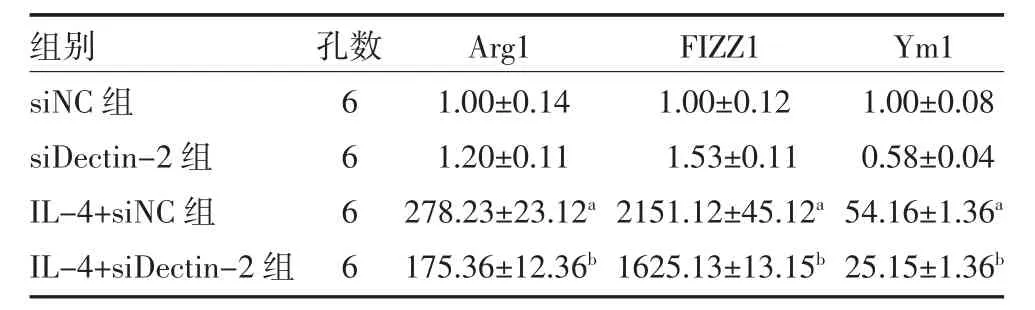
表2 各组Arg1、FIZZ1、Ym1 mRNA 相对表达量()
注:siNC 组为巨噬细胞转染siNC 24h 加入PBS 培养24h;siDectin-2组为巨噬细胞转染siDectin-2 敲降Dectin-2 加入PBS 培养24h;IL-4+siNC 组为巨噬细胞转染siNC 24h 后加入IL-4(20ng/mL)刺激24h;IL-4+siDectin-2 组为巨噬细胞转染siDectin-2 24h 后加入IL-4(20ng/mL)刺激24h;Dectin-2 为树突状细胞相关凝集素-2;Arg1 为精氨酸酶1;FIZZ1 为抵抗素样分子α;Ym1 为几丁质酶3;与siNC 组比较,aP<0.05;与IL-4+siNC 组相比,bP<0.05
3.3 Dectin-2 敲降抑制ox-LDL 诱导的巨噬细胞凋亡 通过siRNA 敲降BMDM 中Dectin-2 后,加入ox-LDL 促进巨噬细胞吞脂质并诱导凋亡。流式细胞术检测结果发现,Dectin-2 敲降可以明显抑制ox-LDL 诱导的巨噬细胞凋亡的产生。ox-LDL+siNC 组凋亡率为(30.04±0.62)%;ox-LDL+siDectin-2 组凋亡率为(12.36±1.07)%。见插页图2。

图2 Dectin-2 敲降抑制ox-LDL 诱导的巨噬细胞凋亡
3.4 Dectin-2 敲降抑制STAT6 磷酸化 通过siRNA敲降BMDM 中Dectin-2 后,利用IL-4(20ng/mL)分别刺激0、5、30、60min 检测巨噬细胞STAT6 磷酸化水平,WB 检测结果显示,Dectin-2 敲降明显抑制STAT6 磷酸化激活。见图3。
4 讨论
动脉粥样硬化过程中巨噬细胞的极化及其对脂质的吞噬是导致泡沫细胞形成及动脉斑块不稳定的重要原因之一。巨噬细胞进入斑块后发生极化,分泌多种分泌促炎和抗炎的细胞因子,从而影响斑块稳定性[6]。前期研究表明,增加斑块组织中M2 型抗炎巨噬细胞的比例,可以减轻斑块局部的炎性反应,增加斑块组织的稳定性,而M1 型促炎巨噬细胞则大量存在于不稳定斑块中[7]。因此解析动粥斑块中巨噬细胞极化的分子调控机制成为进一步了解动粥斑块稳定的关键。
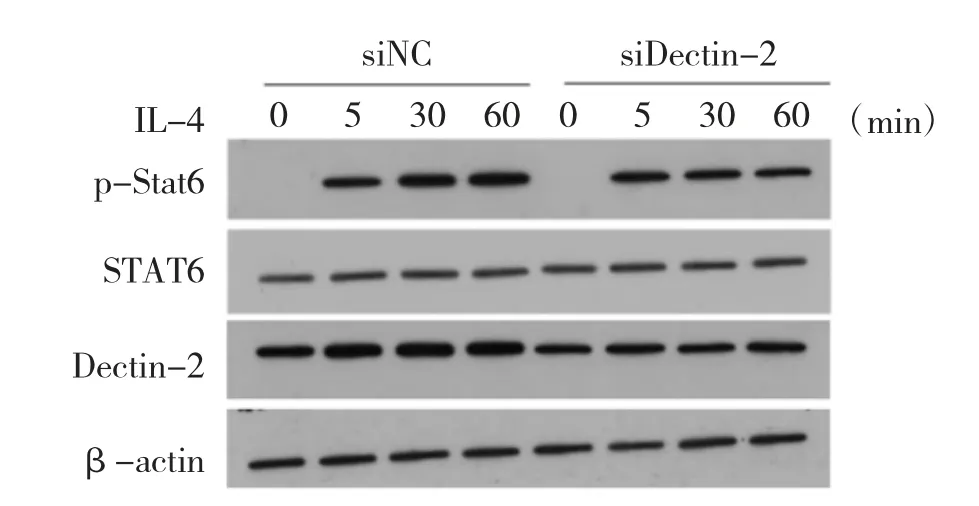
图3 Dectin-2 敲降抑制STAT6 磷酸化
Thiem 等[5]将造血细胞中Dectin-2 敲除后,通过骨髓置换手术到Ldlr-/-转基因小鼠中,再通过高脂喂养构建动脉粥样硬化模型,结果发现,Dectin-2 缺失后明显减轻动粥病灶部位炎症反应,Ly6C 阳性的单核细胞明显减少,同时LPS 刺激后,小鼠腹膜巨噬细胞明显减少,提示Dectin-2 在调控巨噬细胞功能过程可能发挥着重要的作用。本研究结果显示,巨噬细胞Dectin-2 在IL-4 诱导后表达明显升高,敲降Dectin-2 抑制巨噬细胞M2 型活化。同时利用诱导动脉粥样硬化发生的关键脂质分子ox-LDL 刺激巨噬细胞发现,Dectin-2 敲降明显抑制细胞凋亡。因此我们推测Dectin-2 在动脉粥样硬化过程起到保护作用。
目前关于Dectin-2 调控其他免疫细胞的研究发现,Dectin-2 通过其跨膜结构域与包含基于免疫受体酪氨酸的活化基序(ITAM)的信号传导衔接子FcRγ 结合,并可以招募B 细胞内Syk,从而激活其下游CARD9/NF-κB 途径[5,8-11]。而M2 型巨噬细胞的活化主要依赖于STAT6 的磷酸化激活[12-13],因此本研究探究了Dectin-2 对STAT6 活化的影响,结果发现,Dectin-2 敲降能够明显抑制IL-4 刺激诱导的STAT6 磷酸化,从而抑制M2 极化标志物的表达。
综上所述,本研究发现在炎症因子IL-4 刺激下,巨噬细胞Dectin-2 表达上调,敲降Dectin-2 可以抑制IL-4 诱导的M2 型巨噬细胞活化以及ox-LDL 诱导的细胞凋亡,其作用机制可能是通过调控STAT6 磷酸化水平。

