半纤维素的微生物酶促降解及其在酿造中的应用
杨阳,王松涛,许正宏,2,,史劲松
1(江南大学 生物工程学院,江苏 无锡,214122)2(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122)3(江南大学 药学院,江苏 无锡,214122)4(国家固态酿造工程技术研究中心,四川 泸州,646000)
半纤维素是组成植物细胞壁的结构性多糖,常与纤维素和木质素紧密交联形成木质纤维素。木质纤维素是最主要的植物生物质,产生自光合作用中的CO2固定过程,半纤维素在其中的占比约为20%~40%[1]。受到基因型和环境条件的影响,半纤维素的组成可能在植物组织、植物物种甚至同一植物物种之间存在差异[2]。相较于木质纤维素中含量最多、组成相对简单的纤维素,半纤维素由不同类型单糖组成,结构上更为复杂,拥有着巨大的开发潜力。在自然界中,微生物是半纤维素降解中最主要的执行者,相关酶系由于具备高效、专一、多样化等特点,已被直接或间接应用于食品、饲料、材料、医药、化工等领域。为推进此类资源的有效利用,本文基于近年来国内外的相关研究成果,对半纤维素分子结构特点,微生物源半纤维素酶的分类、作用特征及开发手段,半纤维素酶在酿造中的应用等方面的研究进展进行了综述。
1 半纤维素
半纤维素作为自然界中第二大丰富的多糖,分子链较短且多带支链,以无定形非晶质体形式存在,是一群复合聚糖的总称,主要包括由戊糖(D-木糖、L-阿拉伯糖)和(或)己糖(D-葡萄糖、D-甘露糖、D-半乳糖)等单糖基团混合组成的异质多聚体(以木糖含量最为丰富),侧链还可能含少量糖醛酸(D-葡糖醛酸、4-O-甲基-D-葡糖醛酸和D-半乳糖醛酸)基团[3]。半纤维素通常通过共价键和氢键相互连接,也可能通过芳香酯键与木质素紧密结合,并通过氢键与纤维素结合,从而形成纤维素与木质素之间的键合。
“半纤维素”最早由德国科学家SCHULTZE于1891年提出,其定义被后来的研究者不断完善修订,被广为接受的是“能溶于稀碱溶液(无论冷热)但不溶于水,且易被热的无机酸稀溶液水解成单糖或糖酸的植物组织成分”[4],不过之后的研究发现仍有某些半纤维素类别与此定义相悖。出于习惯以及为了方便理解,大多数研究人员目前仍在使用“半纤维素”指代一类主要由葡萄糖、甘露糖或木糖以β-(1→4)糖苷键相连组成骨架结构、既非纤维素也非果胶的植物细胞壁多糖。有学者提议,半纤维素应在广义基础上进一步发展,用以指代呈现出图1-a所示主链结构的多糖,基于此,半乳聚糖、阿拉伯聚糖、阿拉伯半乳聚糖、愈创葡聚糖等多糖虽然有时被归入半纤维素大类,但由于并不具备β-(1→4)主链结构,因此不应被纳入半纤维素的狭义范畴[5]。根据化学组成和结构的不同,半纤维素主要分为甘露聚糖、木聚糖、木葡聚糖以及β-(1→3, 1→4)-葡聚糖。
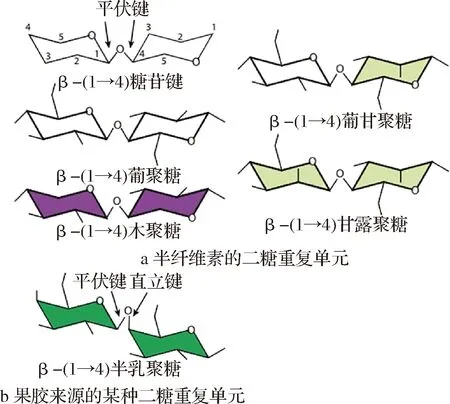
a-半纤维素中的二糖重复结构(主链C1和C4位糖苷键为平伏键型);b-半乳聚糖中的二糖重复结构(主链 C4位糖苷键为直立键型,不应被归入半纤维素)图1 半纤维素和某种非半纤维素的二糖结构区别示意图[5]Fig.1 Difference between the disaccharide structures of hemicelluloses and a non-hemicellulose
1.1 甘露聚糖
甘露聚糖在自然界中广泛分布,这类多糖的主链或全部由吡喃甘露糖基构成[如线性甘露聚糖和半乳甘露聚糖(galactomannans,GaM)],或由吡喃甘露糖基和吡喃葡萄糖基以非重复模式构成[如葡甘露聚糖(glucomannans,GM)和半乳葡甘露聚糖(galactoglucomannans,GGM)]。其中,线性甘露聚糖较少见,主要存在于象牙棕榈果等种子的胚乳中,是一种主链上仅含甘露糖残基的同质多糖[6]。
1.1.1 GaM
GaM主链由甘露糖基通过β-(1→4)糖苷键连接而成,并在C6位不同程度地存在着半乳糖残基的分支。这是一类中性的甘露聚糖,常见于豆科等植物种子的贮藏组织细胞壁中[7-8]。GaM与线性甘露聚糖的区别在于前者侧链上半乳糖基的含量不低于5%[6]。较高的侧链半乳糖基含量会提高多糖的水溶性,这主要归结于半乳糖取代基团对主链固态堆积作用的抑制及其通过 (1→6)键的内旋转对液态构象熵值的提升[9]。
1.1.2 GM
GM是软木次生细胞壁中主要的半纤维素组分,在硬木、草本、禾本等植物中分布较少,分支很少且主要发生在甘露糖残基C6位上[10]。甘/葡基数量比值因来源不同而有较大差异[6]。食品领域常用的GM主要提取自魔芋块茎,其甘/葡基数量比为1.6∶1,且平均每19个主链单糖残基中有1个被乙酰化[10]。
1.1.3 GGM
在GM的骨架结构基础上,GGM中的半乳糖基通过α-(1→6)糖苷键与主链上的甘露糖或葡萄糖单元相连,部分侧链糖基上发生乙酰化。半乳糖基团在多糖中的占比是否达到15%是区分GM和GGM的标准[10]。随着半乳糖支链的增加,相应GGM水溶性也随之增高[11]。
1.2 木聚糖
木聚糖是自然界中最丰富的半纤维素,以吡喃木糖基团通过β-(1→4)糖苷键相连,木糖的C2和C3位置可能发生葡糖醛酸、4-O-甲基-葡糖醛酸、阿拉伯糖、乙酸等基团的取代[12-13]。除此之外,酚酸(主要是阿魏酸和对香豆酸)可以通过酯键与阿拉伯糖残基连接,这种结构可能有利于木聚糖与其他半纤维素或木质素的交联[13-14]。侧链类型与木聚糖的来源相关,根据侧链的不同,木聚糖主要分为4类:同质木聚糖(homoxylans,HX)、阿拉伯木聚糖(arabinoxylans,AX)、葡糖醛酸木聚糖(glucuronoxylans,GX)和阿拉伯糖基葡糖醛酸木聚糖(arabinoglucuronoxylans,AGX)。
1.2.1 HX
HX中仅含有木糖残基,这类木聚糖仅被发现于海草和海藻中,以直链或支链形式存在。木糖残基间通过β-(1→4)或β-(1→3)糖苷键连接,同一原料中也可能混合存在2种连接方式[7]。
1.2.2 AX
AX是谷物淀粉质胚乳(面粉)和外层(麸皮)中的代表半纤维素,存在于小麦、大米、玉米、高粱等许多主流作物中,也见于单子叶植物黑麦草、竹笋和安哥拉草等种子[8,10]。阿拉伯糖是AX最主要的侧链基团,与主链中木糖残基C2位以α-(1→2)键和(或)C3位以α-(1→3)键相连。阿拉伯糖取代基的分布会影响AX的可溶性和可提取性,例如从黑麦和小麦麦粉中所提取的水溶性AX即具有较高的阿拉伯糖含量和取代度,其阿拉伯糖和木糖糖基数量比值可达到1∶(1.1~2)[非水溶性AX中这一比值为1∶(3~5)][15]。此外,酚酸可通过酯键与阿拉伯糖的C5位连接,且这类基团易发生氧化偶联反应从而形成交联网络,进而影响面粉的烘焙性质[16]。
1.2.3 GX
绝大多数的GX拥有单独的4-O-甲基-D-葡糖醛酸残基与主链木糖基团的C2位相连,被称为4-O-甲基-D-葡糖醛酸木聚糖(4-O-methyl-D-glucuronoxylan,MGX),不过其中的糖醛酸侧链也可能存在4-O-无甲基化的形式[8]。MGX是硬木中最主要的半纤维素,占生物质干重的15%~30%[17],其中的木糖与4-O-甲基-D-葡糖醛酸残基的平均数量比值约10∶1[8]。在自然状态下,MGX木聚糖主链中木糖残基在C2位和(或)C3位部分乙酰化,不同植物中MGX的乙酰化程度有所不同。乙酰基团与木聚糖的溶解性有关,其与糖单元之间的连接键在必要的碱性提取条件下易断,从而造成木聚糖在制备中的部分或完全不溶。
1.2.4 AGX
在GX结构的基础上,AGX另有L-阿拉伯糖主要通过α-(1→3)糖苷键连接在主链上的小部分木糖残基上。AGX是禾谷类植物木质化支撑组织细胞壁中的主要半纤维素,可从剑麻、玉米穗轴和小麦秸秆中分离得到[15]。在AGX的典型结构中,L-阿拉伯糖、D-葡糖醛酸(4-O-甲基-D-葡糖醛酸)、D-木糖的数量比约为1∶2∶8[18]。阿魏酸可通过酯键与这类多糖中的阿拉伯糖残基连接,这种连接方式在禾本植物细胞壁中广泛存在。与乙酰基团相似的是,酯结合态的阿魏酸基团在AGX的碱提取过程中也容易丢失。
1.3 木葡聚糖
木葡聚糖(xyloglucans,XG)是高等植物初生细胞壁的主要成分,在双子叶植物中约占初生细胞壁的20%~25%,在针叶木中约占10%,在禾本植物中占比略低(2%~5%)[10]。XG骨架与纤维素类似,由吡喃葡萄糖单元通过β-(1→4)糖苷键连接而成,部分主链基团C6位被吡喃木糖残基取代。在双子叶植物来源的XG中,约60%~75%的葡萄糖单元连有木糖取代基,而在禾本植物来源的XG中,这一比例为30%~40%[15]。XG与纤维素间存在的氢键对该半纤维素组分的提取有负面影响,此外XG也会以共价键进一步固定在细胞壁中,例如与果胶羧基基团间形成酯键,或通过阿魏酸酯与果胶和其他半纤维素成分相连。
1.4 β-(1→3, 1→4)-葡聚糖
β-(1→3, 1→4)-葡聚糖[β-(1→3, 1→4)-glucans,BG]是由葡萄糖单元通过β-(1→3)和β-(1→4)糖苷键连接而成的线性多糖,主要存在于禾本科作物中,在问荆属和苔类中也曾有报道。燕麦、大麦等谷物中的BG含量通常为3%~5%,而在某些品系的燕麦中,BG含量多达6%~7%,甚至某些大麦籽粒的BG含量可达到12%及以上。这类多糖主要分布于谷物的亚糊粉层和胚乳细胞壁,在细胞生长过程中逐渐与纤维素微纤丝交联[19]。
2 半纤维素酶系
鉴于半纤维素复杂的结构特点,要将不同的半纤维素利用酶法降解成寡糖、双糖、单糖等更简单的组分,通常需要多种具有相对专一性的生物酶联合作用,这类生物酶均可归属为半纤维素酶系。根据底物特异性准则,国际生物化学和分子生物学联盟将大部分半纤维素降解酶归为O-糖苷水解酶(编号EC 3.2.1.x);这类酶在碳水化合物活性酶(carbohydrate-active enzyme,CAZy)数据库的分类体系中被归入糖苷水解酶(glycoside hydrolases,GH),并可按氨基酸序列同源性和疏水聚类作进一步家族分类[20]。
2.1 半纤维素酶系的分类
根据作用位点和方式的不同,半纤维素酶可被分为解聚型和脱支型2大类。解聚酶是水解半纤维素主链上连接键的一类半纤维素酶,包含内切酶(从主链中间随机水解)和外切酶(作用于主链末端)2大类;脱支酶也被称作辅助酶,可按侧链作用位点进行划分,其中,水解糖苷键的成员在CAZy数据库中被归入GH家族,作用于糖基和乙酸或阿魏酸等侧链基团之间酯键的成员被归入碳水化合物酯酶(carbohydrate esterase,CE)家族[1]。
由于许多半纤维素要么是不溶的,要么与不溶的纤维素基质紧密结合,因此大多数半纤维素酶都是模块化蛋白,即除了催化域(catalytic domain,CD)之外还存在其他的功能模块,其中以碳水化合物结合模块(carbohydrate binding module,CBM)和Dockerin(对接模块)最为关键。CBM是不具备催化作用的蛋白,与CD附着或关联在一起,其功能为保证酶和不溶性底物的顺利结合[21],对酶的催化效率有重要影响[22]。而Dockerin则是通过组装模块——Cohesin(粘连模块)/Dockerin之间的相互作用,将CD绑定至微生物细胞表面或纤维小体上,使得酶能更好地发挥功能[23]。
基于CAZy数据库(http://www.cazy.org/)中更新的信息,半纤维素酶系主要成员及其作用对象、水解产物以及相关的CAZy酶家族总结见表1。
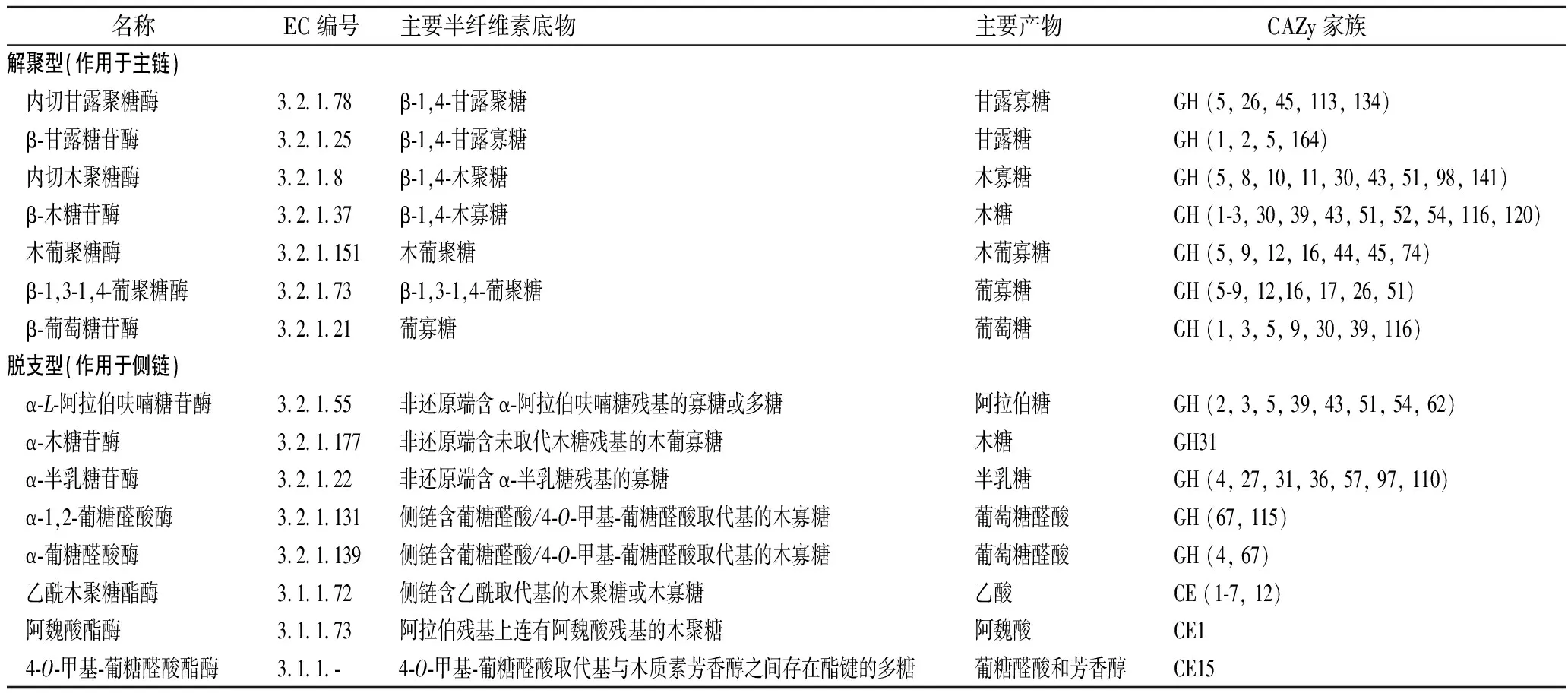
表1 半纤维素酶系主要成员信息Table 1 The hemicellulolytic enzymes
2.2 半纤维素酶系的多样性与协同效应
基于多样的半纤维素结构,微生物源半纤维素酶的多样性和半纤维素酶系不同成员之间的协同作用,是有效降解半纤维素的前提和基础,与其他相关多糖的降解同样密不可分。
2.2.1 环境微生物中的半纤维素酶多样性
从来源上看,半纤维素酶可由真菌、细菌、原生动物和藻类等许多生物产生[1],相关微生物可在自然界中自由存在,在海水、泥土、堆肥、温泉以及生态酿造等各式生境中均有发现,也可作为高等动物消化道的一部分出现[24]。这类酶可能在细胞内作用,也可能被分泌到周围环境中。相应地,微生物在降解植物细胞壁中主要表现出3种生理策略:(1)某些好氧真菌,如木霉(Trichoderma)和曲霉(Aspergillus)能分泌多种类、高浓度、具有协同效应的半纤维素酶,将多糖降解为单糖或双糖,并可被周围的微生物所利用;(2)某些好氧细菌,如芽孢杆菌(Bacillus)和纤维弧菌(Cellvibrio)分泌中等数量的多糖主链降解酶,降解生成相对较大的寡糖产物,这些寡糖的完全降解需要与细胞结合或胞内酶继续作用,这种模式的优势在于其胞外降解产物不容易被无半纤维素降解活性的竞争物种所利用;(3)某些厌氧细菌,如梭菌(Clostridia)进化出了独特的酶复合体——纤维小体,可绑定整合多种纤维素/半纤维素裂解酶共同发挥作用[23]。
2.2.2 单一微生物中的半纤维素酶多样性
在单独的微生物中,也常见半纤维素酶多样性的报道,草酸青霉(PenicilliumoxalicumGZ-2)能分泌8种木聚糖酶(分属GH10、GH11、GH30家族),并对应6种木聚糖酶基因型[25]。嗜热细菌Herbinixhemicellulosilytica至少能够分泌6种新型嗜热木聚糖(分属GH10、GH11家族)、3种阿拉伯呋喃糖苷酶(分属GH43、GH51家族)以及1种属于GH43家族的β-木糖苷酶[26]。许多微生物常常产生多于1种的木聚糖酶,其多样性可能源于不同的基因产物,也可能由翻译后修饰的差异造成,包括糖基化作用、酶蛋白部分水解或两者兼有[24]。在太瑞斯梭孢壳霉(ThielaviaterrestrisNRRL 8126)的培养过滤液中可检测到5种不同的甘露聚糖降解酶,具体包括4种内切甘露聚糖酶和1种β-甘露糖苷酶,均存在着不同程度(6%~36%)的糖基化[27]。糖基化是半纤维素酶最重要的翻译后修饰方式,不仅与蛋白功能的多样性和稳定性相关,有时还可以直接影响酶活力。
2.2.3 半纤维素酶之间的协同效应
酶的协同作用是指多种酶在共同作用时,其水解效率高于不同酶单独作用时的效率总和。通过研究不同酶之间的协同作用,可以在酶总量不变或减少的情况下显著提高半纤维素的转化效率,从而降低酶的成本[28]。在木聚糖水解过程中,作用于主链的内切木聚糖酶、β-木糖苷酶和切断侧链的α-阿拉伯呋喃糖苷酶、乙酰木聚糖酯酶之间便存在着协同效应[29]。乙酰木聚糖酯酶释放乙酸这一过程,减少了内切木聚糖酶攻击木聚糖主链中的障碍,反过来内切木聚糖酶催化释放的短链乙酰化多糖,是更加适合酯化酶发挥活性的优选底物。在甘露聚糖酶和甘露糖苷酶[30],半乳糖苷酶和甘露聚糖酶[31]等半纤维素酶系成员之间,也可见关于协同效应的报道。基于对位阻效应的有效认识,已有研究将脱支酶作为预处理方式,用在添加主链解聚酶之前,这种方式可能有效但也有一些例外的情况,比如有的解聚酶发挥活性需以侧链取代基的存在为前提[32]。此外,半纤维素酶系不同成员之间也存在着某种反馈调节机制,如对AspergillusnigerAn76的研究发现,木聚糖主链降解酶的高效作用优先受到可溶性糖的诱导,且木寡糖比木糖更能触发木糖代谢中的关键转录因子XlnR,进而增强酶的活性、缩短产酶时间,拥有取代基团的木寡糖还能够负责提升脱支酶、特定转运体以及戊糖分解代谢中的关键还原酶和脱氢酶的丰度[33]。
2.2.4 半纤维素酶与纤维素酶、淀粉酶之间的协同效应
木质纤维素降解的复杂性源于植物细胞壁的特殊三维结构,其交联网络限制了酶的功能发挥,而这种限制可利用协同效应在一定程度上予以克服。有研究表明,即使底物中的木聚糖含量非常低,额外添加的木聚糖酶也可有效促进纤维素酶的作用效果。SELIG等[34]使用纤维二糖水解酶分别联合内切木聚糖酶、阿魏酸酯酶、乙酰木聚糖酯酶共同作用于玉米秸秆纤维素,与单独作用相比,纤维二糖释放率提升了13%~84%。ZHU等[35]研究表明,当联合菌剂EMSD5酶粗提物(以半纤维素降解酶为主)与商业纤维素酶制剂以3∶1比例处理玉米秸秆时,两者之间达到最大协同系数1.96,纤维素和木聚糖转化率分别为38.3%和18.7%。这一效应同样体现在发酵食品研究中,LIU等[36]以淀粉酶、木聚糖酶、纤维素酶的单酶和混酶组合分别处理面团,混酶处理后的面团伸展性相较单酶处理最高可提升42%,且3种酶在面团流变学特性上表现出明显的协同效应。
3 半纤维素酶系在酿造行业的研究与应用
在酿造工业(由复杂成分构成并有较高风味要求的发酵食品的生产)中,考虑到丰富的酿造原料中均存在一定数量且种类多样的半纤维素组分,同时基于对应酶系可能赋予酿造过程的积极意义,研究者们纷纷尝试对半纤维素酶在多类酿造过程中的适用性展开研究。
3.1 在葡萄酒生产中的用途
使用半纤维素酶、纤维素酶、果胶酶等混酶制剂有助于葡萄皮的软化以及颜色的提取,有利于酒体的澄清和过滤,可改善葡萄酒质量和稳定性,并且它们还能减少使某些来源于果皮但会影响酒体风味的化合物,并提高令人愉悦的芳香物质含量。SPAGNA等[36]将黑曲霉培养液中初步纯化到的α-阿拉伯呋喃糖苷酶和β-葡萄糖苷酶用于酿造加工,能够明显提升葡萄酒中芳樟醇、香茅醇、橙花醇和香叶醇的浓度,进而影响产品品质。MICHLMAYR等[38]将酒酒球菌(Oenococcusoeni)、黑曲霉等来源的α-阿拉伯呋喃糖苷酶和β-葡萄糖苷酶用于红白两种葡萄酒的处理,可从天然底物中额外释放大量的单萜类风味化合物,这意味着这2种酶的参与和风味前体水解之间的关系甚密。LOUW等[39]将外源葡聚糖酶和木聚糖酶基因一起转入商用酵母SaccharomycescerevisiaeVIN13的基因组中,并将这株重组酵母运用于不同品种的葡萄发酵中,相较各自对照组,赤霞珠实验组发酵后非榨取酒液体积显著增加,黑皮诺实验组葡萄酒感官评鉴结果明显更佳。此外,葡萄糖醛酸是葡萄糖的氧化产物之一,因具解毒作用而受到广泛关注,在葡萄酒中的含量约为48~132 mg/L。由于葡萄糖醛酸是半纤维素侧链上常见的基团,可推测相关半纤维素酶的使用,可能会直接改变产品中的糖醛酸含量从而影响其保健功能。
3.2 在啤酒生产中的用途
啤酒原料中的AX和BG含量较高、亲水性较强,易造成生产中麦汁过滤困难、酒液浑浊、啤酒滤膜堵塞等问题,利用商品化木聚糖酶与β-葡聚糖酶间的协同效应,有利于麦汁黏度的降低以及麦汁收率、酒液澄清度的提高,从而降低酿酒成本,这也是啤酒生产中较为常规的操作。ZHAO等[40]从嗜热真菌Achaetomiumsp. Xz-8中克隆得到2种属于GH11家族的木聚糖酶基因,当重组酶XynC83与商用β-葡聚糖酶联合作用时,麦浆的过滤速度提升了34.76%,效果明显优于将速度提升20.71%的商品用啤酒过滤酶Ultraflo。此外,LI等[41]从黑曲霉中克隆得到一段假定为α-阿拉伯呋喃糖苷酶(属于GH43家族)的基因,对应的重组酶在人工底物(pNPαAraf)和天然底物(麦芽水溶性AX)的降解中都表现出了较高的水解活性,将其加入处于糖化初期的原料,可使得大麦麦汁的过滤速度提高12.8%。WU等[42]将重组阿魏酸酯酶用于麦芽糖化过程,结果表明,1.04 U/50 g处理组的麦汁过滤速度较未处理组提升14.5%,浊度和黏度分别下降22%和6.9%,阿魏酸含量上升约5倍。阿魏酸作为一种强抗氧剂,可有效减少啤酒中的羰基化合物,因此阿魏酸酯酶可从多方面对麦芽和啤酒成品的品质产生正面的影响。而作为小麦啤酒重要风味物质4-乙烯基愈创木酚的前体,阿魏酸基团的有效释放也能够通过酶促反应的联动使之含量提升,有利于小麦啤酒典型风味的呈现[43]。
3.3 在清酒生产中的用途
日本清酒以大米为原料,包覆在大米淀粉质外的细胞壁在一定程度上限制了曲霉内源糖化酶对原料的充分降解,从而造成了发酵后酒糟余量仍然较高的问题。SATO等[44]利用色谱层析从AspergillusoryzaeRIB128固培物中纯化出3种木聚糖酶并运用至清酒发酵,其中XynG2实验组出酒率相较对照组提高4.4%,剩余酒糟量降低4.6%,而XynG2之所以能够如预期一样有效作用于细胞壁,主要是由于相较其他同工酶,它能够在较高浓度的乙醇环境中更长时间地保留自身活性。此外,ITO等[45]研究发现,原料大米本身的阿魏酸含量与清酒酒曲中的阿魏酸酯酶活力相关,从而与原料中木聚糖侧链上阿魏酸基团的释放过程关联,最终影响清酒酒醅中的酚酸水平。虽然阿魏酸具备较突出的药理功能,但它同时会赋予清酒一定的酸、苦、涩感,这导致前人更倾向于在清酒生产中对其含量水平予以控制,而阿魏酸乙酯口感温和、苦甜适中,有助于遮盖阿魏酸的味道。同一团队的后续研究发现,用于清酒制曲的米曲霉产木聚糖酶水平很低,而当米曲中提取的混酶与木霉来源的混合酶制剂Amano T联合作用时,清酒酒醅中阿魏酸及阿魏酸乙酯的含量明显升高,纯化实验表明在其中起到关键作用的正是2种木聚糖酶(分属GH10、GH11家族)[46]。由此可看出,ITO团队基于半纤维素酶系,从多角度对以上2种物质含量水平的控制提供了理论指导。
3.4 在白酒生产中的用途
就人工接种的酒精生产而言,木聚糖酶在玉米的酒精发酵中具有较为明显的优势。徐曼等[47]研究表明,在酿酒酵母接种前向玉米带渣发酵培养基中添加170 U/g木聚糖酶发酵48 h后,实验组的酒精度可达到对照组的1.3倍,残糖含量是后者的7.4%。
就自然发酵的白酒生产而言,半纤维素酶在其中同样表现出较强的应用潜力。大曲酒是白酒中一类具有代表性的高品质产品,禾本科谷物高粱、小麦分别是大曲酒酿制中糟醅、大曲的主要原料,均具有较高的AX和BG含量[48]。在大曲酒酿造中,大曲为发酵、产香提供了丰富的微生物菌群、风味(及前体)物质以及生物酶类。李旭辉等[49]将高活力的木聚糖酶与大曲一并添加至原料糟酒醅中,能明显提升出酒率和酒体乳酸乙酯的含量,降低醛类物质和杂醇油含量。大曲作为富集天然菌群(以真菌为主)的养料载体,具有较强的半纤维素酶累积优势和潜力,相关菌群在特定的自然底物和发酵条件下被诱导产生多元半纤维素酶,可能对原料利用率的提高、特定酒体风味的形成、白酒发酵过程稳定性的提升等方面带来重要影响。鉴于白酒酿造原料中半纤维素来源和组成较为复杂,要充分了解其中半纤维素酶的诱导生成、协同降解以及多种产物的释放情况,需借助基因组学、转录组学、蛋白组学、代谢组学等多组学的技术支持,并结合大数据处理和关联作图等技术,才能更加系统、深入地分析半纤维素及其降解酶与酿造环境及酿造微生物之间的复杂关系,值得研究者们作进一步探究。
3.5 在酱油生产中的用途
美拉德反应是在酱醅(醪)发酵中一种重要的非酶褐变,发生在羰基化合物(还原糖类)和氨基化合物(氨基酸)之间,反应产物能赋予产品独特的风味和色泽,并拥有一定的抗氧化活性,最终生成的主要大分子物质被称作类黑精或拟黑素。在美拉德反应中,反应速度为戊糖>己醛糖>己酮糖>双糖,且戊糖褐变速度高出己糖数倍。HASHIMOTO等[50]就曾通过实验观察到,酱曲来源的AspergillusnigerHL15产生的木聚糖酶、β-木糖苷酶、α-阿拉伯呋喃糖苷酶能够在质量分数为15% NaCl溶液下高效协同降解AX,并释放出多糖中的阿拉伯糖、木糖,据此他展望到,半纤维素酶系执行的AX水解与酱油发酵中发生的美拉德反应效果之间存在着相关性,这一关联为工业上类黑精合成及酱油色的优化提供了合适的切入角度。
综上所述,在食品酿造中,充分利用并发挥半纤维素酶的多样性与协同作用特性,能够对原料生物质进行更加有效地利用、提升产品转化率,以及提高酿造产品的口感风味和营养价值,而在多菌种的生态酿造过程中,半纤维素酶系与酿造的过程控制密不可分,与其中菌、酶多样性的形成相辅相成,这种多样性组成了生态酿造产品独特风味形成的前提和基础。
4 展望
半纤维素降解酶作为一类在食品工业得到有效应用的生物催化剂,在酿造领域中的研究开展得还较少,主要集中在产品的降粘、增香、提高原料利用率等方面。为实现行业良性的可持续发展,有必要在半纤维素高效酶降解的基础之上,更加系统性、针对性地开展半纤维素酶的应用研究。为实现半纤维素的高效酶降解,一是要积极借助现代微生物筛选新技术,如通过培养组学技术获得酶系良好、性能优异的功能菌株(以真菌和嗜热细菌为主),进而对制曲或酿造的过程进行强化;二是对一些能够大幅度改善发酵过程、提升产品风味营养的半纤维素酶,可通过现代化的表达技术,在发酵过程中进行添加,这其中也可能涉及到编码基因的改造使其针对性地满足各种应用要求,如提高酶的活性、底物特异性、对映选择性、立体专一性、稳定性以及对有毒试剂和极端条件的耐受性等;三是利用特异的惰性材料对半纤维素酶进行固定化,进行仿生发酵以改善或强化酿造过程。相关的研究成果可组成微生物源半纤维素酶资源得以进一步开发利用的基础,使其能够在酿造领域最大限度地发挥作用,优化产品质量,控制生产成本。

