永川毛霉型豆豉传统发酵过程中微生物群落结构及动态演替规律
李薇,罗沈斌,邱泽瑞,赖登磊,王洪伟,索化夷*
1(西南大学 食品科学学院,重庆,400715)2(重庆市永川豆豉食品有限公司,重庆,402160)
豆豉是我国历史悠久的传统发酵调味食品,古称“幽菽”,迄今已有两千多年历史。豆豉是以黄豆或黑豆为原料,经过微生物发酵制成,可分为米曲霉型、毛霉型、根霉型、脉孢菌型及细菌型五大类,其中尤以毛霉型豆豉最富特色[1]。永川豆豉是毛霉型豆豉的典型代表,不仅具有“疏松散籽、油亮发黑、味美化渣、清香回甜”的品质特点[2],还富含大豆多肽、豆豉纤溶酶、类黑精及大豆异黄酮等功能性物质,对于延缓衰老、预防疾病、降血压及抗氧化等方面具有积极作用[3-5]。
豆豉独特的感官风味以及营养价值与参与发酵的微生物的群落结构密切相关[6]。然而传统的分离培养鉴定法仅能获得少数优势菌群,不能真实反映发酵样品中微生物的区系变化规律,存在较大局限性。高通量测序技术,尤其是16S rRNA多样性测序及宏基因组测序技术的快速发展与应用为复杂发酵食品中微生物区系的研究提供了有效解决方案[7-8]。目前,已有研究者利用高通量测序技术对江西特色发酵豆豉微生物的群落特征[9]、湖南浏阳豆豉不同工艺阶段的微生物多样性[10]、湖北当阳[11]及云南地区豆豉[12]中细菌群类进行评价,为挖掘豆豉中微生物资源,提高豆豉产品品质与食用安全性提供了理论支撑。然而,利用高通量测序技术再现毛霉型豆豉中菌群环境的研究还未见报道。
永川毛霉型豆豉采用传统自然制曲的开放式发酵方式,且后发酵时间长达1年,这使得其发酵过程中有更为复杂的微生物参与作用。曾涛等[13]曾采用聚合酶链反应变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术研究了永川毛霉型豆豉发酵过程中细菌群落的变化,但该方法存在通量低、PCR扩增的偏好性而精确度不高等局限,只能检测出发酵微生物的部分种类,无法更深入地研究。因此,本研究采用高通量测序技术探索制曲阶段及后发酵阶段永川毛霉型豆豉中菌落的动态变化,揭示发酵过程中的核心微生物,从而为探寻豆豉中微生物群落与品质、功能性组分之间的关系,创新豆豉的生产工艺,开发毛霉型豆豉复合发酵剂奠定理论基础。
1 材料与方法
1.1 材料与试剂
永川毛霉型豆豉,重庆市永川豆豉食品有限公司;无水乙醇(分析纯),成都市科龙化工试剂厂;土壤基因组提取试剂盒,Omega公司;PCR反应系列试剂,北京天根生物技术有限公司。
1.2 仪器与设备
手提式不锈钢灭菌锅(YX280A),上海三申医疗器械有限公司;电子天平(FA2004),上海舜宇恒平仪器有限公司;单人双面净化工作台(SW-CJ-2F),苏净集团苏州安泰空气技术有限公司;台式高速冷冻离心机(5810R),Eppendorf公司。
1.3 豆豉采集
永川毛霉型豆豉:制作工艺包括选料、浸泡[豆∶水= 1∶20(g∶mL),20~25 ℃,2 h]、蒸煮(121 ℃,1 h)、冷却、自然制曲(将摊料以“中间薄,四周厚”的方式入室摊放在簸箕或晒席上,按质量分数为1%添加种曲,10~20 d)、下架、拌料(食盐、醪糟、白酒的质量分数分别为18%、3%和3%)、常温后熟发酵1年。本研究的样品分为制曲阶段的曲料及不同后发酵阶段的豆豉,分别在制曲第1、3、6和8天于重庆市永川豆豉食品有限公司曲室中取样(编号:f1、f3、f6和f8),并采集制曲结束、经拌料后的豆豉曲胚在实验室进行后熟发酵,分别于发酵第25、53、75、165和225天取样(编号:d5、d6、d7、d8和d9),每个阶段采集3个样品。取样后存于-80 ℃冰箱备用。
1.4 永川毛霉型豆豉发酵过程中宏基因组DNA提取及PCR扩增
称取5~6 g永川毛霉型豆豉样品,放入研钵中,加入占研钵体积2/3的液氮,立即在液氮中充分研磨豆豉,直至细粉状(一般加入液氮8~9次),称取50~100 mg豆豉样品,按照土壤基因组提取试剂盒说明书进行后续操作,得到豆豉宏基因组DNA,保存于-20 ℃冰箱里。
以338F-806R作为引物对细菌16S rRNA V3~V4区序列进行扩增,以ITS1F-2043R为引物对真菌ITS区域进行扩增。将PCR扩增产物切胶回收,根据PCR产物检测方法进行检测定量。将处理好的PCR扩增产物送到上海美吉生物医药科技有限公司,采用Illumina Miseq测序。
1.5 数据与图谱分析
高通量测序数据采用美吉云计算平台分析,根据97%相似性采用UCLUST软件进行OTU聚类。
2 结果与分析
2.1 真菌群落结构分析
永川豆豉不同发酵阶段中真菌在门水平的高通量相对丰度分布如图1-a所示,子囊菌门(Ascomycota)和接合菌门(Zygomycota)是优势真菌门(相对丰度>1%),平均相对丰度分别为84.52%及14.96%。制曲第1天(f1)担子菌门(Basidiomycota)也属于优势类群,但在制曲第2天(f2)其相对丰度便下降至低于1%。接合菌门在制曲阶段相对丰度在10.03%~54.00%,在后发酵初期(d5)下降至0.07%,后随着发酵的进行相对丰度缓步上升。作为突出优势门的子囊菌门在制曲阶段相对丰度先降低后增加,在后发酵阶段相对丰度维持在98%以上。
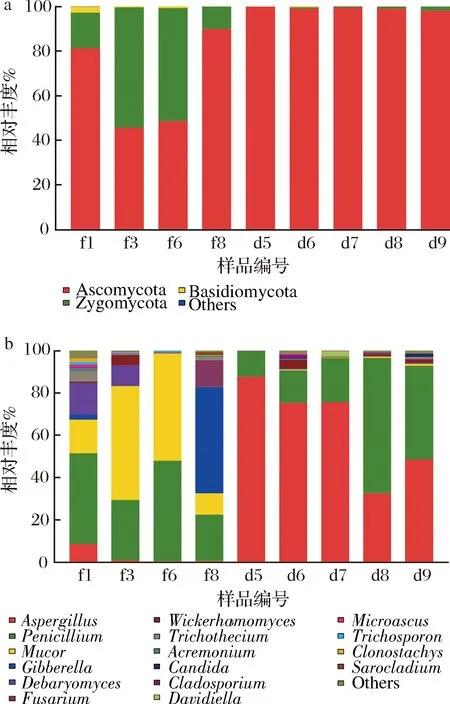
a-门水平;b-属水平图1 永川毛霉型豆豉不同发酵阶段真菌在门水平和属水平的高通量相对丰度Fig.1 Relative abundance of fungi at phylum level and genus level in different fermentation stages of Mucor-type Yongchuan Douchi注:Others为平均相对丰度<1%的门或属
真菌在属水平的高通量相对丰度分布如图1-b所示,共测得17属真菌。制曲第1天(f1)真菌种类丰富,随着制曲发酵进行到第6天(f6),真菌种类多样性逐渐降低,在制曲第8天(f8)又迅速增多。制曲阶段主要由毛霉属(Mucor)占主导作用,尤其在制曲第3天(f3)和第6天(f6),其相对丰度分别达到53.98%和50.87%。而在制曲第8天,镰孢霉属(Fusarium)(12.78%)和赤霉属(Gibberella)(50.35%)的相对丰度迅速增加。进入后发酵阶段后真菌多样性快速降低。曲霉属(Aspergillus)在后发酵阶段成为优势菌群(后发酵阶段平均相对丰度为63.79%),而青霉属(Penicillium)在整个发酵过程都具有较大相对丰度(12.19%~64.17%),与毛霉属、赤霉属以及曲霉属等霉菌形成竞争关系,抢占其他真菌的生存空间。此外,整个发酵过程中还检测到德巴利氏酵母属(Debaryomyces)、威克汉姆酵母属(Wickerhamomyces)和假丝酵母属(Candida)等酵母菌属。从后发酵53 d(d6)开始,部分耐盐耐高渗透压的真菌适应环境后开始缓慢生长,群落多样性增加,渐趋稳定。
2.2 细菌群落结构分析
细菌在门水平的高通量相对丰度分布如图2-a所示,厚壁菌门(Firmicutes)和变形菌门 (Proteobacteria)是优势细菌门(相对丰度> 1%),平均相对丰度分别为48.76%和47.37%。厚壁菌门在制曲前6 d相对丰度>70%,随着制曲阶段进入尾声(f8),其相对丰度降低至21.42%。进入后发酵阶段后,多数细菌群落多样性降低,但厚壁菌门相对丰度却迅速增至53.23%。变形菌门在后发酵阶段的平均相对丰度为65.38%,为突出优势门,与厚壁菌门形成竞争关系。样本f8中细菌群落结构最丰富,蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)的相对丰度在f8中快速增至11.36%、6.95%和1.59%,但进入后发酵期后迅速降低。
由细菌在属水平的高通量相对丰度分布(图2-b)可知,永川豆豉在不同发酵阶段细菌的种类和相对丰度有较大差异,且相比真菌而言,细菌的种类更加丰富,与通过PCR-DGGE技术检测得到的结果基本一致[13]。细菌种类随着制曲的进行逐渐丰富,在f8中达到最大。检测到的25属主要的细菌大多集中在f8。制曲阶段魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)及乳酸杆菌属(Lactobacillus)均为优势菌属,然而进入后发酵阶段后,上述3种菌属几乎停止生长。芽孢杆菌属(Bacillus)、代尔夫特菌属(Delftia)以及根瘤菌属(Rhizobium)为后发酵阶段相对丰度较大的细菌属。值得注意的是,芽孢杆菌属、根瘤菌属、葡萄球菌属(Staphylococcus)、棒状杆菌属(Corynebacterium)以及乳球菌属(Lactococcus)在竞争最激烈的制曲后期及环境发生变化的后发酵初期相对丰度还出现增长趋势,与赵文鹏等[14]研究结果一致。
2.3 真菌聚类分析及主成分分析
非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)假设在进化过程中所有核苷酸/氨基酸都有相同的变异率,即存在着一个分子钟,通过树枝的长短可以观察样本间的进化距离[15],直观显示不同豆豉样本中微生物进化上的相似性及差异性[16]。
真菌区系UPGMA聚类分析如图3-a所示,永川毛霉型豆豉制曲阶段和后发酵阶段真菌群落结构遗传距离较远,而处在同一发酵阶段的遗传距离相对较近。相邻时间样本的真菌群落结构差异性不大,但制曲阶段(或后发酵阶段)前期和后期有明显差异,说明真菌群落结构的变化是一个逐步演替的过程。真菌区系主成分分析(图3-b)中,PC1和PC2两轴的累积方差解释率达到了89.27%,能够较好区分不同发酵阶段样本中真菌群落结构的差异性。制曲阶段样本点较为分散,而后发酵阶段样本点则相对集中,表明制曲阶段真菌群落结构的差异较后发酵阶段更大。结合群落结构分析结果来看,f3与f6真菌区系较为接近,与优势菌属毛霉属和青霉属的相对丰度差异较小有关;与f3和f6相比,f1中毛霉属相对丰度较低,德巴利氏酵母属、曲霉属和单端孢霉属(Trichothecium)等菌属的相对丰度较高,而f8中赤霉属和镰孢霉属取代了青霉属和毛霉属的绝对优势地位,从而造成制曲阶段真菌群落结构差异。
2.4 细菌聚类分析及主成分分析
由细菌区系UPGMA聚类分析(图4-a)可知,不同发酵阶段细菌区系结构存在较大差异,并且制曲阶段样本间的遗传距离远大于后发酵阶段,说明制曲阶段细菌群落演替更为激烈。图4-b为细菌群落结构主成分分析图。PC1与PC2能够分析整个发酵样品80.23%的OTU,具有较高解释率。制曲阶段样本点非常分散,而后发酵阶段样本点则相对集中,与聚类分析结果相佐证。参照群落结构分析结果,引起制曲阶段细菌区系发生较大变化的菌属有魏斯氏菌属、明串珠菌属、乳酸杆菌属、库特氏菌属(Kurthia)及葡萄球菌属,在制曲阶段呈现显著的或增或减的趋势,并且随着制曲发酵的进行,细菌多样性增加,其中短波单胞菌属(Brevundimonas)和1种未分类的鞘脂杆菌科菌属(Sphingobacteriaceae)分别在f6和f8开始出现。后发酵阶段代尔夫特菌属、根瘤菌属以及芽孢杆菌属的相对丰度在d5与d9、d6与d7中相似,而在d8中处于上述2组的中等水平,并且d8中乳球菌属的相对丰度达到整个发酵过程中的最大值,因此d8与其他后发酵阶段样本存在较大差异。
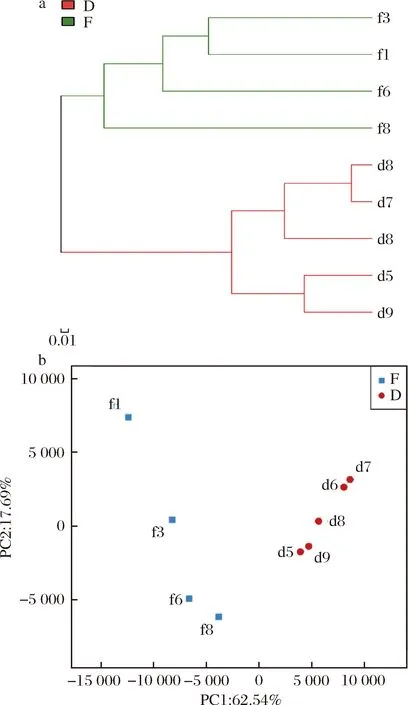
a-聚类分析;b-主成分分析图4 永川毛霉型豆豉不同发酵阶段细菌微生物区系UPGMA聚类分析和主成分分析Fig.4 UPGMA cluster analysis and principal component analysis of bacterial microflora in different fermentation stages of Mucor-type Yongchuan Douchi
2.5 真菌分子进化分析
微生物系统发生进化树作为1种分子生物学分析工具,可通过树枝状结构表示生物间的发育进化关系,树枝长短则对应进化距离[17]。通常采用某一分类水平上序列间碱基的差异构建进化树[18],本研究选择在属分类水平上进行构建。图5为永川豆豉发酵过程中真菌的发育进化树分析图。共检测出57属真菌微生物,其中根霉属(Rhizopus)、曲霉属、毛霉属、青霉属和接合酵母属(Engagementyeast)等17属不同真菌的相对丰度较大,且亲缘关系较近。毛霉属发育进化最简单,在系统发育树中独占一枝,是永川豆豉整个发酵阶段,尤其是制曲阶段的核心菌群。曲霉属和青霉属的亲缘性接近,两者进化程度基本一致。节担菌属(Wallemia)伴随着毛霉属的进化发育进行生长,但在整个发酵过程中几乎检测不到节担菌属的存在,可能与真菌及其代谢产物的抑制有关。
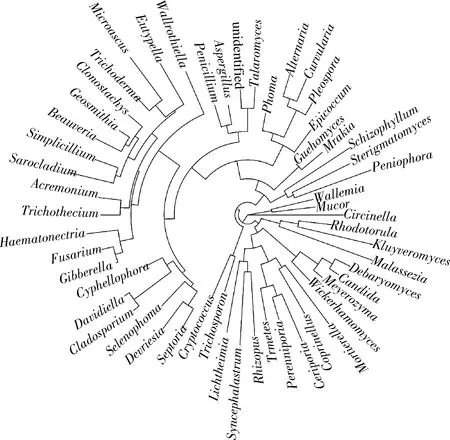
图5 永川毛霉型豆豉不同发酵阶段真菌属水平系统发育进化树Fig.5 Phylogenetic tree of fungi at genus level in different fermentation stages of Mucor-type Yongchuan Douchi
2.6 细菌分子进化分析
永川毛霉型豆豉在发酵过程中各个发酵阶段的细菌微生物十分丰富(图6),达到105个属别,相对丰度>5%的达到25属,包括魏斯氏菌属、乳酸杆菌属、芽孢杆菌属、明串珠菌属、乳球菌属、根瘤菌属、棒状杆菌属、库特氏菌属和克吕沃尔氏菌属(Kluyvera)等。其中,魏斯氏菌属和明串珠菌属的亲缘性接近,链球菌属(Steptococcus)和乳球菌属的亲缘性接近,且其他分支上的主要细菌属别的差异性亦较小,进化程度相似。因此,对这25属主要细菌进行分析,可真实再现永川豆豉在发酵过程中细菌进化的亲缘性程度。
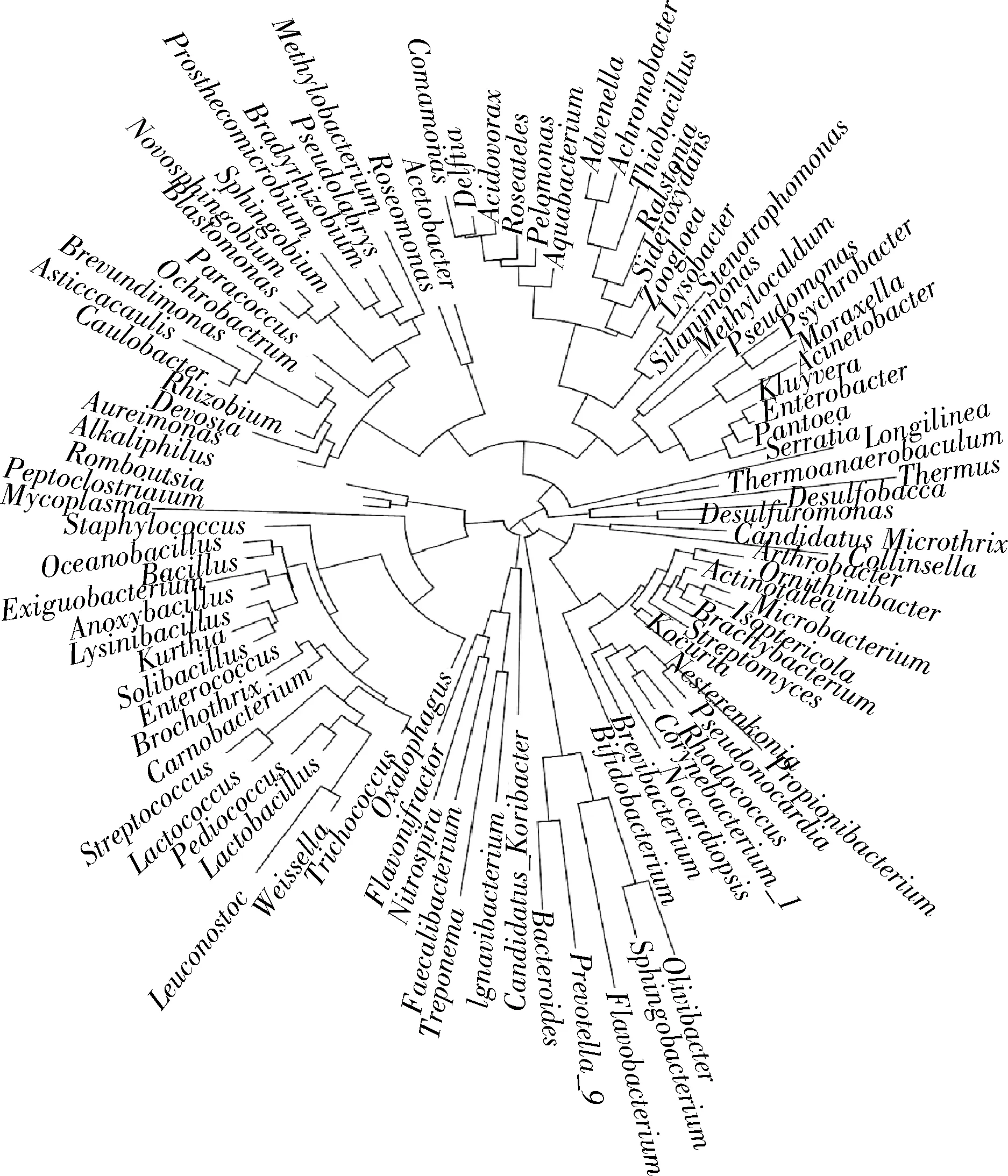
图6 永川毛霉型豆豉不同发酵阶段细菌属水平系统发育进化树Fig.6 Phylogenetic tree of bacteria at genus level in different fermentation stages of Mucor-type Yongchuan Douchi
2.7 真菌线性判别分析
图7为永川毛霉型豆豉不同发酵阶段真菌进化分枝图。由图7可知,在永川毛霉型豆豉制曲阶段和后发酵时期具有重要性的真菌有较大差别。根霉属、曲霉属、毛霉属、单端孢霉属、节担菌属等是在制曲期间起主要作用的真菌。在后发酵期间,子囊菌门(Ascomycota)、散囊菌目(Eurotiales)、威克汉姆酵母属、毛霉属等真菌起主导作用。由此可见,在后发酵阶段产生重要作用的真菌较制曲阶段少,主要原因在于拌料工艺形成的后发酵环境不适于大多数真菌代谢生长,使得以毛霉属为主的少部分在后发酵阶段起较大作用的真菌相对丰度较低。但制曲过程所产生的丰富酶类对后发酵产生关键的作用。
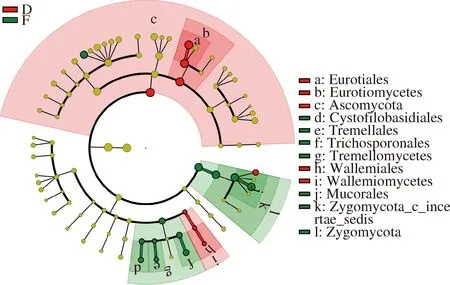
图7 永川毛霉型豆豉不同发酵阶段真菌进化分枝图Fig.7 Branching chart of fungi evolution in different fermentation stages of Mucor-type Yongchuan Douchi注:红色区域代表后发酵阶段,绿色区域代表制曲阶段;树枝中红色节点表示在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中起到重要作用的微生物类群,黄色节点表示的是在2组中均没有起到重要作用的微生物类群(下同)
2.8 细菌线性判别分析
图8为永川毛霉型豆豉不同发酵阶段细菌进化分枝图。由图8可知,后发酵阶段起重要作用的细菌较制曲阶段多。在制曲阶段起重要作用的细菌主要有棒状杆菌属、拟杆菌属(Bacteroides)、芽孢杆菌属、明串珠菌属、乳球菌属、根瘤菌属和鞘脂菌属(Sphingobium)等。到后发酵期间,芽孢杆菌属、明串珠菌属、乳球菌属、根瘤菌属、棒状杆菌属、乳酸杆菌属、库特氏菌属、葡萄球菌属和乳球菌属等主要细菌对豆豉品质形成起到的作用较大。也有部分细菌如芽孢杆菌属、乳球菌属、根瘤菌属、棒状杆菌属、葡萄球菌属等在制曲阶段的作用较大,在后发酵阶段也具有重要性。
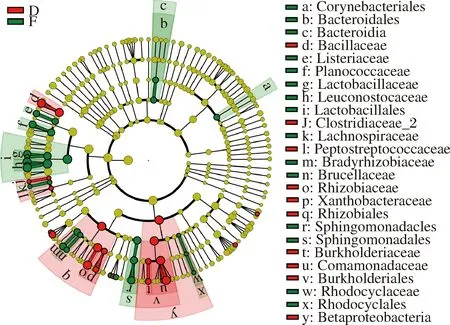
图8 永川毛霉型豆豉不同发酵阶段细菌进化分枝图Fig.8 Branching chart of bacteria evolution in different fermentation stages of Mucor-type Yongchuan Douchi
3 讨论
本研究采用高通量测序技术对制曲阶段及后发酵阶段永川毛霉型豆豉中菌落的动态变化以及在不同阶段占主导作用的核心微生物进行研究,共检测到17属主要真菌和25属主要细菌。发酵过程中微生物的多样性主要受发酵环境的温度、湿度和水分活度等因素影响,因此,制曲阶段及后发酵时期菌群群落结构及主导微生物均有较大差异。永川豆豉采用开放式制曲,微生物在制曲第6天开始进入对数期,到制曲第8天达到最大值[19]。进入后发酵阶段后,由于拌入食盐、醪糟和白酒等辅料,形成高盐、高渗透压和低水分活度环境,并在密闭条件下进一步的发酵,导致微生物多样性迅速降低。较真菌而言,细菌的生长速率快、代谢较短,因此,在整个发酵阶段细菌的多样性高于真菌。
制曲在曲房中进行,相对湿度和温度等条件非常适合细菌生长,因此,制曲阶段细菌多样性成倍增长,在制曲第8天达到最大。进入后发酵阶段后,高渗、密闭的环境不适宜大部分细菌生长[20],另外,明串珠菌属、乳酸杆菌属及魏斯氏菌属还会由于乳酸菌自身代谢产生的酸性环境而受到抑制[21]。然而,芽孢杆菌属、乳球菌属、根瘤菌属和葡萄球菌属在后发酵阶段仍具有相对稳定的丰度,是由于它们均隶属于厚壁菌门,对发酵环境的改变具有较高抗逆性[22]。这也使得厚壁菌门在其他豆豉[23-24]以及泡菜[25]中成为优势菌门。真菌多样性在制曲阶段呈现先降低后迅速增加的趋势,而在后发酵初期相对丰度>1%的也仅有隶属于子囊菌门的曲霉属和青霉属,说明以霉菌为主的真菌对环境的改变较为敏感。随着发酵的进行,一些厌氧耐盐的霉菌逐渐适应生长环境,后发酵阶段真菌多样性开始缓步增加。在这一阶段发挥主导作用的有子囊菌门、散囊菌目、威克汉姆酵母和毛霉属等真菌。也就是说,尽管相对丰度较低,但不影响以毛霉属为首的这些真菌在后发酵阶段发挥重要作用。
制曲阶段,毛霉属和根霉属共同作用,能够产生多种蛋白酶、脂肪酶以及糖化酶,这些酶类存在于整个发酵过程,将大豆蛋白、脂肪及淀粉分解,形成毛霉型豆豉独特的口感与风味,赋予其多种营养和生理功能;芽孢杆菌属和包括乳杆菌属、乳酸球菌属在内的乳酸菌可以适应整个发酵环境,产生蛋白酶、淀粉酶等多种酶类,对永川豆豉在后发酵阶段风味的形成发挥不可替代的作用[26-27];乳酸菌还能提高豆豉的总酸度,降低发酵环境pH,进一步抑制其他杂菌的生长;另外,假丝酵母属、德巴利氏酵母属等酵母可通过分泌蛋白酶、脂肪酶等多种酶类进一步提升豆豉的风味品质[28];根霉属还能分泌β-葡萄糖苷酶以及多种糖化酶,不仅能促进豆豉中产生具备生物活性的苷元型大豆异黄酮,使其具备更高的营养价值,还能促进豆豉中多糖糖化形成多种还原糖,为美拉德反应提供原料,进而促进类黑精的生成和积累,使豆豉具有黝黑的色泽。因此,毛霉型豆豉近一年的后发酵是风味品质形成的关键所在。
4 结论
本研究通过高通量测序对永川毛霉型豆豉制曲及后发酵阶菌群结构进行较为全面地研究。整个发酵过程中细菌多样性高于真菌,制曲阶段微生物多样性较后发酵阶段更为丰富,但后发酵阶段是永川毛霉型豆豉风味及品质形成的关键时期。在制曲阶段发挥主导作用的有根霉属、曲霉属和毛霉属等真菌,以及棒状杆菌属、拟杆菌属、芽孢杆菌属、明串珠菌属等细菌。后发酵阶段微生物群落结构发生较大改变,但芽孢杆菌属、乳球菌属、根瘤菌属和葡萄球菌属等细菌仍具有较为稳定的相对丰度,而毛霉属尽管相对丰度较低,但其所产生的酶类仍在后发酵阶段中发挥着重要作用。

