DNA-Cu(II)复合物应用于粮食中铜的检测
王素利,费华熙,周灿,叶宸志,蒋文苹
(重庆食品工业研究所,重庆,400042)
铜是人体必需的微量元素,对维持人体正常的生理功能具有重要作用[1]。铜在机体内多以含铜蛋白的形式存在,参与免疫反应、神经功能、骨骼代谢、造血系统、抗氧化功能等一系列活动[2]。当铜摄入量过低时,可能会引起冠心病或骨质疏松症等疾病的发生;但过量摄入则可能造成肠道紊乱,以及大脑、肝脏、肾脏的损伤,甚至引发阿尔茨海默病、帕金森症等[3],因此检测食品中的铜含量十分必要。
目前食品中铜含量的测定方法主要有石墨炉原子吸收光谱法(graphite furnace atomic absorption spectrometry,GFAAS)[4-5]、火焰原子吸收光谱法(flame atomic absorption spectrophotometry,FAAS)[6-8]、电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)[9-10]、电感耦合等离子体发射光谱法(inductively coupled plasma optical emission spectrometry,ICP-OES)[11-13]等。这些方法虽然检测结果准确、可信度高,但需要昂贵的大型精密仪器,对分析实验室和操作人员的要求较高,难以满足小规模企业日常生产监测的需要。因此开发出一种简单易行、操作方便、结果准确的铜检测方法具有十分重要的意义。比色检测法因其操作简单方便、检测成本低、检测结果可用肉眼判断等优点,而备受研究人员的关注[14-15]。
GHODAKE等[16]发现,Cu2+与酪蛋白肽功能化的Ag纳米颗粒发生配位反应,可使得Ag纳米颗粒产生集聚,导致溶液颜色由黄色变为红色,由此开发了一种Cu2+的比色检测方法。吴亮亮等[17]通过对Ag/Pt纳米簇的表面修饰调控其催化活性,建立了一种高灵敏的比色法检测Cu2+。梅晓宏等[18]建立了一种基于双重脱氧核酶的生物传感器,可实现Cu2+的裸眼可视化检测。LI等[19]利用Cu2+与特殊序列的DNA的配位作用构建了具有类过氧化物酶活性的DNA-Cu(II)复合物,以此催化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB)-H2O2发生显色反应,进而实现Cu2+的可视化检测。
目前,文献中建立的Cu2+比色检测方法多数用于水样品中Cu2+的检测[16-19],应用范围有限或者仅处于研究开发阶段。因此,考察新开发的检测方法能否适用于复杂基体中Cu的检测,扩大其应用范围具有重要的实际意义。本文在已有文献研究[19]的基础上,采用干法灰化法对粮食样品进行预处理,考察DNA-Cu(II)复合物应用于粮食中Cu的检测的可行性。
1 材料与方法
1.1 主要仪器与设备
ELX-800酶标仪,BioTek;TAS-990原子吸收分光光度计,北京普析通用公司;UPTA-20超纯水机,邦西仪器科技有限公司;SHH-250L恒温培养箱,重庆市永生实验仪器厂;高速台式离心机,北京京立离心机有限公司;XMTD-6000恒温水浴锅,北京长风仪器仪表公司;JA3003A电子分析天平,上海精天电子仪器有限公司;DL-1电炉,北京中兴伟业世纪仪器有限公司;SX2-12-10Z箱式电阻炉,上海博迅实业有限公司医疗设备厂。
本实验所用玻璃器皿、坩埚等均用体积分数20% HNO3溶液浸泡过夜,自来水反复冲洗后,用一级水冲洗干净。
1.2 主要材料与试剂
GBW(E)100195小麦粉有证标准物质、GBW(E)100196玉米粉有证标准物质、GBW(E)100194大米粉有证标准物质、GBW10055大豆粉有证标准物质,中国计量科学研究院;10种粮食样品购自重庆某超市。
一级水(符合GB/T 6682—2008一级水要求),自制;盐酸(优级纯)、H2O2(30%,分析纯),重庆川东化工(集团)有限公司;KH2PO4(分析纯),成都市科隆化学品有限公司;Cu、Cr、Ni、Zn、Pb、Ca、Mn标准溶液(1 000 mg/L),Inorganic Ventures;Ma、Cd,标准溶液(1 000 mg/L)、Al标准溶液(100 mg/L),K、Fe、Mg标准溶液(1 000 mg/L),中国计量科学研究院国家有色金属及电子材料分析测试中心;TMB(纯度≥99.0%)DNA核酸序列RET1:A(G4C)3G5C、RET2:GC5(GC4)3T(ULTRAPAGE纯化),生工生物工程(上海)股份有限公司。
DNA溶液的配制:将DNA冻干粉用一级水漩涡振荡溶解,取等量的RET1溶液和RET2溶液混合,经退火后,形成双螺旋结构(RET1-RET2),双链DNA配制浓度为50 μmol/L;缓冲溶液为100 g/L KH2PO4溶液;TMB溶液为5 mmol/L乙醇溶液。
1.3 实验方法
1.3.1 Cu2+的检测
向微孔板中依次加入100 μL缓冲溶液、20 μL DNA溶液、20 μL不同质量浓度的Cu2+标准溶液,轻轻振荡混匀;再加入20 μL TMB溶液,混匀后加入20 μL H2O2,振荡混匀后,25 ℃避光环境反应30 min,用酶标仪进行630 nm/450 nm双波长检测,测定各孔吸光度。
1.3.2 选择性和干扰性实验
选择性实验:用10倍浓度的其他常见金属离子Na+、K+、Cr3+、Cd2+、Al3+、Ni2+、Zn2+、Pb2+、Fe3+、Ca2+、Mg2+、Mn2+(4.0 μg/mL)代替上述Cu2+检测方法加入的0.4 μg/mL Cu2+,其他步骤同1.3.1,考察该方法的选择性。
干扰性实验:将一定量的其他常见金属离子Na+、K+、Cr3+、Cd2+、Al3+、Ni2+、Zn2+、Pb2+、Fe3+、Ca2+、Mg2+、Mn2+标准溶液分别与Cu2+标准溶液混合,配制成Cu2+质量浓度为0.4 μg/mL,其他金属离子质量浓度为4.0 μg/mL的混合离子溶液。将混合离子溶液代替上述Cu2+检测方法加入的Cu2+标准溶液,其他步骤同1.3.1,考察在有其他离子存在下该方法的抗干扰能力。
1.3.3 实际粮食样品分析
称取粉碎后试样0.5~5 g(精确至0.001 g)于坩埚中,将坩埚置于电炉上以小火加热使试样充分炭化至无烟,然后置于高温炉中,在(550±25)℃灼烧4 h。冷却取出,对于灰化不彻底的试样,加数滴HNO3,小火蒸干后,再转入高温炉中继续灼烧,至试样呈白灰状,冷却后取出,用1 mL体积分数50% HCl溶液溶解并转移至25 mL比色管中,用一级水定容至25 mL刻度线,同时做试剂空白试验。
在与1.3.1相同的实验条件下,将Cu2+标准品溶液替换为空白溶液和试样溶液,测定吸光度。以标准系列溶液中Cu的质量浓度为横坐标,以相应的吸光度值为纵坐标,绘制标准曲线。根据回归方程计算出样品中Cu的浓度。检测过程中Cu2+浓度需在标准曲线的浓度范围内,如超过标准曲线最大浓度,需稀释后重新测定。
2 结果与分析
2.1 标准曲线的建立
在实验条件下,测定不同Cu2+质量浓度下反应体系的吸光度值,Cu2+质量浓度在0~1.0 μg/mL范围内与反应体系所测吸光度值符合二次函数关系,曲线回归方程为:y=-0.173 5x2+0.431 6x+0.004 1,R2=0.998。
2.2 检出限的确定
平行测定20次空白值,计算出吸光度值的标准偏差,将3倍的标准偏差代入标准曲线,计算出相对应的浓度,即为检出限。由此计算出本方法的检出限为0.01 μg/mL,当称样量为1.0 g,定容体积为25 mL时,方法的检出限为0.25 mg/kg,与GB 5009.13—2017《食品安全国家标准 食品中铜的测定》[20]第二法火焰原子吸收光谱法中的检出限相当。
2.3 选择性和干扰性实验结果分析
如图1-a所示,在反应条件下,高浓度的其他金属离子的吸光度值远小于Cu2+,这说明该反应体系对于Cu2+具有特定的识别能力。干扰性实验结果如图1-b所示,在10倍浓度其他离子存在的情况下,反应后的吸光度值相对单独的Cu2+并未发生显著性变化,说明该反应体系具有较强的抗干扰能力。
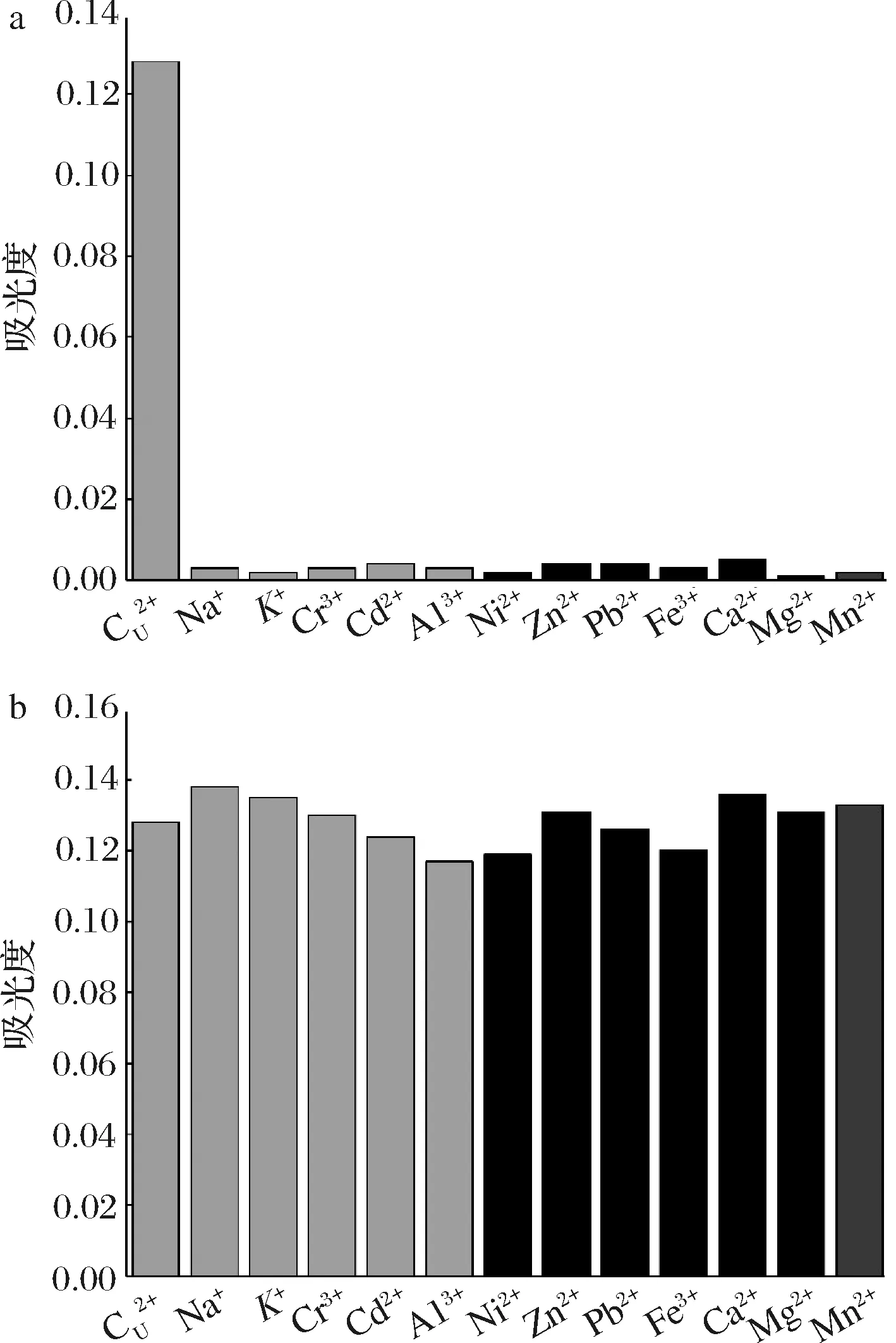
a-金属离子(质量浓度为4.0 μg/mL)反应后吸光度值b-混合离子(含0.4 μg/mL Cu2+和4.0 μg/mL其他金属离子)反应后吸光度值图1 选择性和干扰性实验结果Fig.1 Results of selectivity and interference
2.4 准确性实验结果
选取10种常见粮食样本(大米、小米、小麦、玉米、红豆、燕麦、花生、大豆、芝麻、土豆),各样本分别加入适当不同质量浓度的Cu标准物质,作为低、中、高值的阳性样本。前处理过程相同,采用本实验方法与GB 5009.13—2017《食品安全国家标准 食品中铜的测定》[20]中第二法火焰原子吸收光谱法进行对比实验。同一样品平行测定3次,取其平均值作为检测结果,检测结果见表1。
采用配对t检验法比较2种方法的检测结果是否存在显著性差异[21]。在95%的置信度下,计算得到tD= 0.226,查t分布表可知,t0.05,29=2.045,tD 使用本实验方法分别对小麦粉、玉米粉、大米粉、大豆粉有证标准物质进行6次重复测定,考察本方法的精密度。实验结果见表2。 表1 本方法与火焰原子吸收法测定结果比较Table 1 Comparison between the results of this method and FAAS 表2 精密度实验数据Table 2 The test results of precision 根据GB/T 27404—2008[22]附录F:检测方法确认的技术要求规定,被测组分含量在0.1~1 mg/kg时,实验室内变异系数≤ 11%;被测组分含量在1~10 mg/kg时,实验室内变异系数≤ 7.5%,被测组分含量在10~100 mg/kg时,实验室内变异系数≤5.3%。真值含量在0.01~10 mg/kg时,测定含量平均值与真值的偏差指导范围为-20%~+10%。本实验方法测量结果能够满足上述要求。 另外,NY 861—2004[23]规定谷物及制品中Cu的限量≤10 mg/kg,豆类及制品中、薯类制品中Cu的限量≤20 mg/kg,鲜薯类中Cu的限量≤6 mg/kg。当称样量为1.0 g,定容体积为25 mL时,上述最大限量对应的Cu2+的质量浓度分别为0.4、0.8、0.24 μg/mL。本实验方法测量范围能够满足上述要求。 若无酶标仪设备,也可采用目测法进行半定量判定,即将反应后的样品比色杯与标准点比对,得到样品溶液的近似浓度,进而计算出样品中Cu的大致含量,可用于对大批量样品进行快速筛查。 基于DNA-Cu(II)复合物的类过氧化物酶活性,本文采用干法灰化法对粮食样品进行预处理,建立了粮食中Cu的比色检测方法。通过对标准曲线、检出限、准确性、精密度等的考察,证实了该比色检测方法应用于粮食中Cu含量检测的可行性。但此方法能否适用于基质更加复杂的样品尚未可知,今后工作拟考察该方法应用于果蔬样品、动物性食品等各类样品中Cu含量检测的可行性,以期进一步扩大其适用范围。2.5 精密度实验结果

3 结论

