山葡萄有机酸降解菌的筛选、分离及鉴定
吴曼毓,蒋海芹,贺阳,文连奎,*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.唐山市市场监督管理局,河北唐山063200)
山葡萄(Vitis amurensis Rupr)主要用于酿造山葡萄酒和加工山葡萄汁,其果实有机酸含量达质量浓度10 g/L~28 g/L[1],主要为酒石酸,少量苹果酸和柠檬酸。因酸度较高,口感酸涩,易引起酒液失光、浑浊等现象[2-3],因此,降低山葡萄酒酸度是提高感官品质的关键。
目前,国内外果酒降酸方法主要有化学降酸、物理降酸和生物降酸,其中化学降酸应用较为广泛但易使酒液中残留矿物质,影响果酒感官特性[4-5];物理降酸效果甚微,且成本较高;因此,生物降酸成为果实降酸研究的热点。杨华等从红豆越橘汁中分离出菌株BY-9,接入发酵后的红豆越橘果酒中,使总酸含量降低12.26%[6]。郝爱玲等筛选出降酸能力最强(降酸率18.12%)的东方伊萨酵母M130应用于猕猴桃酒降酸[7]。文连奎等从含酒石酸的环境中分离得到黑曲霉F1,对酒石酸降解率高达70%[8]。王立芳等筛选出的陆生伊萨酵母对苹果酸的降酸率达79.9%,对柠檬酸的降解率达73.1%[9]。Zeravik等利用乳酸菌,通过苹果酸乳酸发酵降低了葡萄酒的酸度[10-12]。本试验从山葡萄生长的土壤中筛选具有降酸作用的菌株,为山葡萄酒生物降酸研究提供思路。
1 材料与方法
1.1 材料与试剂
土壤:吉林农业大学山葡萄园,铲去地表5 cm左右浮土和植物根系,采集深度为10 cm~15 cm。
无水乙醇、氯化钠、氢氧化钠、酚酞指示剂(均为分析纯):北京化工厂;甘油(分析纯):北京鼎国昌盛生物技术有限公司;酒石酸、苹果酸、柠檬酸(均为分析纯):北京北化精细化学品有限公司;琼脂粉:天津市科密欧化学试剂有限公司;YPD液体培养基:青岛高科园海博生物技术有限公司;甲醇(色谱级):美国TEDIA。
1.2 仪器与设备
大容量多孔离心机(LXJ-ⅡB):上海安亭科学仪器厂;压力蒸汽灭菌锅(LS-3D)、生化培养箱(SPX-250B-Z)、振荡培养箱(SPX-250B-D):上海博迅实业有限公司;高效液相色谱(1200):美国 Agilent;pH 计(pH-3C):上海佑科仪器仪表有限公司;双人净化工作台(SW-CJ-2D):浙江苏净净化设备有限公司;生物显微镜(DM1000):德国 LEICA;电泳仪(DYY-11):北京市六一仪器厂;PCR仪 (2720)、DNA 测序仪(3730 XL):美国 ABI。
1.3 方法
1.3.1 降酸菌株的筛选
取(2±0.2)g土壤装入锥形瓶,加入100 mL无菌生理盐水。锥形瓶中加入玻璃珠后放入摇床振荡20 min,待静置分层后取上清液涂于固体培养基,于28℃恒温培养箱培养3 d后,取长势较好的几株菌落再次平板划线培养,将菌株进行纯化,最后进行斜面保存与甘油保存。
将纯化好的菌种接种到分别含有质量浓度10 g/L酒石酸、苹果酸、柠檬酸的3种液体培养基中,于28℃,150 r/min 培养 5 d[13-15]。按照 GB 5009.157-2016《食品安全国家标准食品有机酸的测定》[16]测定有机酸含量,试验重复3次取平均值,筛选出降酸效果较好的菌株并命名,并对降酸效果最优的菌株进行降酸效果分析。
1.3.2 降酸菌株鉴定
1.3.2.1 形态学鉴定
向YPD液体培养基中加入质量浓度20 g/L琼脂粉制成固体培养基,将具有最佳降酸效果的菌株在固体培养基上接种1点~3点,于28℃培养5 d,观察菌落生长状况,对单菌落颜色、形态与特征进行观察。并取少量菌丝,放于光学显微镜下,观察分生孢子头、梗等形状特点[17-18]。
1.3.2.2 分子生物学鉴定
取上述该菌株适量菌体溶于50 μL Takara公司试剂盒(takata lysis buffer for Microorganism to Direct PCR Code No.D304)试剂中变性后离心取上清液作为模板(Template DNA)。反应条件为80℃,15 min[19-20]。
PCR反应体系为:模板 DNA 3 μL,正向引物(10 pmol/μL)1 μL,反向引物(10 pmol/μL)1 μL,2×TransTaqHiFi PCR SuperMix I 25 μL,16s-free H2O 20 μL,共 50 μL。
PCR扩增条件为:94℃预变性5 min;95℃10 s,55℃20 s,72℃1.5 min,循环 35次;72℃延伸10 min。
26s rDNA测序:以NL1和NL4为引物,上游引物NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3';下游引物 NL4:5'-GGTCCGTGTTTCAAGACGG-3'。
1.3.3 降酸菌株生长特性及耐受性能试验
1.3.3.1 菌株最适接种量
将降酸菌株孢子悬液以孢子数12×106CFU/mL稀释为体积分数1%、2%、3%、4%、5%分别接种到pH 3.0的液体培养基中,在28℃,150 r/min摇床培养3 d后,将菌丝体进行抽滤,于烘箱中烘至恒重,以菌丝体干重确定最佳接种量。重复3次试验取平均值。
1.3.3.2 菌株最适生长温度
将降酸菌株以体积分数3%接种量将孢子悬液接种在pH 3.0的液体培养基中,分别在20、24、28、32、36℃条件下150 r/min恒温培养3 d,将菌丝体进行抽滤,于烘箱中烘至恒重,以菌丝体干重确定最适生长温度。重复3次试验取平均值。
1.3.3.3 菌株最适生长pH值
将降酸菌株孢子悬液以体积分数3%分别接种于常温下 pH 2.0、2.5、3.0、3.5、4.0(模拟葡萄有机酸比例配制酸液调节pH值:70%酒石酸、20%柠檬酸、10%苹果酸)的液体培养基中,28℃,150 r/min恒温摇床培养3 d,将菌丝体进行抽滤,于烘箱中烘至恒重,以菌丝体干重确定最适生长pH值。重复3次试验取平均值。
1.3.3.4 菌株最适生长转速
将降酸菌株孢子悬液以体积分数3%接种于100mL pH值为3.0的液体培养基中,在28℃条件下,分别以110、130、150、170、190 r/min 培养 3 d,将菌丝体进行抽滤,于烘箱中烘至恒重,以菌丝体干重确定最适生长转速。重复3次试验取平均值。
1.3.3.5 菌株传代降酸特性
将降酸菌株孢子悬液以体积分数3%接种于100 mL pH值为3.0的液体培养基中,在28℃条件下,150 r/min恒温摇床培养3 d。使用接种环划线于培养皿并放入28℃恒温培养箱中培养3 d,用接种针刮下已经生长好的菌体,移植到YPD培养基中传代培养10代。每一代菌种均按1.3.1的方法测定降酸率。重复3次试验取平均值。
1.3.3.6 菌株对SO2耐受量
将降酸菌株以体积分数3%的孢子悬液分别接种于含有质量浓度 300、350、400、450、500 mg/L 的 SO2液体培养基中,28℃,150 r/min恒温摇床培养3 d后称量菌丝体干重得到降酸菌株对SO2的耐受量,分别吸取过滤菌丝后的培养液100 μL在固体培养基上涂布,28℃培养3 d后观察是否有菌落生长。以不添加SO2为对照。重复3次试验取平均值。
1.3.3.7 菌株对酒精耐受性
将降酸菌株以体积分数3%的孢子悬液分别接种于含有体积分数4%、6%、8%、10%、12%乙醇的液体培养基中(pH 3.0),28℃,150 r/min摇床恒温培养3 d后称量菌丝体干重得到降酸菌株对于酒精的耐受量。分别吸取过滤菌丝后的培养液100 μL在固体培养基上涂布,28℃培养3 d后观察菌落生长情况。以不添加乙醇为对照。重复3次试验取平均值。
1.3.3.8 菌株致死温度
将降酸菌株于pH 3.0的液体培养基中,于28℃,150 r/min活化后,取5 mL菌液于离心管中,分别按以下温度与时间水浴,观察降酸菌株的致死条件:60℃条件下水浴 20、30 min;65℃条件下水浴 20、30 min;75 ℃条件下水浴 15 s、5、10、15 min;80 ℃条件下水浴 15 s、5、10、15 min;85 ℃条件下水浴 15 s、2、5 min;90 ℃条件下水浴15 s、2、5 min。水浴后分别吸取菌液100 μL在固体培养基上涂布,28℃培养3 d后观察菌落的生长情况[21-22]。重复3次试验取平均值。
2 结果与分析
2.1 降酸菌株筛选结果
2.1.1 降酸菌株筛选
筛选出的菌株第一代菌种经含酸液体培养基培养后,降酸率结果如图1。
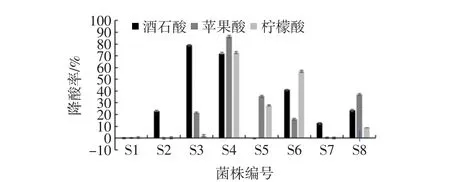
图1 筛选菌株及降酸率对比Fig.1 Strains and their comparison of acid reducing rate
由图1可见,有8株菌株具有降酸效果,命名为S1、S2、S3、S4、S5、S6、S7、S8。8 株菌株中,6 株菌株对酒石酸有降酸效果,降酸率10%~30%的有3株,30%~50%有1株,高于50%有2株,分别为菌株S3和S4。5株菌对苹果酸有降酸效果,降酸率10%~30%的有2株,30%~50%有2株,高于50%有1株,为菌株S4。5株菌株对柠檬酸有降酸效果,降酸率10%~30%的有3株,高于50%有2株,分别为菌株S4和S6。综合降酸率结果,选择降酸效果最优的S4菌株进行以下分析。
2.1.2 菌株S4降酸效果分析
菌株S4液体培养基含酸量变化如图2。
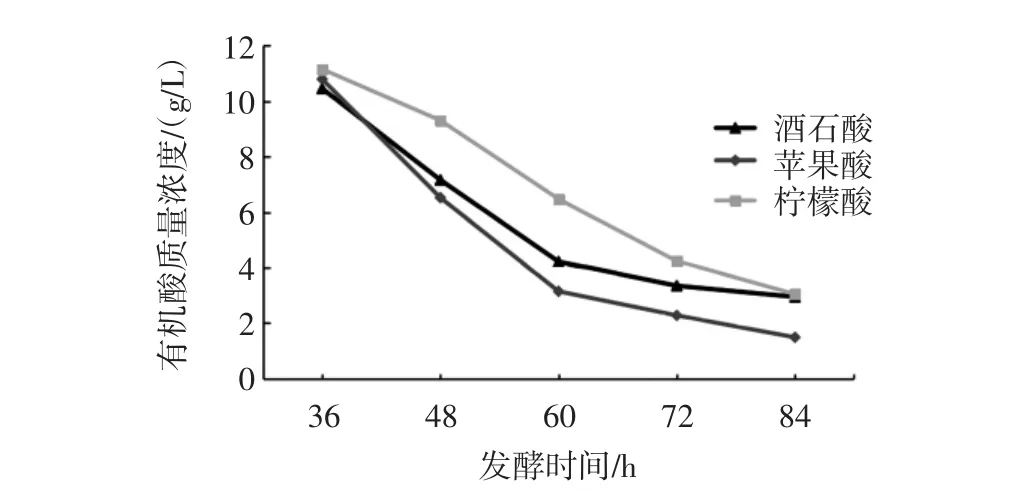
图2 液体培养基的含酸量变化Fig.2 The change of acid content of culture media
由图2可知,菌株S4对于酒石酸、苹果酸、柠檬酸降酸率为酒石酸(71.90±0.27)%,含酸量由(10.46±0.08)g/L 降为(2.94±0.05)g/L;苹果酸(86.33±0.53)%,含酸量由(10.80±0.09)g/L 降为(1.48±0.07)g/L,柠檬酸(72.77±0.46)%含酸量由(11.16±0.07)g/L 降为(3.04±0.07)g/L,降酸前后含酸量经过T检验得到差异极显著(p<0.01)。
2.2 菌株S4形态学观察
菌株S4形态学观察结果见图3~图5。
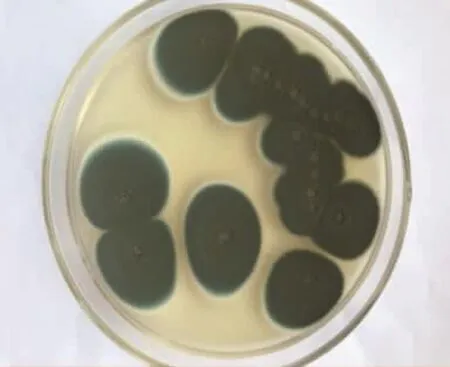
图3 菌株S4在固体培养基中形态Fig.3 Morphology of strain S4 in solid medium
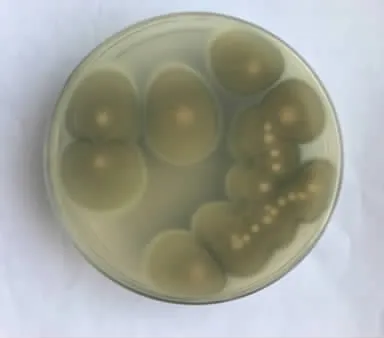
图4 菌株S4在固体培养基中背面形态Fig.4 Back morphology of strain S4 in solid medium
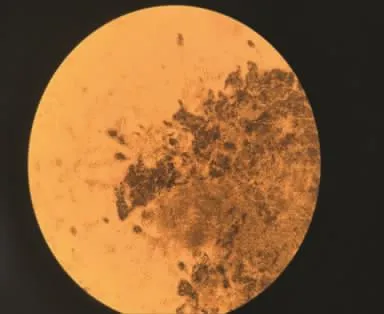
图5 菌株S4在显微镜下形态Fig.5 Morphology of strain S4 under microscope
将菌株S4点植于固体培养基中,28℃下恒温培养5 d。可观察到菌落生长迅速,菌落为圆形或椭圆形,菌体较厚且呈绿色绒毛状,中心略有凹陷(见图3)。平板背面呈淡色,中央呈白色(见图4)。接入液体培养基中,菌体成长为球状。经过显微镜观察,菌丝各细胞之间有横膈膜,菌丝向上突起分生出孢子梗,顶端长出扫帚状分生孢子,呈绿色。根据观察可初步鉴定该菌株为青霉属(见图5)。
2.3 菌株S4分子生物学鉴定
对纯化后菌株S4进行PCR扩增,琼脂糖凝胶电泳的结果为,菌株S4 DNA片段长度为577 bp,见图6。
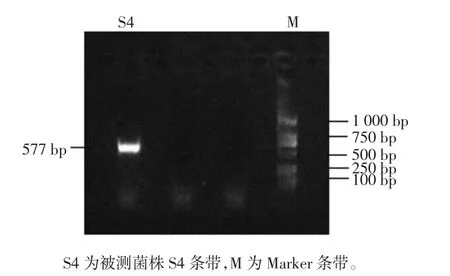
图6PCR产物电泳图Fig.6 Electrophoresis of PCR products
将测序结果输入Genebank中,利用BLAST功能组件将测得的基因序列与Genebank数据库中序列进行同源性比较。选取BLAST结果中得分较高的株菌的序列,使用MEGA5.2.1软件根据Neighbor-Joining进行系统进化树分析,结果如图7所示,通过系统进化树可以判定菌株S4为草酸青霉(Penicillium oxalicum)。

图7 26s rDNA序列的进化树Fig.7 Evolutionary tree based on the 26s rDNA sequence
目前,草酸青霉主要应用于果蔬贮藏中与致腐菌的拮抗作用以及降解农药等[23-24],曾报道应用于普洱茶发酵[25],因此在未来的试验中,在对其安全性进一步评价后,可利用基因工程手段提取其降酸基因,在酵母菌等中表达应用于果酒降酸,亦可应用于含有机酸的废水处理等方面。
2.4 菌株S4生长特性
2.4.1 最适接种量
菌株S4最适接种量如图8所示。
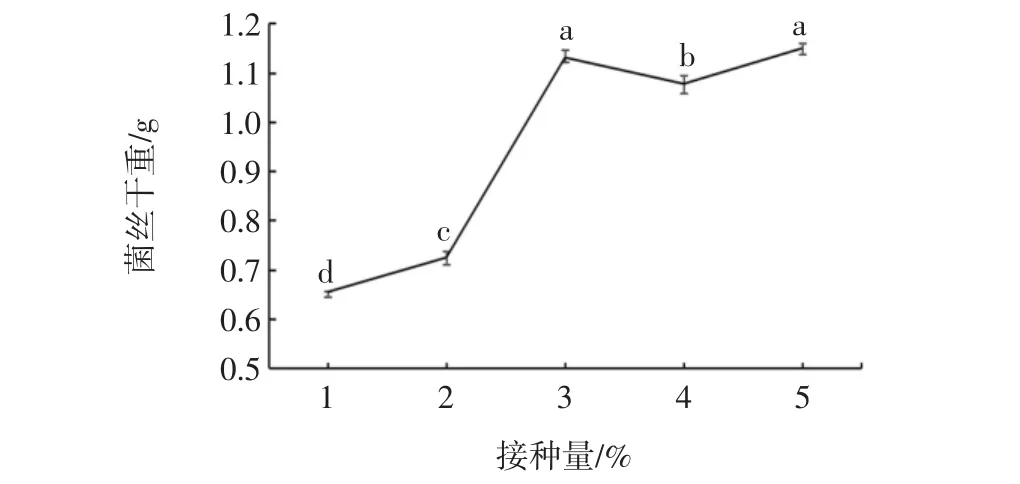
图8 接种量对菌株S4生长的影响Fig.8 Effect of inoculation quantity on the growth of strain S4
如图8可见,降酸菌株S4最适接种量为体积分数3%,显著性水平取α=0.05,采用统计学SNK方法得到差异显著(p<0.05)。通过观察发现接种量高于体积分数3%时,因其菌丝团过于密集,菌体出现颜色变深和相互粘连的状态。接种量低于体积分数3%时,菌体与营养物质接触不充分,在液体培养基中菌丝团较小,因此最适接种量选择体积分数3%。
2.4.2 最适生长温度
菌株S4最适生长温度如图9所示。
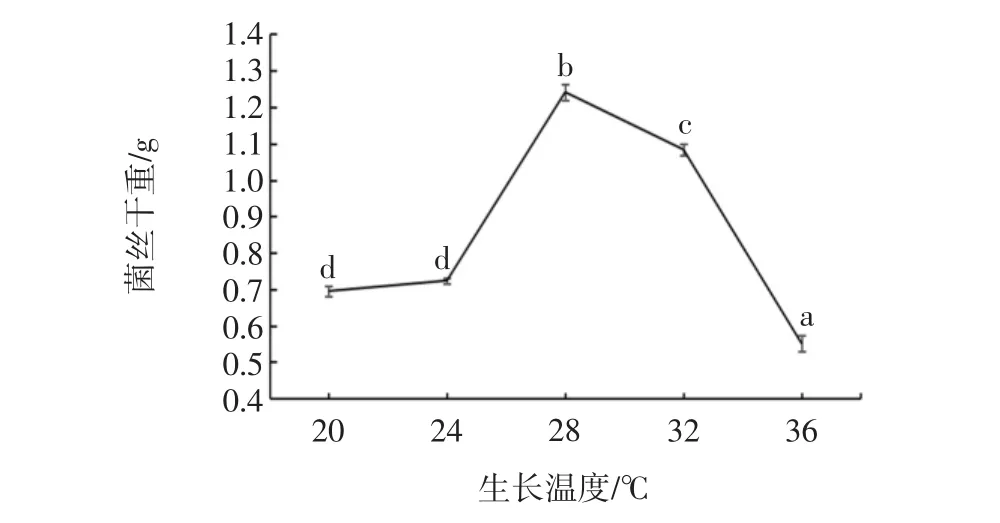
图9 温度对菌株S4生长的影响Fig.9 Effect of temperature on the growth of strain S4
如图9所示,菌株S4最适生长温度为28℃,显著性水平取α=0.05,采用SNK方法得到差异显著(p<0.05)。根据微生物生长特性,培养温度高于28℃或低于28℃时菌体不能充分生长,因此最佳生长温度为28℃。
2.4.3 最适生长pH值
菌株S4最适生长pH值如图10所示。
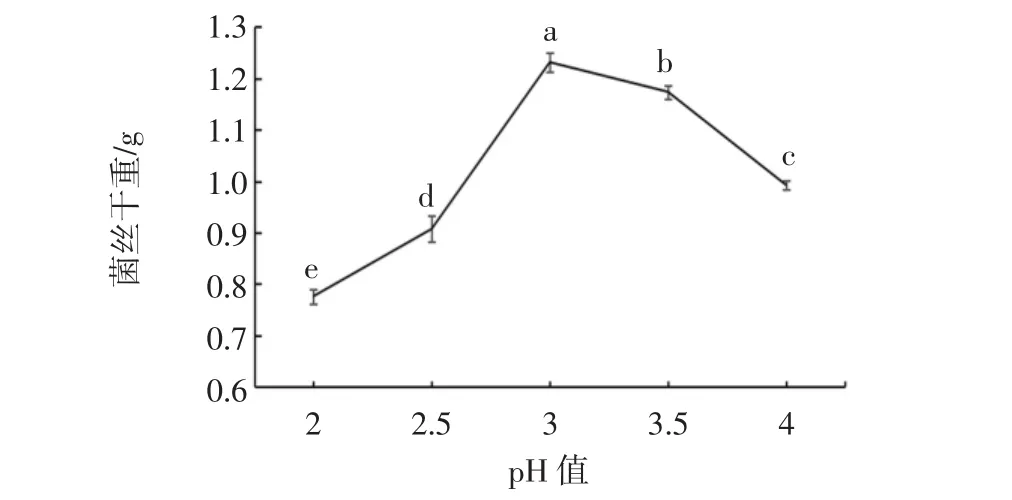
图10 pH值对菌株S4生长的影响Fig.10 Effect of pH value on the growth of strain S4
如图10所示,菌株S4最适生长pH值为3.0,显著性水平取α=0.05,采用SNK方法得到差异显著(p<0.05)。可证明菌株在偏酸环境下更容易生长,因此适宜应用在山葡萄酒酿造中。
2.4.4 最适生长转速
菌株S4最适生长转速如图11所示。
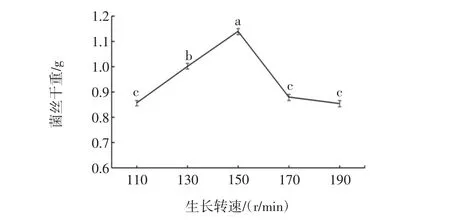
图11 生长转速对菌株S4生长的影响Fig.11 Effect of rotation rate on the growth of strain S4
如图11所示,菌株S4最适生长转速为150r/min,显著性水平取α=0.05,采用SNK方法得到差异显著(p<0.05)。高于150 r/min时溶氧量急剧升高,产生大量代谢产物从而影响菌株生长。转速低于150 r/min时,菌株与氧气、培养液中营养物质接触不充分,导致菌体不能充分生长。
2.5 菌株传代降酸特性
将菌株S4在培养基中传代10代以上,以同样的条件接种及培养后,其降酸结果如图12。
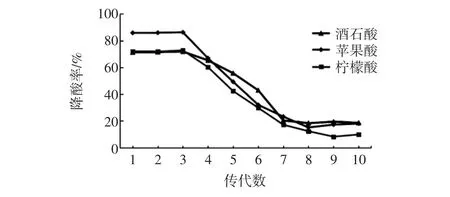
图12 S4菌株传代数对降酸率的影响Fig.12 The effect of S4 strain on the acid reducing rate
试验中发现其降酸效果会随着菌株传代次数的增加而降低降酸效果,经反复试验,在菌株为1代~4代时,降酸率较高。但培养至5代~7代,菌株的降酸率大量降低,但在7代以后降酸率趋于稳定,酒石酸(20.13±0.27)%,苹果酸(18.38±0.92)%,柠檬酸(11.85±0.55)%。通过分析菌种来源及筛选过程,原因可能是菌株生长环境由土壤变为培养液,其可逐渐适应适宜的生长环境,降酸功能减弱。可在后续研究中,从分子生物学角度对菌株进行复壮研究。
2.6 菌株耐受性能
2.6.1 菌株S4的SO2耐受性能结果
菌株S4的SO2耐受性能结果如图13所示。
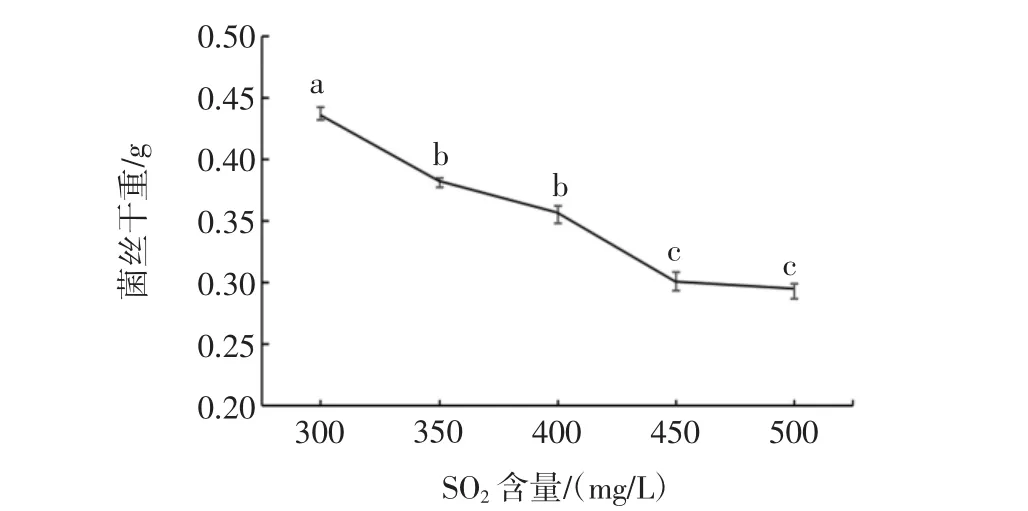
图13 菌株S4 SO2耐受性能Fig.13 SO2tolerance of strain S4
将菌株S4接种到含有SO2的液体培养基中活化,取菌液涂板培养,3 d后平板中均长出大量S4菌落,在含硫量高达质量浓度500 mg/L(p<0.05)的培养基中仍可生长。由2.4可知,培养基中不添加SO2时,菌丝干重为1.2 g左右,在含有SO2的培养基中,菌株长势弱于普通培养基但仍可存活。原因可能为SO2对菌株有一定的抑制作用。今后可通过对降酸菌株进行驯化富集培养使菌株增强对SO2的耐受性。
2.6.2 菌株S4的酒精耐受性能
菌株S4的酒精耐受性能结果如图14所示。
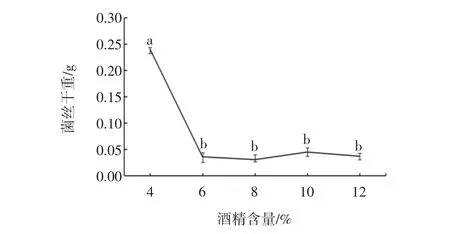
图14 菌株S4酒精耐受性能Fig.14 Ethanol tolerance of strain S4
将菌株S4在含有酒精的液体培养基中活化后,取菌液涂板培养,3 d后平板中长出大量S4菌落,因此该菌株即使在酒精含量高达体积分数12%(p<0.05)的培养基中菌落仍然存活。由2.4所知,培养基中不添加酒精时,菌丝干重为1.2 g左右,在含有酒精培养液中菌株可存活但长势弱于普通培养基,原因可能为酒精对菌株有一定的抑制作用。今后可通过对降酸菌株进行驯化富集培养使菌株增强对酒精的耐受性。
2.6.3 菌株S4的致死温度试验
菌株S4的致死温度试验结果如表1所示。
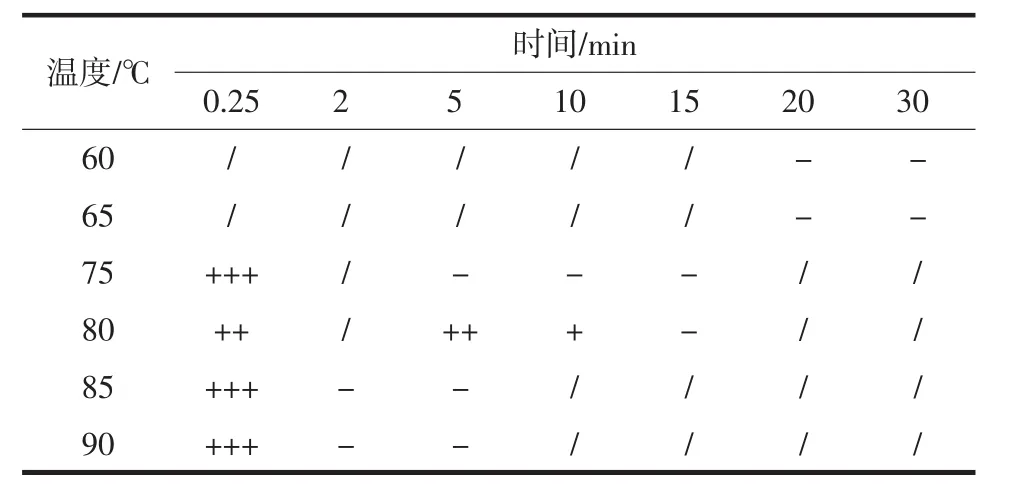
表1 S4致死温度试验Table 1 Lethal temperature test of strain S4
通过表1可知,菌株S4在致死条件为60℃~65℃,20 min~30 min时无菌落生长,在 75℃,5min~15 min时无菌落生长,85℃~90℃,2 min~5 min时无菌落生长。因此符合巴氏杀菌条件[26],不需要过高的灭菌温度及长时间的灭菌。
3 结论
从山葡萄生长的土壤中筛选得到8株具有降解有机酸效果的菌株,筛选出一株降酸效果最佳的菌株S4,对于酒石酸、苹果酸、柠檬酸降解率分别为(71.90±0.27)%、(86.33±0.53)%、(72.77±0.46)%。经多次传代后,其降酸率下降,但可稳定在酒石酸降解率为(20.13±0.27)%,苹果酸降解率为(18.38±0.92)%,柠檬酸降解率为(11.85±0.55)%。通过形态及分子生物学鉴定该菌株为草酸青霉(Penicillium oxalicum)。该菌株最适接种量为3%,最适生长温度为28℃,最适生长pH值为3.0,最适生长转速为150 r/min。其对SO2耐受性>质量浓度500 mg/L,对酒精耐受性>体积分数 12%,致死温度为60℃~65℃,20 min~30 min。