放射性同位素碳-14标记毒死蜱的合成与分析
余凯翔,杨征敏,周 兵,徐凌锋,李书琰,陈沪飞,王 伟
(1.浙江大学 原子核农业科学研究所,杭州 310058;2.上海启甄同位素标记合成研究中心,上海 201403)
毒死蜱(Chlorpyrifos)是美国陶氏化学于1965年成功开发并商品化的乙酰胆碱酯酶抑制剂,属硫代磷酸酯类非内吸性广谱杀虫杀螨剂。它具有触杀、胃毒和熏蒸作用,能有效防治多种作物的地上和地下害虫,是一种具有中等毒性、低残留的农药品种。尽管毒死蜱的专利早已过期,但因其具有其广谱、高效等优点,因而毒死蜱仍然是世界杀虫剂市场的主流品种之一。2007年,我国全面禁止使用5种高毒有机磷杀虫剂,毒死蜱迅速抢占这些禁用品种留下的市场空间。迄今,毒死蜱依然是我国应用最广泛的有机磷类杀虫杀螨剂之一[1]。
伴随着毒死蜱长期持续、大量使用而产生的慢性毒性、生态环境等与人体健康密切相关的系列问题引起了国内外学者和多国政府部门的关注,人们对于该杀虫剂可能引起的潜在危害而担忧[2-5]。放射性同位素示踪法是深入开展上述问题研究进而评判毒死蜱安全性的常用方法之一[6-13],而放射性同位素碳-14标记毒死蜱是示踪研究中理想的示踪剂。从毒死蜱的化学稳定性、代谢稳定性、毒理学重要性和示踪试验的要求等角度考虑,具有芳香性的吡啶环是毒死蜱分子中理想的标记位置。文献报道了一种吡啶环碳-14标记毒死蜱(O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C2]吡啶基)硫代磷酸酯),但该标记物的制备条件苛刻,须使用剧毒的[14C]氰化钾和氯气,且氯气必须在高温高压(高压釜)下反应,因而实验操作具有较大的潜在危险性[14]。为克服该法不足,笔者设计并制备了一种替代该标记物的吡啶环碳-14标记毒死蜱(1,O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C]吡啶基)硫代磷酸酯[15]),标记物(1)合成的条件温和,操作安全、可行性高。
1 仪器与试剂
1.1 主要仪器
本研究中放射合成工作在上海启甄同位素标记合成研究中心完成;Varian 400 MHz核磁共振仪(以TMS为内标):美国瓦里安公司;Mini-Scan TLC薄层放射性扫描仪:美国BioScan公司;FSA:美国Aim Research公司;Waters Alliance e2695 HPLC-Acquity Qda MS/2489 UV高效液相色谱-紫外光谱/质谱联用系统和Waters 2545 HPLC-2998 PDA制备型液相色谱系统(配备Waters fraction collector Ⅲ):美国Waters公司;Agilent 7890B GC-5977B MS气相色谱-质谱联用系统:美国Agilent公司;Tri-Carb 4910TR液体闪烁测量仪:美国PE公司;Typhoon FLA9500 IP多功能激光成像仪:美国GE公司;Milli-Q Reference S. Kit(18.2 MΩ/cm,25 ℃)超纯水制备系统:默克化工技术(上海)有限公司;Sartorius BSA22 4S-CW(1 mg)和BT25S(0.01 mg)电子天平:德国赛多利斯公司。
1.2 主要试剂
[14C]碳酸钡(比活度55.3 mCi/mmol,放化纯度99.9%,化学纯度98%):美国ARC公司;2,5-二苯基噁唑(PPO):高效液相色谱(HPLC)纯度大于99.0%,日本TCI公司;1,4-双(5-苯基-2-噁唑)苯(POPOP):HPLC纯度大于99.0%,日本TCI公司;Optiphase HiSafe 3闪烁液:美国PE公司;HPLC和HPLC-MS用甲醇:分别为色谱级和质谱级,美国Fisher Scientific公司;其他试剂均为市售分析纯,试剂按照文献[16]方法纯化。
2 实验方法
毒死蜱(Chlorpyrifos)化学结构图示于图1,放射性同位素碳-14标记毒死蜱(1)的合成路线示于图2。

图1 毒死蜱和两种碳-14标记毒死蜱(1和2;*标示碳-14标记位点)Fig.1 Chlorpyrifos and its carbon-14 labelled counterparts (1&2, *indicates carbon-14 labelled sites)
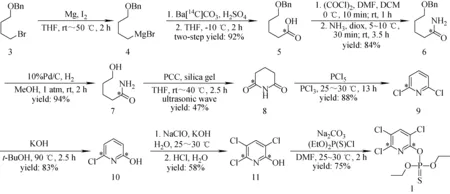
图2 放射性同位素碳-14标记毒死蜱(1)的合成路线(*标示碳-14标记位点)Fig.2 Synthetic route of radioisotope carbon-14 labelled chlorpyrifos (1, *indicates carbon-14 labelled sites)
2.1 放射性同位素标记化合物的制备
2.1.15-苄氧基[羰基-14C]戊酸(5) 利用自制的第五代微型集成式放射性二氧化碳反应装置制备标记物(5)[7,17]。投料量和反应条件:(A)制备格氏试剂(4):依次向二氧化碳反应器中加入表面光亮的镁屑(41 mg)、4-溴丁基苄基醚(3)的无水四氢呋喃(THF)溶液(5.1 mL,0.65 mol/L)和碘的无水THF溶液(0.5 mL,0.2 mol/L)进行反应。反应引发后控制加料过程中反应温度为40~50 ℃;加毕室温搅拌2 h。(B)格氏反应:在二氧化碳发生器中分别加入[14C]碳酸钡(291.2 mg,55.3 mCi/mmol)和脱气浓硫酸(4 mL);在-10 ℃进行格氏反应。按照标准操作程序启动微型集成式反应装置进行反应[7,17]。GC-MS和气体放射性检测表明,反应装置运行2 h后[14C]CO2彻底消耗。向二氧化碳反应器中反应液里加入饱和氯化铵溶液(30 mL),减压脱除该混合液中THF,残余液以稀盐酸(1 mol/L,下同)酸化(pH 2~3),二氯甲烷(DCM)萃取(35 mL×5);萃取液以氢氧化钠溶液(1 mol/L)反萃取(30 mL×3),酸化反萃取液(pH 2~3),DCM萃取(35 mL×5),萃取液经饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩得油状物[18]。同法重复该反应3次;共得油状物(5,1 140.6 mg,299.8 mCi,92%)。1H NMR(400 MHz,DMSO-d6):δ12.03(br,1H),7.63-6.98(m,5H),4.44(s,2H),3.49-3.39(m,2H),2.30-2.15(m,2H),1.66-1.42(m,4H)。ESI-MSm/z:211[M+H]+。
2.1.25-苄氧基[羰基-14C]戊酰胺(6) 在氩气保护和0 ℃下,将5-苄氧基[羰基-14C]戊酸(5,227.4 mg)和N,N-二甲基甲酰胺(DMF,50 μL)溶于无水DCM(3 mL)中,搅拌;缓慢滴入草酰氯(418 mg)。滴毕搅拌10 min;升至室温,搅拌1 h。减压蒸除反应液中过量草酰氯,残余物以无水DCM(3 mL)稀释。在5~10 ℃下,将稀释的酰氯溶液缓慢滴入氨饱和的干燥二氧六环(diox)溶液(2 mL)中,滴毕搅拌30 min;升至室温,搅拌3.5 h。在线放射性高效液相色谱-二极管阵列检测器/质谱联用(HPLC-FSA/PDA/MS,简称HFPM)监测表明,原料(5)完全转化。向反应液中加水(30 mL),减压脱除有机溶剂,向残余液中加入饱和碳酸氢钠溶液(15 mL),以乙酸乙酯萃取(30 mL×5),萃取液经饱和食盐水洗涤、无水硫酸钠干燥、过滤、浓缩得淡黄色固体。同法重复该反应4次;共得淡黄色固体(6,943.6 mg,249.4 mCi,84%)。1H NMR(400 MHz,DMSO-d6):δ7.37-7.12(m,6H),6.65(s,1H),4.42(s,2H),3.48-3.33(m,2H),2.10-1.92(m,2H),1.64-1.29(m,4H)。ESI-MSm/z:210[M+H]+。
HPLC分析条件:SunFire C18色谱柱(5 μm,4.6 mm×250 mm);流速1.00 mL/min;波长 254 nm;柱温 30 ℃;进样量 5 μL;梯度洗脱(min/%A)控制:0/10,1/10,15/100,20/100,25/10,30/10,A为甲醇,B为0.05%甲酸水溶液。下文如无说明,HPLC分析均使用此条件。
2.1.35-羟基[羰基-14C]戊酰胺(7) 在氩气保护下,将5-苄氧基[羰基-14C]戊酰胺(6,184.6 mg)、10%Pd/C(17 mg)和甲醇(4 mL)混合,反复抽真空-氢气置换五次,向系统鼓入氢气,在室温常压下搅拌。HFPM监测显示,搅拌2 h后原料(6)反应完全。将反应混合物过滤,以甲醇淋洗滤饼5次,减压浓缩滤液得白色固体[19]。同法重复该反应4次;共得白色固体(7,499.3 mg,230.7 mCi,94%)。1H NMR(400 MHz,DMSO-d6):δ7.24(br,1H),6.70(br,1H),3.43-3.32(m,1H),2.10-1.86(m,1H),1.64-1.28(m,1H)。ESI-MSm/z:120[M+H]+。
2.1.4[羰基-14C]戊二酰亚胺(8) 将硅胶(100~200目,720 mg)、氯铬酸吡啶鎓盐(PCC,680 mg)、5-羟基[羰基-14C]戊酰胺(7,125.7 mg)和无水THF(5 mL)的混合物超声震荡(内温<40 ℃)[20]。HFPM监测表明,反应体系超声2.5 h后(7)转化完全。将反应混合物过滤,滤饼以THF淋洗3次,浓缩,浓缩物经快速硅胶层析(VMeOH∶VDCM=1∶100)得无色固体。同法重复该反应3次;共得白色固体(8,221.9 mg,106.3 mCi,47%)。1H NMR(400 MHz,DMSO-d6):δ10.64(s,1H),2.54-2.38(m,4H),1.89-1.77(m,2H)。ESI-MSm/z:116[M+H]+。
2.1.52,6-二氯[2-14C]吡啶(9) 在氩气保护下,将[羰基-14C]戊二酰亚胺(8,107.6 mg)、五氯化磷(583 mg)和三氯化磷(2.5 mL)的混合液于室温下搅拌。HFPM监测显示,搅拌13 h后原料(8)完全转化[21-22]。将反应液倒入剧烈搅拌的冰-水(50 mL)中,DCM萃取(40 mL×5),将萃取液依次用水、饱和碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,过滤后浓缩得白色固体。同法重复该反应1次;共得白色固体(9,248.3 mg,90.6 mCi,88%)。1H NMR(400 MHz,DMSO-d6):δ8.00-7.91(m,1H),7.64-7.54(m,2H)。ESI-MSm/z:150[M+H]+,152[M+2+H]+。
2.1.66-氯[2,6-14C]吡啶-2-醇(10) 在氩气保护下,将2,6-二氯[2-14C]吡啶(9,99.2 mg)、氢氧化钾(105 mg)和叔丁醇(2.5 mL)的混合液于90 ℃下搅拌。HFPM监测显示,搅拌2.5 h后反应结束[23]。减压脱除反应液中溶剂,加入水和石油醚(各50 mL),搅拌分层,以稀盐酸酸化水层(pH 2~3),经乙酸乙酯萃取(40 mL×5)、饱和食盐水洗涤和无水硫酸钠干燥,过滤,浓缩得白色固体。同法重复该反应1次;共得白色固体(10,169.8 mg,71.5 mCi,83%)。1H NMR(400 MHz,DMSO-d6):δ11.44(br,1H),7.70-7.56(m,1H),6.95-6.81(m,1H),6.63-6.50(m,1H)。ESI-MSm/z:132[M+H]+,134[M+H]+。
2.1.73,5,6-三氯[2,6-14C]吡啶-2-醇(11) 在氩气保护下,将次氯酸钠溶液(1.35 mL,活性氯≥7.5%)加入搅拌的6-氯[2,6-14C]吡啶-2-醇(10,83.0 mg)和氢氧化钾(40 mg)的水(1.50 mL)溶液中;在室温下搅拌1.5 h反应结束[24]。将反应混合物降温至0 ℃,以稀盐酸酸化(pH 2~3),搅拌10 min,过滤,滤饼用纯水洗涤3次,在40 ℃真空干燥后得淡黄色固体。同法重复该反应1次;共得淡黄色固体(11,149.0 mg,40.8 mCi,58%)。1H NMR(400 MHz,DMSO-d6):δ12.96(br s,1H),8.26(s,1H)。ESI-MSm/z:200[M+H]+,202[M+2+H]+,204[M+4+H]+。
2.1.8目标物14C-毒死蜱(1,O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C]吡啶基)硫代磷酸酯) 在氩气保护下,将二乙基硫代磷酰氯(165 mg)加入3,5,6-三氯[2,6-14C]吡啶-2-醇(11,146.3 mg)和碳酸钠(93 mg)的干燥DMF(3 mL)中,室温搅拌。HFPM监测显示,搅拌2 h原料(11)消耗完全[14,25]。以稀盐酸酸化反应液(pH 2~3),加水(30 mL),以乙酸乙酯-石油醚混合液(1∶1,V/V)萃取(35 mL×5),萃取液经饱和食盐水洗涤(40 mL),无水硫酸钠干燥,过滤后浓缩得粗品。粗品经制备型RP-HPLC纯化得白色固体(1,193.1 mg,30.2 mCi,75%)。1H NMR(400 MHz,DMSO-d6):δ8.62(s,1H),4.42-4.14(m,4H),1.32-1.25(m,6H)。ESI-MSm/z:352[M+H]+,354[M+2+H]+,356[M+4+H]+。制备色谱条件:xBridge Prep C18柱(10 μm,150 mm×19 mm),流速7.00 mL/min,波长270 nm,进样量500 μL;柱温30 ℃;梯度洗脱(min/%A)控制:0/30,1/30,18/40,21/0,24/0,27/30,30/30;A为水,B为甲醇。收集保留时间为15.450~16.423 min的组分。
2.2 同位素标记化合物的质量指标分析
2.2.1放化纯度的测定 白色固体(1)的放化纯度分别采用放射性薄层成像分析(TLC-IIA)、离线放射性高效液相色谱(HPLC-LSC)和在线放射性高效液相色谱(HPLC-FSA)法测定[26-27]。
(1) TLC-IIA分析:将白色固体(1)和毒死蜱标样在同一硅胶薄板(20 cm×5 cm)上连续展开4次;TLC条件:二氯甲烷/石油醚(VMeOH∶VDCM=1∶100)。在UV灯下,在该层析板上两个样品均显示一个规则的斑点(Rf=0.64);将该层析板进行成像,该硅胶板上仅显示一个规则的放射性斑点(Rf=0.64)。
(2) HPLC-FSA分析:准确称取9.63 mg白色固体(1),以甲醇溶解并定容至100.00 mL,得母液。将母液稀释至10 μg/mL,取10 μL进行HPLC-FSA分析。流动液闪采用Optiphase HiSafe 3闪烁液,流速为8 mL/min。白色固体(1)在HPLC-FSA色谱图中均显示1个色谱峰,保留时间为7.318 min。HPLC色谱条件:SunFire C18色谱柱(5 μm,4.6 mm×150 mm,美国沃特世公司);梯度洗脱(min/%A)控制:0/45,1/45,15/100;其余条件同2.1.2节。
(3) HPLC-LSC分析:取10 μL白色固体(1)稀释液(10 μg/mL)进行HPLC分析,用自动接收器收集洗脱液,每隔20 s收集1份,用LSC分别测定各收集液活度。HPLC色谱条件同HPLC-FSA分析。根据测定结果绘制(1)的离线放射性高效液相色谱图,结果如图3所示。在图3中,保留时间为420~460 s之间呈现1个放射性色谱峰(对应收集液为第21~23份)。根据该色谱峰对应物质的总活度与10 μL白色固体(1)稀释液(10 μg/mL)活度的比值即放化纯度;平行分析3次,取其平均值作为白色固体(1)的放化纯度。

图3 放射性同位素碳-14标记毒死蜱(1)的离线放射性高效液相色谱图(HPLC-LSC)Fig.3 Offline radio-chromatogram (HPLC-LSC) of the carbon-14 labelled chlorpyrifos (1)
2.2.2化学纯度的测定 白色固体(1)属于高比活度标记物,采用HPLC-UV色谱图中色谱峰面积归一法确定其化学纯度。结果如图4所示,(1)的保留时间为7.351 min。色谱条件同2.2.1节。

图4 放射性同位素碳-14标记毒死蜱(1)的高效液相色谱图(254 nm)Fig.4 High performance liquid chromatogram of radioisotope carbon-14 labelled chlorpyrifos (254 nm)
2.2.3比活度的测定 白色固体(1)的比活度按照文献方法测定[26]。
3 结果与讨论
以[14C]碳酸钡为放射性同位素原料,通过格氏反应、亲核取代、分子内环化反应、脱水芳构化、亲电氯代等9步放化反应获得碳-14标记毒死蜱粗品,经反相高效液相色谱纯化获得白色固体(1,30.2 mCi,总放化收率为11%)。白色固体(1)的核磁共振氢谱与毒死蜱标样一致;HPLC-FSA/PDA/MS分析显示(1)的相对分子质量比毒死蜱大2,且放射性高效液相色谱保留时间与毒死蜱标样的HPLC保留时间一致。据以上分析结果并结合标记物的合成技术路线可确定,白色固体(1)为目标物碳-14标记毒死蜱(O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C]吡啶基)硫代磷酸酯)。TLC-IIA、HPLC-LSC、HFPM和LSC分析表明,标记物(1)的放化纯度和化学纯度均大于98%,比活度为55.2 mCi/mmol,该质量指标满足下游示踪试验的要求,因而标记物(1)可作为放射性示踪剂,可替代文献中报道的标记物(O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C2]吡啶基)硫代磷酸酯[14]),用于毒死蜱的药代动力学、生态环境安全与污染消减机制等问题的研究。
碳-14是利用同位素示踪法研究农医药的代谢与安评中常用的核素,合成碳-14标记农医药首先需要考虑的是标记位置的选择[12-13]。需要指出的是,选用不同的标记位置的碳-14标记物,则下游示踪试验的结果往往有所不同;而碳-14标记位置选择不当,则会引起下游试验结果与客观情况有所偏差,甚至导致结论谬误。例如,文献报道的乙基碳-14标记毒死蜱(2,O,O-二[1-14C]乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,见图1)合成步骤少,成本低,但其中[1-14C]乙氧基标记片段通过磷酸酯键与吡啶环相连,因其易从分子骨架脱落而无法满足生物体(植物、哺乳动物和家禽)、水体-土壤环境中大多数代谢试验对示踪剂的要求[28]。
在用于代谢试验的碳-14标记农医药合成中,通常根据农医药母体分子的化学结构将其划分为若干标记单元(即分子中标记相对牢固的位置),然后依据标记合成的必要性、可行性、标记难度及实验目的和要求在各个标记单元内选择恰当的位点进行标记。对于含一个标记单元的农药,仅需对标记单元中任意一个位点的碳原子进行标记;对于含两个或多个标记单元的农药,则需要对各个标记单元分别进行标记,标记位点可选择标记单元中任意一个碳原子[6]。考虑到研究成本和实验目的,笔者均从每种农药中均选取两个标记单元分别进行标记,且以芳环标记为主[6-10,17,26-27];而仅有少数碳-14标记物,如毒死蜱、精草铵膦、利谷隆、氟啶虫酰胺、丁噻隆和特丁津,均含一个标记单元,仅需选取标记单元内任意一个位点进行标记。碳-14是自旋量子数为0的非磁性核,无核磁共振现象,因而无法利用核磁共振碳谱直接确定碳-14标记物中碳-14的位点。尽管综合利用核磁共振定量碳谱、质谱和液体闪烁测量等技术可间接地推测碳-14的位点,但因分析过程所需样品较大而放射性标记物通常均为微量,因而确定未知来源的放射性物质中碳-14位点往往难以实现[29]。当前,国际上确定碳-14标记物中碳-14位点的最可靠方法是将标记合成技术路线与其他分析手段相结合,综合分析确定。
香草硫缩病醚(12)、毒死蜱(13)和氟啶虫酰胺(14)分子中的标记单元示于图5。本研究选取具有芳香性的吡啶环为标记位置,以吡啶环中2,6-位碳为标记位点,这种标记较为牢固,碳-14不易从吡啶环脱落,可满足大多数示踪试验的要求。相比较而言,采用标记生物大分子常用的核素碘-131标记毒死蜱,合成简单,成本低,但碳-14标记毒死蜱(1)的理化性质和生物学性质更贴近毒死蜱,标记物的物理半衰期更长,稳定性更高,因而更适合于下游示踪试验[30]。

图5 香草硫缩病醚(12)、毒死蜱(13)和氟啶虫酰胺(14)分子中的标记单元Fig.5 Radiolabelling units of XCLSBM (12), chlorpyrifos (13) and flonicamid (14)
文献报道碳-14标记毒死蜱(O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C2]吡啶基)硫代磷酸酯)制备方法中起始同位素原料[14C]氰化钾为剧毒品,且[14C]氰化钾与1,3-二溴丙烷制备[1,4-14C2]戊二腈的亲核取代反应非常缓慢,长达65 h;[1,4-14C2]戊二腈在210 ℃高温下反应18 h方可制得[1,4-14C2]戊二酰亚胺,因而反应条件非常苛刻[14]。在本研究中,以[14C]二氧化碳在低温下进行反应,经过3步接近常温常压条件制备了[1-14C]戊二酰亚胺,反应速度较快,且反应易于控制。文献报道中间体[2,6-14C2]氯吡啶必须用剧毒的氯气在高压釜内高温进行氯化,操作具有潜在的危险性,而本研究在室温常压条件下采用次氯酸体系对[2,6-14C]三氯吡啶醇(10)进行氯化,进而通过在碱性条件下与二乙基硫代磷酰氯反应而获得目标物(1)。
4 结论
以[14C]碳酸钡为放射性同位素原料,通过9步放化反应获得碳-14标记毒死蜱(1,O,O-二乙基-O-(3,5,6-三氯-2-[2,6-14C]吡啶基)硫代磷酸酯,30.2 mCi),反应总收率为11%。该标记物的技术指标满足下游同位素示踪试验的要求,因而它可作为放射性示踪剂,用于毒死蜱的药代动力学、生态环境安全与污染消减机制等问题的研究。

