实时荧光核酸恒温扩增技术和实时荧光定量聚合酶链反应检测解脲脲原体的效果比较
陈娟 王庭强 张诗颜 黄咏 张袁露
支原体是生物界最小的一种原核微生物,可生长、繁殖于无生命培养基,解脲脲原体(Ureaplasma urealyticum,UU)、生殖道支原体等均属于支原体,主要分离于泌尿生殖道,会造成泌尿生殖道疾病,可引发30%~40%的男性非淋菌性、非衣原体尿道炎[1]。在性传播疾病中,UU感染较为常见,近年来发生率日益升高。在UU检测中,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)是近年来应用最广泛的技术之一,但由于采集样本是分泌物拭子,采样过程中易产生损伤,而无损伤采集的样本进行qRT-PCR敏感度不高,且存在一定假阳性概率,因此临床上有必要寻找一种高敏感度、高特异度,同时可降低假阴阳概率且适用于检测病原微生物含量较低标本的方法[2]。本研究统计分析了2018年1月—2020年1月就诊于我院的89例疑似UU感染患者的临床资料,旨在评估实时荧光核酸恒温扩增技术(simultaneous amplification and testing,SAT)和qRT-PCR对UU的检测效果,现报告如下。
1 资料与方法
1.1 研究对象及一般资料 选择2018年1月—2020年1月本院收治的89例疑似UU感染患者,其中男性30例(占33.7%),女性59例(占66.3%);年龄19~58岁,平均(38.5±6.4)岁。
1.2 试剂与仪器 ABI 7500荧光定量PCR仪(美国应用生物系统公司),SAT试剂盒购自上海仁度生物科技有限公司,qRT-PCR试剂盒购自广州达安基因股份有限公司。
1.3 检测方法
1.3.1 尿液样本采集 取患者清晨首次尿液,或长时间(至少1 h)不排尿后的首段尿标本2 mL。采集的样本在2~30 ℃条件下于24 h内送至实验室加入样本保存液,制备成待测样本(RNA在菌体死亡后很容易发生降解,标本须在24 h内加入保存液)。
1.3.2 分泌物拭子采集 男性患者采集分泌物时用棉拭子在尿道内停留15 s,取出时均匀旋转3周;女性患者采集阴道内分泌物或宫颈口内2 cm处分泌物。将采集的棉拭子置于无菌试管中立即送检。
1.3.3 样本保存 标本采集后24 h内将尿液与样本保存液1:1混合(2 mL尿液加入样本保存管至红色刻度线附近),所取分泌物拭子加入1 mL生理盐水。加入保存液后的待测样本在2~8 ℃下保存不应超过7 d,-20 ℃下保存不超过3个月,-70 ℃下可长期保存,避免反复冻融。
1.3.4 操作步骤 对所有患者尿液标本进行SAT检测,并对比同一患者分泌物标本的qRT-PCR结果,差异样本进行第三方鉴定。① SAT:洗脱拭子样本,置于37 ℃、5% CO2培养箱培养1~2 d。混匀400 μL尿液或分泌物(加有保存液)+100 μL核酸提取液,在60 ℃下恒温、室温分别放置5 min、10 min,在磁珠分离器上静置5 min,加入洗涤液洗涤2次。置于半自动核酸提取仪上提取RNA,然后吸取含磁珠的30 μL扩增检测液,放置于8连管中,加入42 ℃预热的SAT酶液,在42 ℃下进行40 min实时恒温扩增。②qRT-PCR:加入1 mL生理盐水样本振荡数秒,将液体转移至1.5 mL离心管中,以12 000 r/min(离心半径11 cm)离心10 min,弃去上清,加入50 μL核酸提取液,100 ℃金属浴中煮沸10 min,以1 000 r/min(离心半径11 cm)离心5 min,取5 μL上清液进行qRT-PCR。
1.4 结果判读 ① SAT:依据阈值线与样本曲线交点的横坐标读数(dt),dt≤35为阳性(UU携带者),dt≤界值参考品dt值表明样本中UU≥104 cfu/mL,需进行临床干预;35<dt<40建议重新检测,dt<40为阳性,无数值或dt=40为阴性[3]。② qRT-PCR:根据阳性参考对照曲线,每个反应管内荧光信号到达设定阈值时所经历的循环数(Ct值)无数值为阴性,Ct值<30.0为阳性[4]。
1.5 统计学方法 使用SPSS 21.0统计软件分析数据,符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以例或率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 SAT和qRT-PCR检测UU阳性率比较 89例疑似UU感染的临床标本中,使用尿液标本的SAT阳性检出率明显高于拭子标本的qRT-PCR阳性检出率(P<0.05)。见表 1。

表1 SAT和qRT-PCR检测UU的阳性情况比较
2.2 SAT和qRT-PCR对UU的诊断效能 89例疑似UU感染的临床标本中,临床诊断阳性59例,阴性30例,SAT法检测阳性62例,阴性27例;qRT-PCR检测阳性46例,阴性43例。以临床诊断作为“金标准”,SAT检测的敏感度为100.0%(59/59),特异度为 90.0%(27/30),准确度为 96.6%(86/89),阳性预测值为 95.2%(59/62),阴性预测值为 100.0%(27/27);qRT-PCR检测的敏感度为78.0%(46/59),特异度为100.0%(30/30),准确度为 85.4%(76/89),阳性预测值为 100.0%(46/46),阴性预测值为 69.8%(30/43)。SAT检测的敏感度、特异度、准确度、阴性预测值均明显高于qRT-PCR(均P<0.05),阳性预测值和特异度均低于qRT-PCR(均P<0.05)。见表2~3。
3 讨论
生殖道支原体感染与男性前列腺炎、女性宫颈炎等密切相关[5]。在UU检测中,qRT-PCR是临床通常采用的方法,qRT-PCR的检测原理是在原有PCR的基础上增加了一条荧光探针,在扩增时荧光探针与病原体的一条DNA链结合,当引物延伸时,外切酶切断荧光探针中的荧光基团,此时荧光基团发光,通过拍照设备获得图像,检测荧光强度,从而反映病原体的产物量[6]。在对UU进行检测的过程中,qRT-PCR只能采用拭子样本,取样过程具有侵入性,给患者造成一定痛苦。但由于qRT-PCR操作简便、较为经济,同时能够降低产物污染,因此现阶段在临床实验室检测中较为常用[7]。SAT是指靶标RNA在反转录酶作用下反转录合成一条包含T7启动子的双链DNA,T7 RNA聚合酶以这条双链DNA为模板进行转录,每个RNA可以扩增出100~1 000个拷贝的RNA。合成所得的RNA与分子信标结合,发出荧光,可以被荧光检测仪检测到[8]。与此同时,新合成的RNA继续在反转录酶和T7 RNA聚合酶的作用下循环反转录和转录的过程,如此往复,以达到高效扩增的目的[9]。SAT的检测样本可以为泌尿生殖道分泌物,也可以为尿液,而尿液取样具有非侵入性,可以让受检者自行取材,一方面能减少医生工作量,另一方面还能避免拭子取样给患者造成的痛苦,易为患者所接受。
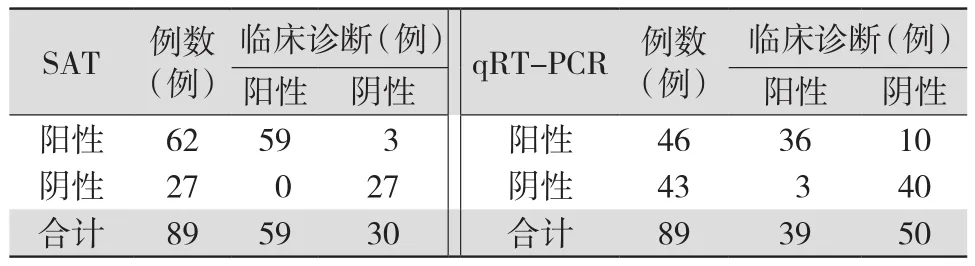
表2 SAT和qRT-PCR检测UU的效果与临床诊断比较

表3 SAT和qRT-PCR对UU的诊断效能比较
有研究显示,在UU检测中,SAT具有较高的准确性,能有效满足快速、简便的实验要求,且SAT的检测样本可以为尿液,因此临床应用价值较高[10]。本研究结果表明,实验方案共验证89例疑似UU感染临床标本,其中SAT法(尿液标本)共检出62例阳性,阳性率为69.7%;qRT-PCR(拭子标本)共检出46例阳性标本,阳性率为51.7%。SAT法阳性率高于qRT-PCR,且qRT-PCR检出阳性的标本SAT均检出阳性。SAT法检测的敏感度、准确度、阴性预测值均高于qRT-PCR,阳性预测值低于qRT-PCR,与上述研究结果[10]一致,表明SAT法在UU检测中具有较高的阳性率、敏感度、准确度和阴性预测值,同时还具有检测速度快、取样方便的优点。SAT属于一种新型RNA检测技术,有机结合了实时荧光检测与RNA恒温扩增技术,运用磁珠法特异性提取尿液样本中的UU RNA,不需要高温加热和高速离心,具有较高的提取效率。同时,RNA在常规环境中易降解,交叉污染较少,能有效解决污染引发的假阳性问题,也能为监测临床疗效提供有利条件。此外,SAT采用水相洗涤,可特异性捕获靶标,具有较少的反应抑制物,能有效降低假阴性概率和提高检测敏感度[11]。
综上所述,采用SAT检测UU较qRT-PCR效果更好,值得在临床推广。
利益冲突 所有作者均声明不存在利益冲突

