CYP2C19基因多态性和ApoE基因分型检测质量控制品的制备
郝繁运
CYP2C19基因多态性检测可用于氯吡格雷等药物用药安全监测和用药指导,ApoE基因分型检测结果可以作为心脑血管疾病及阿尔兹海默病(Alzheimer's disease,AD)临床辅助诊断和风险评估的重要指标。CYP2C19基因多态性和ApoE基因分型检测已被越来越多的临床医师重视,因此,准确检测CYP2C19基因多态性和ApoE基因分型至关重要,但目前在临床检测工作中缺少准确可靠的商用质量控制(质控)品,因此,本研究使用医院血库制备滤膜的收集物,进行基因检测质控品的研制,取得预期效果[1-4],现报告如下。
1 自制质控品的标本来源
为获得稳定的质控品来源,本研究对医院血库制备“去白细胞红细胞”后弃留在过滤器滤膜上的白细胞进行提取[5],作为自制质控品的标本来源。自制质控品采用来自健康献血者的标本,而非提取后的DNA,目的在于进行实验全流程质控,包括核酸提取阶段和聚合酶链反应(polymerase chain reaction,PCR)阶段。
2 自制质控品的制备与分型检测
2.1 仪器与试剂 美国应用生物系统公司生产的ABI 7500实时荧光定量PCR仪(已校准,该检测系统已经通过性能验证和室间准确性比对);CYP2C19基因多态性试剂盒(批号:20181001H,武汉海吉力生物科技有限公司),ApoE基因分型试剂盒(批号:AE201811005,厦门人瑞生物医药科技有限公司)。
2.2 标本收集 使用无菌生理盐水冲洗去白细胞过滤器,采用无菌操作将洗涤下来的液体小心收集在50 mL离心管中备用,总量约50 mL,取0.5 mL样本在血液分析仪中进行测定,以白细胞计数达到5.0×109/L为合格。本次实验共收集标本28份,测得白细胞计数都在10×109/L以上。
2.3 收集标本盲测 将收集的28份标本使用ABI 7500实时荧光定量PCR仪进行基因测试分型,采用CYP2C19基因多态性试剂盒和ApoE基因分型试剂盒进行基因扩增实验。
2.3.1 CYP2C19基因多态性的判断 本实验采用的基因扩增试剂每个标本占据1条6连管。选择1、2号管,根据每个反应管到达FAM通道(450~490 nm)信号阈值时所经历的循环数差值(∆Ct值)判断样本CYP2C19*2的基因多态性;选择3、4号管,根据FAM信号∆Ct值判断样本CYP2C19*3的基因多态性;选择5、6号管,根据FAM信号∆Ct值判断样本CYP2C19*17的基因多态性,然后根据表1判断标本的基因型。对分装的自制质控品进行核酸提取后按照基因扩增操作程序在PCR仪上机检测。
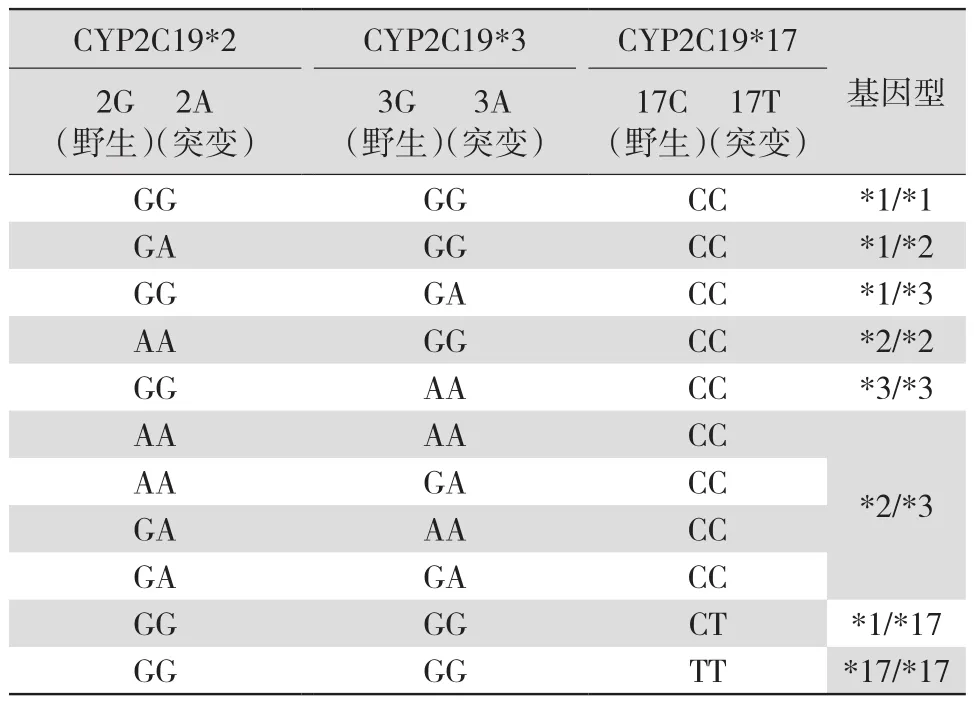
表1 CYP2C19基因多态性分型判断
2.3.2 ApoE基因分型判断 待测样品DNA内控HEX通道(515~535 nm)信号正常时观察样品在ε2、ε3和ε4基因检测试剂中的FAM信号有无曲线升起。如有扩增曲线,计算Ct和∆Ct值(∆Ct=CtFAM-CtHEX),以≤∆Ct临界值判断为阳性。见表2。
本研究筛选出25份符合要求样本,CYP2C19基因多态性检测出*1/*1基因型10份,*1/*2基因型10份,*2/*2基因型3份,*1/*3基因型1份,*3/*3基因型 1份,未检出 *1/*17、*2/*3、*2/*17、*3/*17、*17/*17基因型;筛选出27份符合要求样本中ApoE基因分型检测出ε3/ε3基因型19份,ε3/ε4基因型2份,ε2/ε3基因型4份,ε2/ε2基因型1份,ε4/ε4基因型1份,未检出ε2/ε4基因型。

表2 ApoE基因分型判断
2.4 自制质控品的制备
2.4.1 CYP2C19基因多态性检测质控品的制备取上述不同基因型(*1/*2、*2/*2、*1/*3、*3/*3)的阳性标本,分别颠倒混匀10次。室温下以2 000 r/min(离心半径为15 cm)离心30 min。然后用一次性塑料吸管小心吸出位于红细胞和血浆层中间的白细胞层(白膜),置于5 mL双蒸水(ddH2O)中,颠倒混匀后静置10 min,使吸出的少量红细胞低渗溶血,以3 500 r/min离心15 min;吸弃上清,保留细胞层,视溶血效果可重复低渗溶血操作1~2次。合并相同基因型的白细胞,以适量(按原血标本总体积的1/2)模拟血浆重悬。充分混匀后按照每管不少于200 μL分装到0.5 mL离心管中,于-70 ℃保存备用。
2.4.2 ApoE基因分型检测质控品的制备 取上述不同基因型(ε3/ε4、ε2/ε3、ε3/ε3、ε4/ε4)的阳性标本,按照2.4.1项下方法制备ApoE基因分型检测质控品并分装,于-70 ℃保存。
2.5 自制质控品的分装 上述自制质控品按6个月量进行配制。用0.5 mL离心管分装,每支分装量应足够进行至少1次检测,在质控品外部粘贴标签,需注明质控品名称、配制日期、有效期及配制人。
3 实验评价自制质控品的方式和频率
3.1 每日取1支自制质控品作为外部阳性质控(不同基因型交替轮换使用),随日常标本进行核酸提取及PCR上机检测,外部阳性质控标本位置随机。每块反应板均需运行室内质控,包括试剂盒自带的阴性、阳性质控以及空白对照,自制质控品每日检测1次。
3.2 根据室内质控结果与已知结果的一致性判断本批次结果是否正常,报告能否发出。
4 自制质控品均匀性和稳定性评估[6-7]
4.1 均匀性评估 每批新制质控品均需进行1次均匀性评价,每个基因型质控品配制成一定浓度后混匀分装并上机检测,以不同瓶间无明显差别(本实验为判定分型结果一致)作为均匀性评价指标。每个分型标本取5瓶在1 d内进行核酸提取后扩增检测,根据试剂盒要求判读结果,定型结果与已知结果一致为合格。见表3~4。
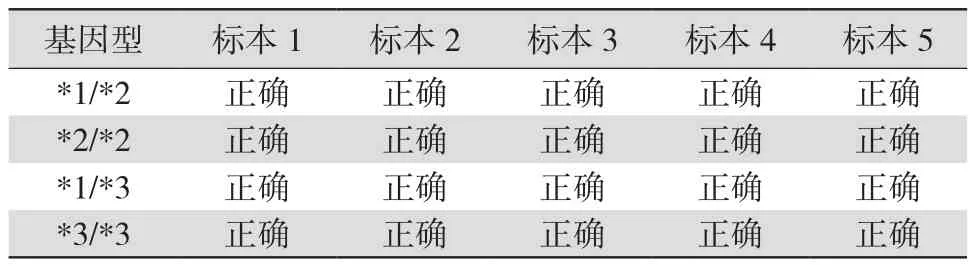
表3 CYP2C19基因多态性自制质控品同批次均匀性结果

表4 ApoE基因分型自制质控品同批次均匀性结果
4.2 稳定性评估 将自制质控品保存于-70 ℃,每批次选取3瓶进行上机检测,记录第0、1、3、6个月后检测结果,与预期阳性结果一致则为稳定性良好,稳定期为检测时间,否则将上一次检测时间作为稳定时间。见表5~6。

表5 CYP2C19基因多态性自制质控品阶段性复测结果
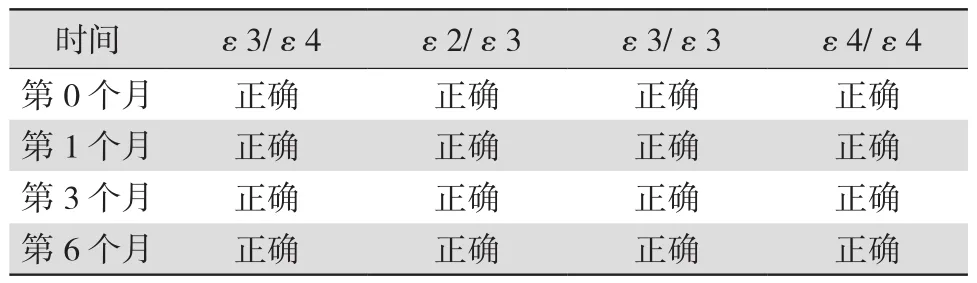
表6 ApoE基因分型自制质控品阶段性复测结果
4.3 稳定性回顾评价[8-10]定期对质控数据进行回顾性评价,每月质控小结回顾首先确认质控品的有效性。如果自制质控品Ct值有降低趋势,或无明确原因与预期结果不一致,则需停止使用并重新确认该批次质控品的有效性,更换新批次的质控品。
自制室内质控品在PCR扩增仪中的位置不能永久固定在1个孔,应尽量在每次扩增检测时进行相应顺延,使得在一定时间内可以尽可能地监测每1个孔的扩增有效性。
5 讨论
本研究以医院血库制备“去白细胞红细胞”后弃留在滤膜上的白细胞作为原料,对其进行提取,自制基因检测质控品,结果显示,自制质控品的均匀性和稳定性符合预期质量要求。并且可获得稳定充足的样本,克服通过其他渠道获得样本来源有限、不能有效监测实验反应全过程等缺点,制备的质控品在临床实验室中可用于ApoE基因分型和CYP2C19多态性检测。自制质控品需较长时间冻存,本研究未加入甘油、二甲基亚砜、血清等外源性保护剂和稳定剂,可以避免检测中可能存在的非特异性干扰。
利益冲突 作者声明不存在利益冲突

