无导线起搏器的研究现状及展望
王冬梅
世界第一例植入式心脏起搏器于1958年在瑞典的斯德哥尔摩Karolinska医院植入,从此开创了心脏病领域起博器治疗的新纪元。其后经过60多年的努力,心脏起搏器领域今非昔比,战果辉煌。从单腔起搏器到双腔起搏器至三腔起搏器,从非生理性到半生理性至生理性起搏,从治疗心动过缓到心动过速至心力衰竭的同步化治疗,从远离核磁到磁共振兼容,从单位点起搏到多位点起搏。起搏器体积越来越小,外形越来越圆滑,电池寿命越来越长,功能越来越智能化。起搏电极导线也有明显进步,导线越来越细,抗压性及抗磨损性越来越强,起搏极性越来越多(从单级到双极至四级),起搏向量组合越来越广(数十种向量组合)。虽然如此,电极导线还是有一些无法避免的并发症。如:导线磨损及断裂,起搏器囊袋破溃和感染,穿刺血管的血栓及堵塞及疤痕局部疼痛等。更有甚者是电极导线所致的大量三尖瓣反流,致使患者右心功能急剧恶化,乃至死亡。此外,如果患者静脉系统存在解剖缺陷或更换起搏器时血管完全阻塞,则无法经静脉植入起搏器,这些患者,要么采用创伤更大的开胸植入导线方式,要么丧失了起搏器治疗的机会。总之,起搏导线问题给临床医师和患者带来极大困扰,也激励着科学家们不断探索、勇于创新,终于在21世纪迎来了心脏起搏器领域的新飞跃---无导线起搏器的诞生。起搏器领域的长足进步,给广大患者带来巨大生机,在全球挽救了数百万患者的生命。
无导线起搏器系统的发展也历经艰难,早在20世纪70年代,无导线起搏器的雏形已进入临床前期的动物实验(图1)[1]。经过40年漫长的研发,终于在2012年NanostimTM(St.Jude Medical,USA)无导线起搏器系统用于临床试验(LEADLESS研究,欧洲多中心,目前已撤回)[2],随后2013年Micra TPS(Medtronic,USA)的临床研究开始,并取得了较为理想的结果。美国FDA于2016年4月批准Micra TPS产品临床应用(图2)。Micra TPS无导线起搏器是集脉冲发生器与起搏电极于一体的新型起搏器,无需静脉植入心内膜导线,而是以微缩胶囊的形式通过股静脉经导管植入患者的心腔内,因此也无需皮下切口和囊袋。微缩胶囊的体积和重量是传统起搏器的1/10左右(体积:0.8cc),预估平均寿命为12年以上,其功能与传统的心室单腔起搏器基本相同,同样具有频率应答、自动阈值管理及磁共振兼容等功能,开始仅有单腔VVIR模式。MicraTPS系统的临床试验表明,手术成功率为99.2%,主要并发症为4.0%,比传统起搏器的主要并发症降低了50%以上[3-5]。但对术者及其团队要求较严格,术者需在熟练植入传统起搏器的基础上进行专门培训,才有资格完成无导线起搏器植入术;团队必须具备救治心脏及血管严重并发症的能力。

图1 右室心腔内无导线起搏器

图2 Micra TPS无导线起搏器及输送系统
然而,在全球的起搏器应用中,单腔起搏器仅占起搏器植入量的15%左右,房室同步性起搏可以减少房室传导阻滞(AVB)患者起搏器综合征的发生率,并能增加心排量,对心功能状态及生活质量均有益处。于是,研究者们开始研发房室同步化的无导线起搏器,首先想到了通过MicraTPS系统的加速度传感器(三轴加速度传感器,ACC)来感知心房收缩。MASS和MASS2研究证实了ACC感知心脏活动主要通过以下4个心脏活动阶段来实现的,A1:心室等容收缩和三尖瓣/三尖瓣关闭;A2:主动脉/肺静脉瓣关闭;A3:心室被动充盈;A4:心房收缩产生的主动充盈。起搏器进行同步化运算,提供类似VDD的起搏支持[6]。MARVEL研究结果显示:运用AV运算达到平均房室同步效果的比例为87%,其中永久性AVB患者为80.0%,有自身房室传导的患者为94.4%。经心脏超声证实通过AV运算达到的房室同步与VVI起搏比较,左室流出道血流速度积分(VTI)明显增高(23.9vs. 21.8 cm;P=0.004)[7]。
Micra AV于2020年1月在美国FDA批准上市。尽管MicraTPS系统实现了房室同步功能,但却无法完成心动过缓的心房起搏功能。为了实现具有心房起搏功能的无导线双腔起搏器,研究者们想到了是否可以在双心腔应用双无导线起搏器?此理念基于身体是具有生物传感器的网络,通过心肌和血液作为传播介质,在两个电极间传递电流藕联信号,起搏电极负责接收和传递信息。2018年Bereuter等[8]报道了双无导线起搏电极进行房室同步起搏的动物实验(猪)结果,实验于右心房及右心室心外膜各放置一个无导线电极,起搏器设置DOO模式起搏,起搏心率120 bpm,AV间期设置50 ms,心电图显示房室同步顺序起搏(图3)。此实验为无导线双腔起搏器的研发提供了良好的平台,但仍存在很多尚未解决的问题,如心外膜针样电极怎样被心内膜电极替代;电极的阳极被血液包绕,血液的阻抗虽低,但仍存在着信号衰减现象,信号衰减可增加能量消耗等。因此,过渡到临床尚需时日。
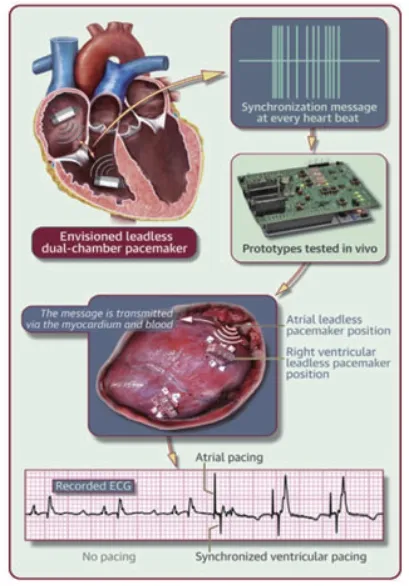
图3 无导线双腔双起搏电极房室同步起搏
心脏在同步化治疗(CRT)慢性心衰具有跨时代意义,但仍有30%患者无应答,经冠状窦植入左室电极导线的脱位率为8%~10%[9,10],还有因血管问题导致手术植入的失败率。这些需要亟待解决的问题,使研究者们开始尝试在左室心内膜植入电极导线,方式为穿房间隔或室间隔。但由于手术过程复杂,易发生并发症,此外,即使在长期高标准(INR在3~4)的抗凝治疗情况下,仍存在血栓事件的风险。因此,该种方法在临床上一直未能推广应用。无导线起搏器的研发,为CRT治疗无应答或植入失败的患者带来了希望。WiSE-CRT系统是基于WiCS-LV system(EBR Systems Inc.左室心内膜无导线电极)的左室心内膜起搏联合传统起搏器或埋藏式心律转复除颤器(ICD)来共同实现双心室同步起搏,左室心内膜起搏的能量是来自于超声波能量的转换。左室心内膜无导线电极植入方法是经股动脉逆行送入左室腔内,检测R波振幅及阈值(窦性心律R波感知>5 mV,起搏阈值<3 V),释放电极,电极通过锚状结构固定在左室内膜。再将脉冲发生器放置在肋间隙合适的超声波窗口(>2 cm)区,其与左室电极成角在±50°内,两者距离<10 cm,并固定在皮下组织内,同时将与脉冲发生器相连接的电池固定在胸部侧壁的皮下组织内。当WiCS-LV系统的脉冲发生器检测到右室R波后被立即触发,发出与右室起搏同步的超声能量,左室心内膜无导线电极接受超声能量后转换成电能,并起搏左心室,右室激动至左室激动的延迟时间约为 3 ms,预估电池寿命在2.5~5.0年(图4)[11-14]。
2010年10月Auricchio等[14]植入了全球第1例WiSE-CRT的左心室心内膜无导线电极,2013年开始了WiSE-CRT的临床研究,入选标准:经冠状窦左室电极植入失败,CRT无反应,起搏器或ICD需要升级为CRT。共入选17例患者,手术成功率为76.5%(13/17)。左室心内膜电极参数为:平均R波振幅5.6±3.2 mV,平均起搏阈值1.6±1.0 V。在术后1和6个月双心室起搏比例分别为83%和92%,QRS间期缩窄了41 ms(P=0.001)。术后6个月时2/3患者NYHA心功能改善至少1级,左室射血分数(LVEF)明显改善(25%±4.0%)vs.(31%±7.0%),P=0.01。4例手术失败,3例心脏破裂伴血流动力学不稳定,其中1例死亡。其它与手术和器械相关的不良事件4例[15]。此试验虽然具有较好的临床疗效,但因严重并发症较高而被提前终止。
针对WiSE-CRT研究中手术相关并发症较多的问题,研究者们引以为戒,对WiCS-LV的递送鞘管进行了改进,将输送鞘管头端装有一个聚酯防损伤的充气球囊,并再次进行临床研究。SELECT-LV研究也是入选均为经静脉左室电极植入失败或CRT无应答患者,观察术后6个月内的安全性及治疗有效性。35例患者进行了左室心内膜无导线电极植入,成功率为97.1%(34/35例),平均植入脉冲发生器和左室电极的时间分别为(85±35)和(58±24)min,术后QRS时限明显缩窄(169.9±29.2)vs. (142.6±27.3)ms,(P<0.001)。达到双心室起搏患者占97.1%(术后1个月)和93.9%(术后6个月),术后6个月84.8%的患者临床综合指标明显好转,LVEF、左室舒张末容积(LVEDV)和左室收缩末容积(LVESV)均明显改善(P均<0.02),再住院率为3.0%(1例),临床综合评分(死亡率、心衰住院率、心功能等)较术前提高80.8%。并发症13例(38%),其中因电极头端导致室颤死亡1例,左室电极导致血栓并脱落到下肢至动脉栓塞1例,脑卒中1例(房颤术后未服华法林),其它与手术和器械相关的并发症10例,但无心脏破裂发生[16]。该研究的治疗效果显著优于传统CRT,虽无严重的心脏穿孔事件,但其它的相关并发症也较高,仍需继续验证其安全性。
WICS-LV系统首先在欧洲获得CE认证,用于无法常规植入CRT或CRT无反应的患者。2015年11月开始的WICS-LV上市后的国际多中心注册研究,也是目前左室心内膜无导线起搏的最大型研究,共入选90例患者,其中常规经静脉CRT植入失败(48.9%),复杂升级(37.8%),13.3%的患者为心外膜CRT无反应者。随访6个月,结果显示,手术成功率94.4%。临床症状改善69.8%,综合评分无变化14.0%,综合评分恶化4.7%。死亡5例(5.6%),其中3例(3.3%)判定为与操作/器械相关。其他并发症22例(24.44%),12例(13.33%)与操作/器械相关[17]。本研究再一次证实了WiSE-CRT治疗心衰的有效性,但并发症发生率仍较高,一半以上的并发症与与操作/器械相关,甚至导致死亡。并且发现WICS-LV的大部分并发症(76%)发生在该中心植入的前10例患者,说明并发症的发生率与术者手术技能的熟练程度相关。因此,术者应得到足够的训练,在初始的学习曲线中,必须具备处理血管及心胸系统并发症的能力。
WiCS-LV系统的无导线左室心内膜起搏的优势:明显减少膈肌刺激,避免左室电极导线导致的血栓形成及二尖瓣返流,并可多处选择起搏位置,与生理性电传导更接近,CRT应答率较高,不需终身抗凝。存在问题包括:手术操作复杂,并发症较多(包括危及生命的并发症),超声波穿透力弱,超声窗口与左室电极的定位关系尚需探讨,附件体积较大,电池寿命和长期的阈值还需临床验证。目前仅适用于CRT经静脉左室电极植入失败及CRT无应答的患者。
以上的CRT研究均是无导线左室心内膜起搏联合应用传统起搏器或ICD的结果,并没有实现CRT治疗的全无导线化。近期报告了1例全无导线的起搏器系统进行CRT治疗,患者既往因心衰伴房颤植入CRTD,并行房室结消融(患者成为起搏器依赖)。曾更换过2台CRTD,后期因囊袋感染拔出原来的起搏装置。因CTA显示双侧锁骨下静脉闭塞,于右室心尖部植入了无导线起搏器(Micra,VVIR),术后起搏的QRS间期250 ms,导致心衰反复发作住院,LVEF降至15%,决定植入WiCS-LV系统。无导线电极植入左室侧壁(阈值1.5 V,QLV间期240 ms),与右室心尖的Micra起搏器同步后QRS间期降至161 ms(图5)[18]。本例报告开拓了全无导线双心室起搏的先河,使全无导线的CRT治疗成为可能。但由于全无导线的双心室起搏治疗仅是个案报道,尚需临床试验观察其长期疗效及安全性。

图5 白色实剪头是左室侧壁的WiCS -LV无导线左室电极,黄色空箭头是右室心尖的Micra TPS无导线起搏器
无导线起搏器从设想、研发到临床应用走过近50年的历程[19]。虽然目前临床试验数据较少,观察时间尚短,长期并发症和更换方式均不清楚。但无导线起搏器已成为事实,并于2019年11月在我国上市。无导线的房室同步功能和双心室起搏治疗虽有雏形和研究方向,但道路艰辛并曲折。研究者们会汲取精华、去除糟粕、坚忍不拔的走下去。我们期待着心脏起搏领域全无导线产品的来临,尽管任重而道远,我们坚信这一造福于全人类的愿望一定能够实现。

