硫胺素对鲁氏接合酵母高盐适应性的影响
姚婉婷,李 可,宋 娜,王 慧,卢慧芳,陈 雄,李 沛,姚 娟,代 俊
(1.湖北工业大学 生物工程与食品学院 发酵工程教育部重点实验室,湖北 武汉 430068;2.安琪酵母股份有限公司,湖北 宜昌 443000)
酱油因其独特、浑厚、浓郁的风味,在食品调味方面起着十分重大的作用,已成为东方饮食的主要调味品之一[1]。酵母是产风味物质的主要微生物,在酱油酿造过程中,具有产醇、产香、增鲜等作用[2]。然而高盐稀态酿造酱油是在高盐条件下进行的,因此提高酱油酵母的高盐适应性,是酱油产生高风味成分的关键因素之一[3]。鲁氏接合酵母(Zygosaccharomyces rouxii)是一种常用于酱油发酵的耐盐芳香型酵母,能代谢产生醇、醛和酯,影响发酵酱油的风味[4]。然而酱油酿造过程中的盐胁迫会减少Z.rouxii的细胞生长并影响其发酵性能,减少风味的产生。
为了加速发酵过程中香味物质的形成,需要提高增香酵母的生物量控制发酵过程。因此,提高Z.rouxii的高盐适应性对于增强酱油发酵至关重要。Z.rouxii在盐胁迫下表现为胞内积累钠离子胁迫和渗透压胁迫[5],其耐盐机制主要有:一是产生胞内渗透压调节物;二是通过Na+/K+-三磷酸腺苷(adenosine triphosphate,ATP)酶和Na+/H+反转运蛋白调节胞内阳离子的动态平衡[6]。研究表明,细胞会采取一些策略来抵御盐胁迫,如调节细胞内微环境、细胞膜和细胞代谢等[7]。硫胺素即维生素B1(vitamin B1,VB1),是所有生物体的重要化合物,其功能形态焦磷酸硫胺素(thiamine diphosphate,TDP)在细胞代谢中的行使多种辅助功能[8]。据报道,TDP依赖性酶如转酮酶或α-酮戊二酸脱氢酶影响细胞氧化还原状态[9]。LUKIENKOP I等[10]研究发现,硫胺素能发挥更直接的作用,其能与自由基潜在相互作用而被氧化,导致三环硫色素(tricyclic thiochrome)的形成,显示出抗氧化性质。
本研究通过额外添加一定量的硫胺素,研究Z.rouxii菌株的生理代谢过程,从而探讨在高盐胁迫下,硫胺素对鲁氏接合酵母高盐适应性的影响,以期为增加食品工业酱油的风味品质提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
鲁氏接合酵母(Zygosaccharomyces rouxii)CCTCC M2013310:湖北工业大学功能酵母与酿造微生物研究室[4]。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸粉10g/L,葡萄糖20g/L,蛋白胨20 g/L。固体培养基中加入琼脂20 g/L。
1.1.3 试剂
酵母浸粉(生化试剂):赛默飞世尔科技有限公司;葡萄糖(生化试剂)、氯化钠(分析纯)、无水乙醇(分析纯):国药集团化学试剂有限公司;蛋白胨(生化试剂):北京双旋微生物培养基制品厂;硫胺素、三氯乙酸(均为分析纯):上海麦克林生化科技有限公司;液体样本甘油含量酶法测定试剂盒:北京普利莱基因技术有限公司;腺苷三磷酸(adenosine triphosphate,ATP)酶试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
WFJ2000型可见分光光度计:尤尼柯(上海)仪器有限公司;YXQ-LS-100SⅡ型高压蒸汽灭菌锅:上海博讯实业有限公司;5810R型高速冷冻离心机:德国Eppendorf公司;SBA-90型生物分析传感仪:山东省科学院生物研究所;7890B型气相色谱(gas chromatography,GC)仪:安捷伦科技(中国)有限公司;ZA3300型原子吸收光谱仪:日本HITACHI公司;Ultimate 3000型高效液相色谱(high performance liquid chromatography,HPLC)仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 鲁氏接合酵母种子液的制备
将鲁氏接合酵母接种于5 mL YEPD培养基,30 ℃、200r/min条件下培养24h,按5%(V/V)的接种量接种于YEPD培养基,装液量50 mL/250 mL,30 ℃、200 r/min条件下培养12 h,作为二级种子液备用。
1.3.2 硫胺素浓度的确定
由于Z.rouxii在含180 g/L NaCl的YEPD平板上生长状态较差,因此,选用含140 g/L NaCl的YEPD平板探究不同质量浓度硫胺素的添加对鲁氏接合酵母生长的影响。
将二级种子液采用10倍梯度稀释法稀释至10-1、10-2、10-3,在加入不同质量浓度硫胺素(0、0.5 mg/L、5 mg/L、50 mg/L、0.5 g/L、5 g/L、10 g/L)的含140 g/L NaCl YEPD固体培养基平板上点样0.8 μL,30 ℃静置培养60 h,观察菌落的生长情况。
1.3.3 高盐胁迫下鲁氏接合酵母显微形态观察
将二级种子液按5%(V/V)的接种量分别接种于含有180 g/L NaCl的50 mL YEPD培养基(对照组)、含有5 g/L硫胺素和180 g/L NaCl的50 mL YEPD培养基中(试验组),30 ℃、200 r/min条件下发酵,取不同生长阶段的发酵液备用。取适量发酵液涂布于载玻片中央,盖上盖玻片在微分干涉对比(differential interference contrast,DIC)显微镜下观察酵母的形态特征。
在载玻片中央滴加一滴1 g/L亚甲蓝染液,取适量待观察菌液置于染液中,混匀后放置3 min,在明场(bright field,BF)镜头下观察细胞并根据细胞颜色区分死活细胞。
细胞周期中取样点的确定:首先根据菌株不同培养条件下的生长曲线确定其生长周期各阶段;再根据细胞在不同培养条件下细胞周期阶段中相似的时间点取样。对照组:延滞期时取样时间点为12 h、对数期取样时间点为36 h、稳定期取样时间点为72 h;试验组:延滞期取样时间点为12 h、对数期取样时间点为24 h、稳定期取样时间点为72 h。
1.3.4 测定方法
生物量的测定:OD600nm值的测定:取5 mL发酵液,5 000 r/min离心10 min,取其上清液作为参比液,在波长600 nm处测定OD600nm值。细胞干质量的测定:称取离心管的质量,取5 mL发酵液于离心管中,5 000 r/min离心10 min,用清水洗涤2次后于80 ℃烘箱内烘干至恒质量,电子天平称离心管和菌体的质量,计算出每毫升发酵液的细胞干质量。
葡萄糖含量的测定[11]:采用3,5-二硝基水杨酸(3,5-dini trosalicylic acid,DNS)法。
乙醇浓度的测定[12]:使用SBA-40C生物传感器。
甘油含量的测定[13]:将发酵液于12 000 r/min条件下离心10 min,收集上清液待测胞外甘油含量,菌体用去离子水清洗3次后加入1 mL超纯水,加入适量玻璃珠用涡旋仪破碎10 min,12 000 r/min离心10 min,收集上清液待测胞内甘油含量。使用液体样本甘油含量酶法测定试剂盒测定甘油含量。
胞内海藻糖含量的测定[14]:将发酵液于12 000 r/min条件下离心10 min,弃上清液,收集菌体,用无菌水清洗3次,菌体用0.5 mol/L的三氯乙酸(trichloroacetic acid,TCA)常温下提取3次,每次20 min。收集3次提取液,稀释后用硫酸蒽酮法测定其中的海藻糖含量。
胞内钠钾比率(Na+/K+)的测定[15]:采用HITACHI原子吸收光谱仪测定胞内的钠和钾离子的浓度。
Na+/K+-ATP酶活性的测定:采用ATP酶试剂盒[16]。
脂肪酸的测定:参照文献[17]采用GC法。
2-苯乙醇含量的测定:参照文献[18]采用HPLC法。
1.3.5 统计分析
实验重复3次,结果用“平均值±标准差”表示,用Origin 9.0软件作图,采用Excel 2010进行方差分析。
2 结果与分析
2.1 不同质量浓度硫胺素对鲁氏接合酵母生长的影响
硫胺素通过TDP依赖性酶如转酮酶或α-酮戊二酸脱氢酶影响细胞氧化还原状态和与自由基的潜在相互作用参与不同抗胁迫的生化反应[19]。由于Z.rouxii在含180 g/L NaCl的YEPD平板上生长状态较差,因此选用含140 g/L NaCl的YEPD平板探究不同质量浓度硫胺素的添加对鲁氏接合酵母生长的影响,结果见图1。由图1可知,外源添加5 g/L、10 g/L的硫胺素对Z.rouxii细胞生长的促进作用最大,而添加其他质量浓度的硫胺素,促进作用不明显。因此,选择外源添加5 g/L硫胺素考察其对Z.rouxii耐盐胁迫机制的影响。
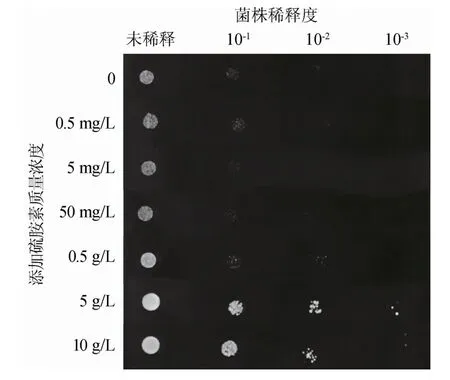
图1 不同质量浓度硫胺素对鲁氏接合酵母生长的影响Fig.1 Effect of different concentrations of thiamine on growth status of Z.rouxii
2.2 高盐胁迫下鲁氏接合酵母的形态特征
当细胞所处的外环境渗透压骤升时,水分会迅速流向低水分活度的胞外环境,细胞收缩[20]。使用蔡司显微镜DIC观察Z.rouxii细胞在有无5 g/L硫胺素添加的含180 g/L NaCl YEPD培养基中不同生长阶段的形态变化,结果见图2。
由图2可知,Z.rouxii细胞不运动,以出芽方式进行无性繁殖,在延滞期的形状趋于球形,直径<5 μm,细胞表面出现褶皱,有许多细胞聚集成团。细胞的相对表面积增大,有利于细胞的物质交换从而保护细胞。在对数期,细胞拉长呈椭球形,短径约5 μm,细胞表面光滑,出芽率高。在稳定期,对照组的Z.rouxii细胞大部分呈单细胞状态,出芽现象不明显;而添加5 g/L硫胺素的Z.rouxii细胞仍存在出芽现象,细胞表面更加圆润饱满。说明在180 g/L NaCl的胁迫下,外源添加硫胺素可能会增加细胞活力,延缓细胞的衰老。

图2 对照组(a)及试验组(b)鲁氏接合酵母不同生长阶段的细胞形态Fig.2 Cell morphology of Zygosaccharomyces rouxii at different growth stages in control group (a) and test group (b)
使用显微镜BF观察Z.rouxii细胞分别在有无5 g/L硫胺素添加的含180 g/L NaCl YEPD培养基中不同生长阶段的亚甲蓝染色情况,结果见图3。
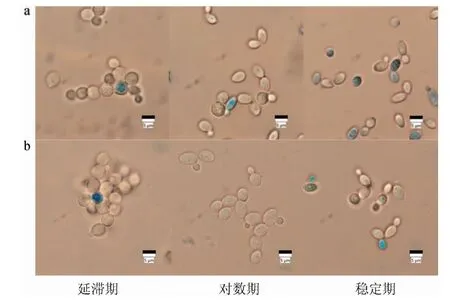
图3 对照组(a)及试验组(b)鲁氏接合酵母不同生长阶段的亚甲蓝染色情况Fig.3 Results of methylene blue staining of Zygosaccharomyces rouxii at different growth stages in control group (a) and test group (b)
由图3可知,Z.rouxii细胞在延滞期和对数期细胞活力较强,几乎不被染色;在稳定期,部分细胞呈蓝色或淡蓝色。与添加硫胺素的试验组相比,对照组中死细胞或代谢作用微弱的衰老细胞数目更多。在一定程度上说明了外源添加硫胺素增加了Z.rouxii细胞对高盐胁迫的适应性,延缓了细胞的衰老。
2.3 硫胺素的添加对鲁氏接合酵母细胞生长和葡萄糖消耗的影响
Z.rouxii发酵利用葡萄糖的过程有3种途径,有氧呼吸生成CO2和H2O,无氧呼吸生成乙醇或者生成甘油[21]。探究硫胺素的添加对Z.rouxii细胞的生长和葡萄糖消耗的影响,结果见图4。
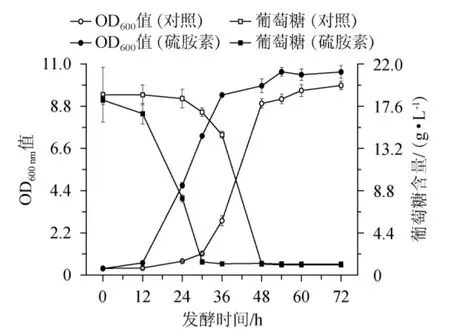
图4 硫胺素添加对鲁氏接合酵母细胞生长和葡萄糖消耗的影响Fig.4 Effect of thiamine addition on growth and glucose consumption of Zygosaccharomyces rouxii cells
由图4可知,对照组中,Z.rouxii经过24 h的延滞期后细胞快速生长。与对照组相比,试验组中葡萄糖的消耗更迅速,Z.rouxii细胞的延滞期缩短了12 h,稳定期时生物量提高了7.1%。试验组在12 h之前,虽然葡萄糖在消耗,但生物量增加较少;在12 h之后随着葡萄糖的消耗,生物量迅速增加。这种现象表明,硫胺素的加入促进了葡萄糖的消耗;在延滞期,葡萄糖的消耗可能不是用于细胞的生长而是用于合成平衡细胞渗透压的物质。胞内生物相容性的物质有甘油和海藻糖等,其可以提高酵母在高渗透压下的生长,硫胺素是否促进葡萄糖的分解代谢用于合成甘油和海藻糖需要进一步探讨。
2.4 硫胺素的添加对鲁氏接合酵母乙醇产量的影响
乙醇对于酱油香气的形成有重要作用。优化酱油酵母产乙醇条件,提高酱油中乙醇产量,有利于酱油的增香和保存[22]。硫胺素的添加对鲁氏接合酵母乙醇产量的影响见图5。
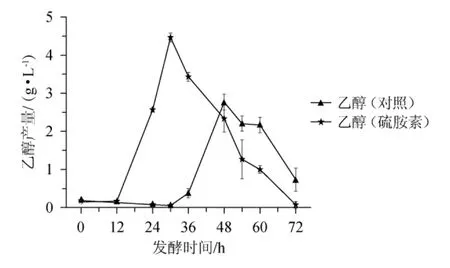
图5 硫胺素的添加对鲁氏接合酵母乙醇产量的影响Fig.5 Effect of thiamine addition on ethanol yield of Zygosaccharomyces rouxii
由图5可知,乙醇在对数生长期开始积累,当葡萄糖消耗完全时达到最大浓度。对照组中,乙醇产量最大达到2.77 g/L;与对照组相比,添加硫胺素后,乙醇产量最大达到4.5 g/L,比对照组高62.5%。硫胺素焦磷酸在丙酮酸脱羧酶催化丙酮酸脱羧形成乙醛的反应中行使辅助因子功能,促使更多的乙醛还原成乙醇。因此,在高盐胁迫下,外源添加硫胺素能提高Z.rouxii的乙醇产量。
2.5 硫胺素的添加对鲁氏接合酵母甘油和胞内海藻糖含量的影响
在Z.rouxii中甘油和海藻糖是重要的生物相容性物质。甘油由于含有羟基,亲水性能好,能有效地维持细胞内水分活度,保护细胞免受脱水的侵害,平衡高盐引起的细胞内外渗透压[23]。海藻糖是酵母细胞高渗透压下的一种典型代谢物质,可以保护细胞膜、蛋白质、核酸和其他生物大分子免受胁迫损伤[12]。硫胺素的添加对Z.rouxii胞内外甘油含量的影响见图6。

图6 硫胺素的添加对鲁氏接合酵母胞内(A)、胞外(B)甘油含量的影响Fig.6 Effect of thiamine addition on intracellular (A) and extracellular(B)glycerol contents of Zygosaccharomyces rouxii
由图6可知,对照组中,Z.rouxii在前30 h的适应阶段,胞内甘油的含量都随着葡萄糖的消耗而有效的合成,在30 h时达到最大积累量(81 mg/g菌体干质量),在30 h之后细胞进入快速生长阶段,胞内积累的甘油被迅速消耗,可能是用于脂类合成或其他保护性物质的合成。试验组中,Z.rouxii菌体胞内甘油在前12 h积累并达到最大积累量(75 mg/g菌体干质量),之后也迅速减少,但每克干菌体细胞的最大胞内甘油积累量与对照相比无显著差异(P>0.05)。说明外源添加硫胺素能促使高渗甘油应答途径[23]中甘油合成的提前,确保迟滞期细胞产生较多的胞内甘油,以平衡细胞内外的渗透压,使细胞能尽快适应高盐环境。
由图6亦可知,试验组中Z.rouxii胞外甘油积累速率比对照组更快,最高含量比对照组高59.7%。胞外甘油在细胞生长延滞期积累,在生长对数中期开始消耗,当葡萄糖消耗完时,积累的胞外甘油也消耗完毕。结合胞内外甘油的产量,说明外源添加硫胺素能促进甘油的合成,至于胞外甘油对Z.rouxii在高盐胁迫下能否起到更为长期的保护作用需要进一步的研究。
硫胺素的添加对Z.rouxii胞内海藻糖含量的影响见图7。海藻糖作为一种典型应激代谢物,其合成分解在Z.rouxii胞内是可调控的。由图7可知,与对照组相比,添加了硫胺素的培养基中,海藻糖作为碳源被分解代谢的速率更快,更有效的参与细胞的生长代谢过程,这可能是由于硫胺素促进了糖异生的代谢。在高盐胁迫下Z.rouxii胞内海藻糖积累现象不明显可能是更多的碳通量流向高渗甘油应答途径或者此时细胞内又产生其他具有保护性的物质。

图7 硫胺素的添加对鲁氏接合酵母胞内海藻糖含量的影响Fig.7 Effect of thiamine addition on intracellular trehalose content of Zygosaccharomyces rouxii
在高盐胁迫条件下,酵母会产生相容性渗透调节物对抗胁迫,它们的主要作用是保持水平衡、稳定酶系统正常代谢功能以及恢复正常细胞容积。甘油和海藻糖是常见的两种重要渗透调节物,也是酵母对抗高渗胁迫的主要方式。根据实验结果,相比于海藻糖,Z.rouxii主要是依靠甘油的产生和富集来适应高盐胁迫。特别是在硫胺素添加的盐胁迫条件下,Z.rouxii胞内甘油含量在迟滞期末达到最高值的时间比对照组提前了18 h,表明这段时期的细胞迅速产生甘油来平衡渗透压,使其迅速适应环境;当细胞适应了环境后,胞内甘油也慢慢降到一个平衡点,此时细胞生长已趋于稳定;胞内甘油生产的增加,也伴随着甘油的溢出,这导致胞外甘油含量持续增加至对数生长期中后期;当葡萄糖被消耗完全后,作替代碳源和能量来源的甘油也随之减少。而Z.rouxii胞内海藻糖在硫胺素添加的盐胁迫条件下,一直呈减少趋势,在32 h消耗至最低,且消耗速率快于对照组;值得注意的是,海藻糖在Z.rouxii胞内没有富集,而是作为一种储存性的碳源被消耗,在葡萄糖消耗完全时,胞内的海藻糖的含量也达到最低水平。在对照组中,甘油和海藻糖的代谢趋势也与实验组类似。上述结果表明,Z.rouxii在面临盐胁迫时会产生并富集甘油而不是海藻糖来适应胁迫,而硫胺素的添加,能促进甘油的有效合成,加快海藻糖的代谢,使细胞能更快适应高盐胁迫条件。
2.6 硫胺素的添加对鲁氏接合酵母胞内Na+/K+及Na+/K+-ATP酶活性的影响
ATP酶是一类分布广泛的膜结合蛋白酶,其中Na+/K+-ATP酶在维持细胞内外渗透压的平衡与细胞膜完整性中起到了重要的作用[16]。Z.rouxii在高盐胁迫的环境中,胞内Na+的浓度要远高于K+的浓度。当Z.rouxii细胞膜上Na+/K+-ATP酶被激活时,会将细胞内的Na+转运到细胞外,同时将细胞外的K+转运到细胞内,维持细胞内外渗透压的平衡。硫胺素添加对Z.rouxii胞内钠钾比率(Na+/K+)及细胞膜上Na+/K+-ATP酶活性的影响见图8。

图8 硫胺素的添加对鲁氏接合酵母胞内Na+/K+(A)及细胞膜上Na+/K+-ATP酶活性(B)的影响Fig.8 Effect of thiamine addition on Na+/K+(A) in cell and Na+/K+-ATP enzyme activity (B) on cell membrane of Zygosaccharomyces rouxii
由图8可知,Z.rouxii胞内Na+/K+在对数期降低,在稳定期有所升高。在对数期,添加硫胺素的培养基中胞内Na+/K+为43.6,比对照组低11.3%。相反,试验组中Z.rouxii细胞膜上Na+/K+-ATP酶的活性在对数期升高,在稳定期有所下降。这是因为在细胞受到外界胁迫时,细胞内活性氧(reactive oxygen species,ROS)自由基含量会升高,随着时间的延长,Z.rouxii胞内产生过量的ROS会导致膜的氧化损伤,使Na+/K+-ATP酶活性出现下降,胞内Na+/K+升高,最终导致细胞活性下降甚至进入凋亡[24]。Z.rouxii在延滞期的Na+/K+-ATP酶活性很低,为0.004 U/mg蛋白,这可能与延滞期菌体生物量少,菌体未适应胁迫条件,酶活被抑制有关。在对数期,添加硫胺素的培养基中Na+/K+-ATP酶活性为0.91 U/mg蛋白,比对照组高361.6%;在稳定期,添加硫胺素的培养基中Na+/K+-ATP酶活性为0.59 U/mg蛋白,比对照组高111.4%(P<0.05)。在高盐胁迫下,外源添加硫胺素能增加Na+/K+-ATP酶活性,降低胞内Na+/K+,减少Na+对细胞的毒害作用从而增加细胞活性。
2.7 硫胺素添加对鲁氏接合酵母胞内脂肪酸组成的影响
脂肪酸链的饱和度影响着细胞膜的流动性和渗透性[25],因此,脂肪酸的合成将影响Z.rouxii在含180 g/L NaCl YEPD培养基中的生长。硫胺素添加对鲁氏接合酵母胞内脂肪酸组成的影响见表1。

表1 硫胺素的添加对鲁氏接合酵母胞内脂肪酸组成的影响Table 1 Effect of thiamine addition on fatty acid composition in Zygosaccharomyces rouxii cell
由表1可知,Z.rouxii胞内的脂肪酸主要有棕榈酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)、油酸(C18:1)和亚油酸(C18:2)。对照组中,Z.rouxii胞内主要不饱和脂肪酸的含量是总脂肪酸含量的81.07%,主要饱和脂肪酸的含量为17.92%。添加硫胺素的培养基中,Z.rouxii胞内主要不饱和脂肪酸含量是总脂肪酸含量的57.82%,主要饱和脂肪酸的含量是36.49%。
与对照组相比,添加硫胺素后,Z.rouxii细胞内棕榈油酸(C16:1)、油酸(C18:1)和亚油酸(C18:2)含量分别减少1.21%、17.56%和4.48%,月桂酸(C12:0)、豆蔻酸(C14:0)、棕榈酸(C16:0)和硬脂酸(C18:0)含量分别增加0.42%、1.12%、10.24%和6.79%,饱和脂肪酸含量提高18.57%,而不饱和脂肪酸含量减少23.25%。外源添加硫胺素使Z.rouxii通过改变脂肪酸的组成,降低不饱和脂肪酸与饱和脂肪酸的比例,从而提高了脂肪酸的饱和度,增加了细胞膜的稳定性,避免酵母细胞出现内外渗透差而导致膜的破裂,保证了细胞膜的流动性,使得细胞在高盐胁迫下能够更好的生长。
2.8 硫胺素的添加对鲁氏接合酵母2-苯乙醇产量的影响
Z.rouxii在发酵过程中产生乙醇、高级醇(如2-苯乙醇)及芳香杂醇类物质,在高盐环境中还能转化糖类物质生成多元醇(如甘油)及糖醇类风味物质[26]。2-苯乙醇是发酵食品中具有玫瑰风味的重要风味成分之一,若酱油中不含或少含2-苯乙醇类的高级醇,会使酱油味淡薄,风味不足。硫胺素的添加对鲁氏接合酵母2-苯乙醇产量的影响见图9。
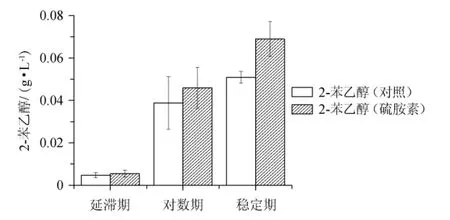
图9 硫胺素的添加对鲁氏接合酵母2-苯乙醇产量的影响Fig.9 Effect of thiamine addition on 2-phenylethanol production of Zygosaccharomyces rouxii
由图9可知,对照组中,Z.rouxii在延滞期的2-苯乙醇产量为4.7 mg/L,对数期的2-苯乙醇产量为0.04 g/L,稳定期的2-苯乙醇产量为0.05 g/L。添加硫胺素后,Z.rouxii在延滞期的2-苯乙醇产量为5.2 mg/L,对数期的2-苯乙醇产量为0.05 g/L,稳定期的2-苯乙醇产量为0.07 g/L。与对照组相比,添加了硫胺素使Z.rouxii的2-苯乙醇产量在对数期提高了17.9%,在稳定期提高了35.3%。在延滞期,无论是否添加硫胺素,因为菌体正处在对环境的适应阶段,细胞生长缓慢,生物量少,代谢产生的2-苯乙醇量低,所以两者变化不明显。
在氮源丰富的条件下,细胞只能通过莽草酸途径合成少量的2-苯乙醇[27]。莽草酸途径中,来源于糖酵解途径的磷酸烯醇式丙酮酸和磷酸戊糖途径的4-磷酸赤藓糖经一系列酶促反应生成2-苯乙醇[28]。硫胺素焦磷酸在3-磷酸甘油醛生成4-磷酸赤藓糖的转酮酶反应中行使辅助因子功能,因此,在高盐胁迫下,外源添加硫胺素能提高2-苯乙醇在莽草酸途径上的产量。
3 结论
研究结果表明,外源添加硫胺素(5 g/L)增加了Z.rouxii细胞对高盐胁迫的适应性,增加了细胞活力,延缓了细胞的衰老;使高盐胁迫下细胞的延滞期缩短了12 h,生物量提高了7.1%;促进葡萄糖的分解代谢,使高渗甘油应答途径中甘油的合成提前并提高甘油的产量;促进海藻糖分解代谢参于细胞的生长代谢过程;增加了Na+/K+-ATP酶活性,降低了胞内Na+/K+,减少Na+对细胞的毒害作用从而增加细胞活性;通过改变脂肪酸的组成,降低不饱和脂肪酸与饱和脂肪酸的比例,从而提高脂肪酸的饱和度,保证细胞膜的流动性,维持细胞在高盐胁迫下的生长。除此之外,硫胺素的添加还提高了62.5%的乙醇产量以及提高了35.3%的2-苯乙醇产量,有利于酱油的增香和保存,提高酱油的风味品质。
由此可见,硫胺素能增强Z.rouxii的高盐适应性,提高盐胁迫条件下的生物量,加速发酵过程中风味物质的形成,结果将有助于探索酱油发酵过程中耐盐产香酵母风味形成的机理,并改善传统酱油酿造的营养与风味。

