樱桃酒酿造用产香酵母的筛选及其特征香气成分分析
彭 璐,明红梅*,陶 敏,任 清,熊堂语,王 轩,俞 飞
(1.四川轻化工大学 生物工程学院,四川 宜宾 644000;2.北京工商大学 轻工科学技术学院,北京 100048)
樱桃富含糖类、蛋白质、维生素及钙、铁、钾等物质,具有较高的营养价值[1-2]。由于樱桃易腐败变质,不易储存,需深加工利用[3]。开发樱桃酒是提高樱桃附加值是较为理想的选择。樱桃酒富含矿物质、维生素和多酚等保健成分[4-6],具有良好的发展潜力。
果酒的风味与酿造酵母等微生物的特性密切相关,酵母是决定果酒品质优劣的重要因素之一。目前,果酒酿造大多采用酿酒酵母(Saccharomyces cerevisiae)进行发酵,其发酵酒香气淡薄,口感单一[7]。产香酵母能够生成醇、醛、酯等多种芳香物质,对果酒风味有积极的影响[8]。剧柠等[9]利用产香酵母与商用酿酒酵母混菌发酵枸杞果酒,其酯类物质种类和含量均高于酿酒酵母单菌发酵酒,具有更加浓郁的花香、果香气。袁晓龙等[10]利用一株产香酵母与酿酒酵母混菌发酵鸭梨酒,其总酯含量是酿酒酵母单菌发酵酒的2.6倍,并使酒体香气更加浓郁和舒适。有研究者将产香异常毕赤酵母(Pichia anomala)与安琪酒酵母协同发酵生姜梨酒,结果表明,混菌发酵较安琪酵母单菌发酵增加了醇类、酯类和萜烯类香气物质,赋予果酒优雅和谐的香味[11]。综上,针对樱桃酒酿造筛选优良产香酵母的报道较少,且开发果酒产香酵母也是目前果酒研发领域的热点[12]。
本研究采集樱桃、果园土壤样本,经过三级筛选获得适合樱桃酒酿造的产香酵母,并探究其樱桃汁发酵液的特征香气成分,以期提高樱桃酒品质,为果酒规模化、产业化发展奠定基础,也为果酒专用酵母的开发提供菌株资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌种
樱桃、土壤:内江市庆卫镇果园种植基地;酿酒酵母(Saccharomyces cerevisiae)NJ1:实验室保存优良菌种。
1.1.2 试剂
葡萄糖、乳酸、乙酸(均为分析纯):成都市科龙化工试剂厂;蛋白胨(生化试剂):北京奥博生物技术有限责任公司;2-辛醇(色谱纯):美国Sigma公司。
1.1.3 培养基
富集培养基(酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基):蛋白胨20 g,酵母浸膏10 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
分离培养基(孟加拉红培养基):葡萄糖10 g,蛋白胨5 g,磷酸二氢钾0.25 g,尿素0.1 g,硫酸镁0.5 g,1%孟加拉红水溶液0.033 g,琼脂粉20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
保藏培养基(马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基):马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 mL,自然pH,121 ℃灭菌20 min。
种子液培养基:樱桃汁外观糖度调整至10°Bx,pH值为4.5,煮沸5 min。
樱桃酒发酵培养基:樱桃汁外观糖度调整至25°Bx,pH值为4.2,煮沸5 min。
樱桃汁产香培养基(即樱桃清汁):樱桃果汁含量为30%,外观糖度为15°Bx,pH值为4.5,煮沸5 min。
1.2 仪器与设备
STO210 pH计:奥豪斯仪器(上海)有限公司;LB20T手持折光仪:广州市速为电子科技有限公司;50 μm/30 μm DVAB/CAR/PDMS固相微萃取头、手动固相微萃取(solid phase microextraction,SPME)进样器:美国Supelco公司;S-3400扫描电子显微镜:日本HITACHI公司;SKY-2102C恒温摇床:韶关市广智科技设备有限公司;Agligent 6890N-5975B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦公司。
1.3 方法
1.3.1 酵母菌富集、分离与纯化
樱桃、土壤样品中分别加入无菌水,摇匀后制成菌悬液。分别取10 mL菌悬液加入到90 mL YPD液体培养基中,28 ℃、150 r/min条件下富集培养24 h。用无菌水将富集菌悬液梯度稀释至10-3、10-4、10-5,并分别涂布于孟加拉红培养基上,28 ℃条件下培养48 h。挑选符合《酵母菌的特征与鉴定手册》[13]的酵母特征的单菌落,即菌落乳白或奶油色,表面球形凸起且光滑湿润,并在YPD固体培养基划线纯化培养2~3次后,进行PDA培养基斜面保藏。
1.3.2 产香酵母菌的初筛
将保藏于PDA斜面的酵母菌接种于YPD培养基平板上,28 ℃培养3~5 d,通过嗅闻法[4]对酵母菌株进行香气评价,初步筛选具有较浓酯香气或特殊果香气的菌株,用于后续菌种的复筛。
1.3.3 产香酵母菌的复筛
将初筛获得的酵母菌接种于种子液培养基,28 ℃、150 r/min条件下培养至种子液浓度达到107个/mL,以8%(V/V)的接种量接种于樱桃汁产香培养基中,28 ℃静置微氧培养7 d,在发酵结束后测其总酯含量,并进行香气评价[4]。
1.3.4 产香酵母菌的三级筛选
三级筛选是利用复筛酵母与酿酒酵母混菌发酵樱桃酒的品质评价菌株的协同能力。参照文献[2]利用复筛的产香酵母与酿酒酵母NJ1混菌发酵樱桃酒,产香酵母和酿酒酵母NJ1分别接种于种子液培养基,28 ℃、150 r/min条件下培养至种子液浓度各达到107个/mL时,将产香酵母与酿酒酵母NJ1以1∶1的浓度比例同时接种到樱桃酒发酵培养基,产香酵母与酿酒酵母NJ1总接种量按发酵液体积分数10%(各占5%)接种,29 ℃静置培养10 d。当樱桃酒还原糖质量浓度<4 g/L(主发酵结束后),离心分离出酵母菌,终止乙醇发酵,用于后续试验分析,测定其总酸、总酯含量、酒精度和挥发酸含量,并进行感官评价。
1.3.5 产香酵母菌的鉴定
将筛选获得的目的酵母菌接种到YPD固体培养基上,28 ℃条件下培养2 d,观察酵母菌的菌落形态;并且用扫描电子显微镜进行扫描,记录并观察酵母菌的细胞形态。同时将分离的酵母菌纯种送至上海生工生物工程有限公司进行26S rDNA测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对搜索,选取同源性较高的模式菌株的26S rDNA序列,采用MEGA6软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.6 目的酵母的特征香气成分分析
将鉴定出的产香酵母菌株单菌落接种于樱桃汁产香培养基,以樱桃清汁(未接种的樱桃汁)作对照组,29 ℃静置培养10 d。发酵结束后利用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合GC-MS技术,测定樱桃汁发酵液和对照组中的挥发性成分[14]。半定量分析:以2-辛醇(终质量浓度259.99 μg/L)为内标物,通过半定量方法测定其含量。定性分析参文献[11]。
1.3.7 理化指标测定
总酯含量参考曾智娟等[11]的方法,总酸含量、挥发酸含量、酒精度参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[15];感官评价参考文献[4]。
1.3.8 数据分析
利用Origin 2018、MEGA6等软件进行数据处理和分析。
2 结果与分析
2.1 产香酵母菌株的筛选
2.1.1 产香酵母菌株的分离及初筛结果
通过分离纯化共获得纯种酵母菌35株。通过嗅闻法初筛后获得5株具有较浓酯香气或特殊果香气酵母菌,编号分别为J2、J12、J13、J31和J33。
2.1.2 产香酵母菌株的复筛结果
将初筛优选的5株酵母菌分别接入樱桃汁产香培养基进行单菌发酵,发酵结束后测定其总酯含量,并进行香气评价,结果见表1。
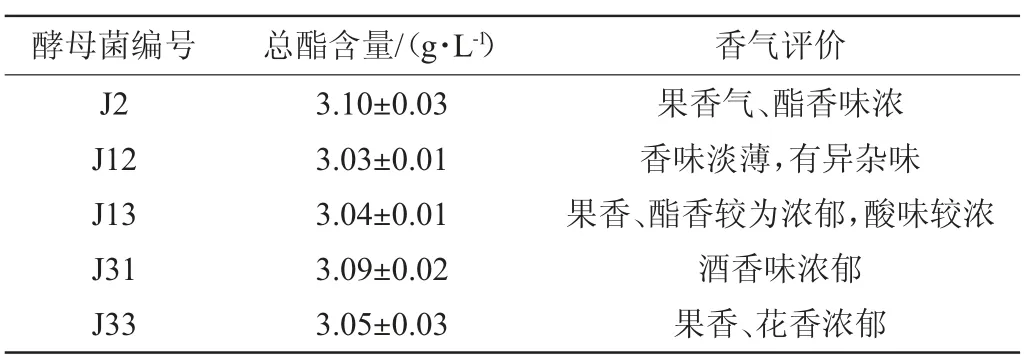
表1 不同产香酵母菌株发酵液的总酯含量和香气评价结果Table 1 Total esters content and aroma evaluation results of fermentation broth of different aroma-producing yeast strains
由表1可知,5株酵母菌发酵液的总酯含量差异不大,在3.03~3.10 g/L之间。其中菌株J2的总酯含量最高,菌株J12和J13的总酯含量较低。这可能是因为不同酵母分泌酯酶的种类及活性存在着差异,导致生成酯的能力也不相同[16]。结合香气评价结果,初步优选酵母菌株J2、J31和J33做为下一步三级筛选菌株。
2.1.3 产香酵母菌株的三级筛选结果
分别将酵母菌株J2、J31、J33与酿酒酵母NJ1混菌发酵制备樱桃酒,组合编号依次为A、B、C,对照组为酿酒酵母NJ1单菌发酵,编号为D。在主发酵结束后分别测定总酸、挥发酸含量、总酯含量、酒精度,并进行感官评价,结果见图1。
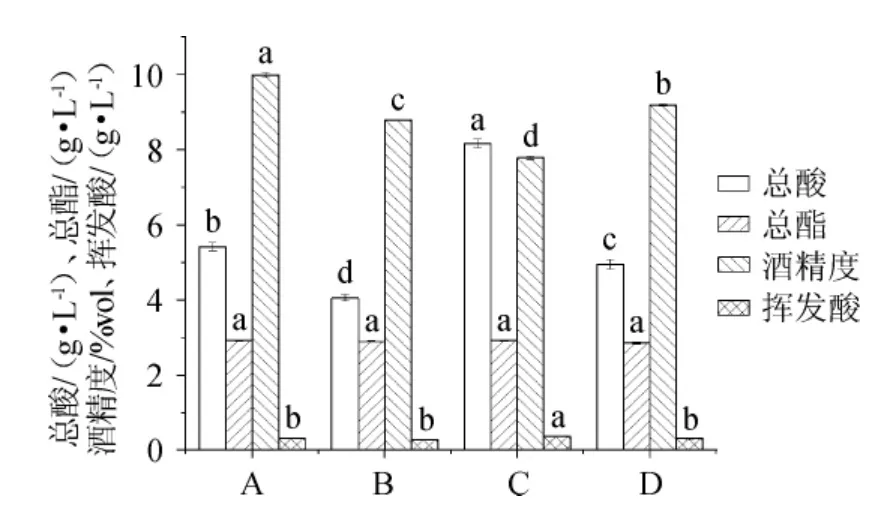
图1 各菌株组合发酵樱桃果酒的理化指标Fig.1 Physicochemical indexes of cherry fruit wine fermented by different strains combination
由图1可知,A、B、C、D组的酒精度差异均显著(P<0.05),可能是不同酵母与酿酒酵母协同发酵产酒精能力不同[11]。A组酒精度最高,达10%vol,与对照组(D组)比较,A组酒精度增加,这可能是A组中酵母(酵母J2)具有一定产酒精的能力[17],有待进一步研究。A、B、C、D组的总酯含量差异均不显著(P>0.05),总酯含量在2.86~2.92 g/L之间,其中A、C组总酯含量较高,均为2.92 g/L;A、B、C组的总酯含量与D组比较均有所增加,说明A、B、C组中接入的产香酵母菌均具有较好的酯类物质合成能力。果酒中适当的酸含量有利于赋予果酒适口性,抑制杂菌,增加酒体稳定性[11]。A、B、C、D组的总酸含量差异均显著(P<0.05),这可能是不同的酵母菌株利用糖类物质代谢生成酸能力不同,部分酸类物质在发酵过程中作为中间代谢产物转化为其他物质(酯类物质等)的能力不同[18],A、B、C、D组的总酸含量均符合果酒行业标准《绿色食品果酒》要求(总酸含量应在4~9 g/L)[19]。挥发酸是酵母不完全发酵形成的副产物,适量的挥发酸赋予果酒愉悦的香气[18]。A、B、D组的挥发酸含量与C组差异显著(P<0.05),这可能是不同的酵母产生挥发酸的能力不同。A、B、C、D组的挥发酸含量在0.29~0.37 g/L,均符合国标《葡萄酒、果酒通用分析方法》规定(挥发酸含量<1.2 g/L)[15]。结合感官评价结果,A组果酒感官评分最高,达86分,酒体色泽深红,果香、酒香浓郁,酸甜协调、口感柔和;B组果酒感官评分较低,为79分,酒体酸味突出,口感欠佳。综上所述,A组即菌株J2与酿酒酵母NJ1发酵的樱桃酒的协同效果最好,因此,确定菌株J2为优选的产香酵母。
2.2 产香酵母菌株J2的鉴定
2.2.1 形态学鉴定
对菌株J2的菌落形态进行观察,并将菌株J2于电镜下观察细胞形态,结果见图2。
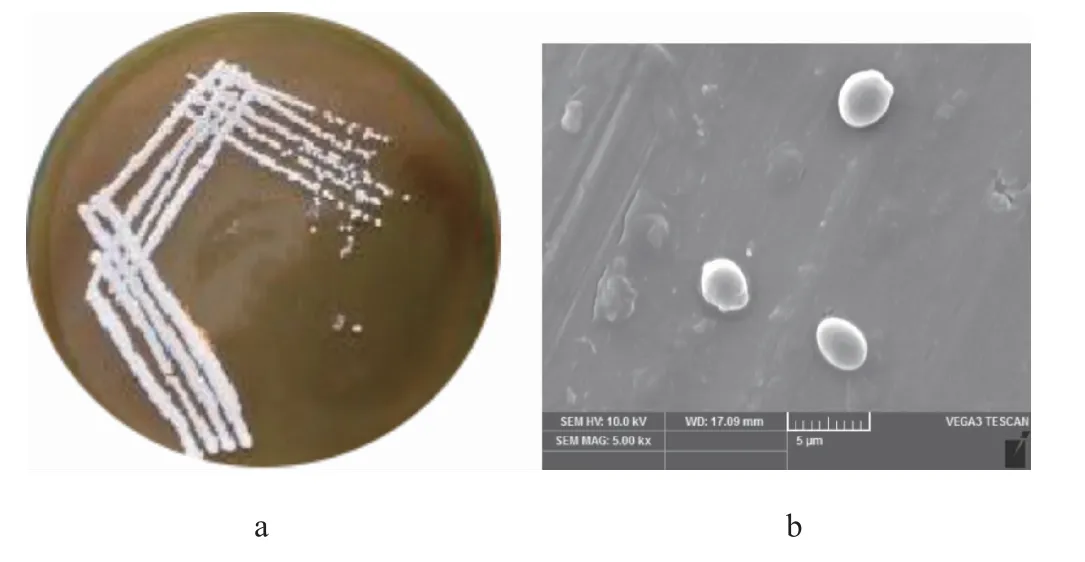
图2 菌株J2的菌落(a)及细胞(b)形态Fig.2 Colony (a) and cell (b) morphology of strain J2
由图2可知,菌株J2在YPD固体培养基上的菌落整体呈圆形,颜色为乳白色,菌落表面光滑、湿润、粘稠,容易挑起,质地均匀,电子显微镜扫描出菌株J2的细胞形态为椭圆形,是酵母的典型细胞形态。故初步鉴定菌株J2为酵母属菌株。
2.2.2 分子生物学鉴定
基于26S rDNA基因序列菌株J2的系统发育树见图3。由图3可知,菌株J2与季也蒙毕赤酵母(Meyerozyma caribbica)聚在同一分支,且相似度为100%,亲缘关系最近,结合形态观察,鉴定菌株J2为季也蒙毕赤酵母(Meyerozyma caribbica)。

图3 基于26S rDNA基因序列菌株J2的系统发育树Fig.3 Phylogenetic tree of strain J2 based on 26S rDNA gene sequences
2.3 酵母J2的特征香气成分分析
对菌株J2樱桃汁发酵液的挥发性香气成分进行分析,其GC-MS分析总离子流色谱图见图4,挥发性香气成分检测结果见表2。
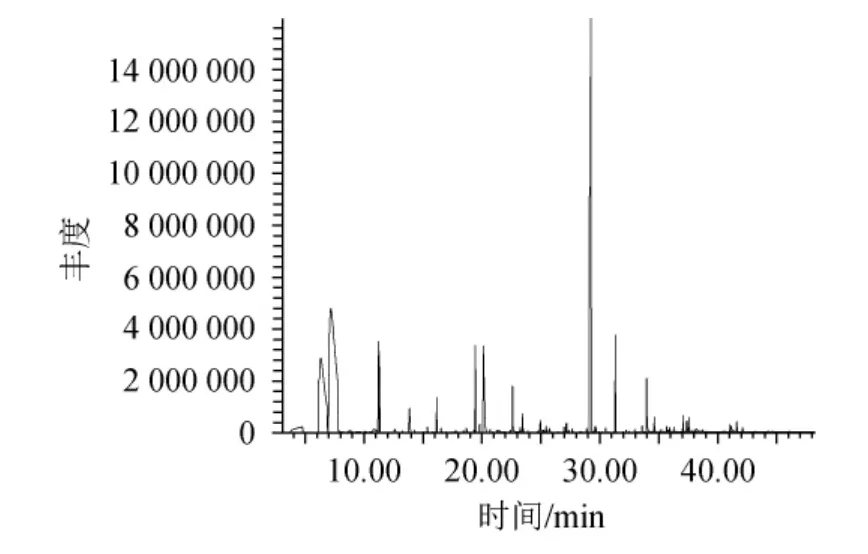
图4 菌株J2樱桃汁发酵液挥发性香气成分GC-MS分析总离子流色谱图Fig.4 Total ion chromatogram of volatile aroma components in cherry juice fermentation broth by strain J2 analysis by GC-MS
香气是水果及果酒感官品质的重要组成部分[20]。由表2知,菌株J2樱桃汁发酵液和樱桃清汁中分别检测出香气成分42种和33种,总含量分别为9 555.63 μg/L和7 021.64 μg/L。有20种香气成分仅在菌株J2樱桃汁发酵液中检测到,其总含量达443.64 μg/L。菌株J2樱桃汁发酵液和樱桃清汁中共有22种香气成分,其中17种成分的含量显著增加,其总含量相较樱桃清汁增加了37.00%。
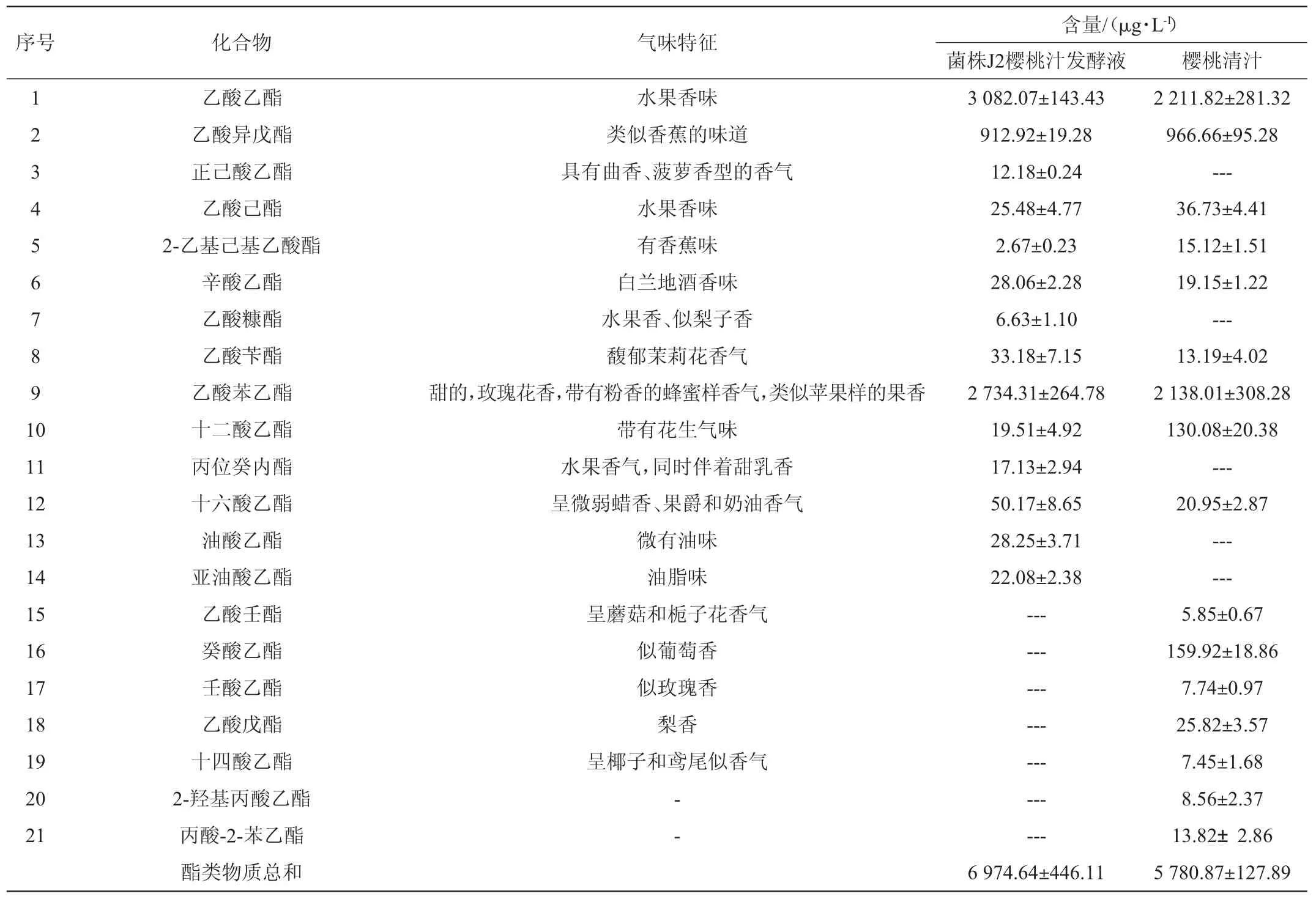
表2 菌株J2樱桃汁发酵液挥发性香气成分的GC-MS检测结果Table 2 Detection results of volatile aroma components in cherry juice fermentation broth by strain J2 analysis by GC-MS
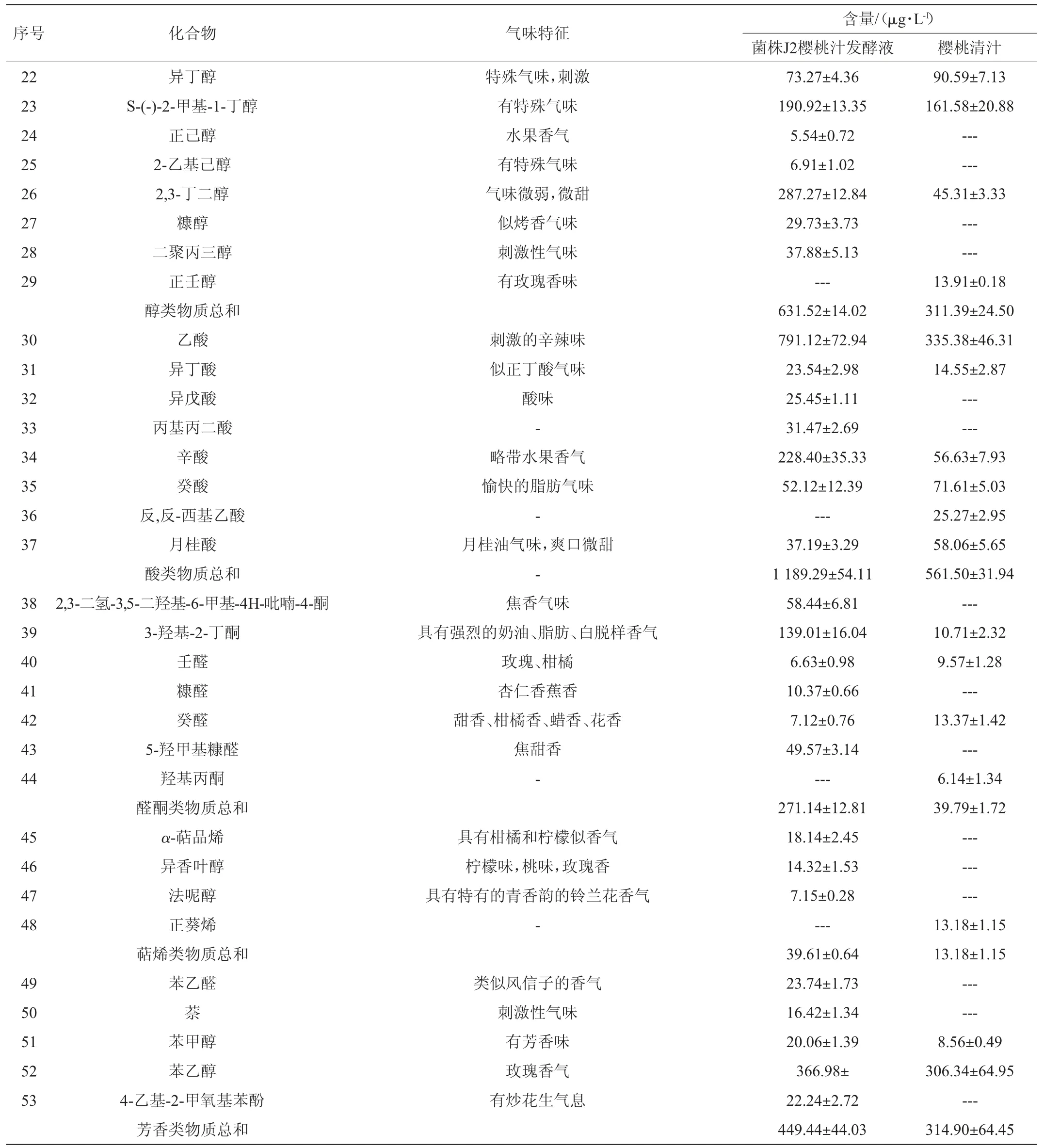
续表
2.3.1 酯类物质分析
菌株J2樱桃汁发酵液中酯类物质总含量为6974.64 μg/L,比樱桃清汁高1 193.77 μg/L。正己酸乙酯、乙酸糠酯、丙位癸内酯、油酸乙酯、亚油酸乙酯只在菌株J2樱桃汁发酵液中检测到。正己酸乙酯阈值较低,是樱桃酒主要香气成分[5]。乙酸糠酯、丙位癸内酯、油酸乙酯、亚油酸乙酯在樱桃酒中较少报道,在其他果酒或白酒中有检测出[21-22]。菌株J2樱桃汁发酵液和樱桃清汁共有成分含量差值较大的是乙酸乙酯、乙酸苯乙酯,其差值分别为870.25 μg/L和596.30 μg/L,这两种酯类物质具有花果香气,是樱桃酒的主要香气物质[23]。这些酯类的形成与酵母的酯酶转化有关[24]。
2.3.2 醇类和醛酮类物质分析
菌株J2樱桃汁发酵液中醇类物质总含量为631.52 μg/L,比樱桃清汁高320.13 μg/L。正己醇、2-乙基己醇、糠醇、二聚丙三醇只在菌株J2樱桃汁发酵液中检测到。正己醇[25]、2-乙基己醇[25]、糠醇[26]是樱桃酒的香气成分。酵母经葡萄糖代谢途径或氨基酸代谢途径可生成醇类物质[27]。
菌株J2樱桃汁发酵液中醛酮类物质总含量为271.14 μg/L,比樱桃清汁高231.35 μg/L。2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮、糠醛、5-羟甲基糠醛只在菌株J2樱桃汁发酵液中检测到,其中糠醛是樱桃酒的特征香气成分[25]。烃类物质经降解可产生醛酮类物质[28]。菌株J2樱桃汁发酵液和樱桃清汁共有成分含量差值较大的是3-羟基-2-丁酮、2,3-丁二醇,其差值分别为128.30 μg/L和241.96 μg/L。2,3-丁二醇和3-羟基-2-丁酮是樱桃酒重要香气成分[29-30],其在白酒中也有检测到[31]。在酵母代谢过程中,3-羟基-2-丁酮与2,3-丁二醇这两种物质存在相互转化[32]。
2.3.3 酸类物质分析
菌株J2樱桃汁发酵液中酸类物质总含量为1189.29μg/L,比樱桃清汁高627.79 μg/L。异戊酸、丙基丙二酸只在菌株J2樱桃发酵液中检测到。菌株J2樱桃汁发酵液和樱桃清汁共有成分含量差值较大的是乙酸、辛酸,其差值分别为455.74 μg/L和171.77 μg/L。这些酸类物质是樱桃酒香气的来源[25,33]。酸类物质主要是高级脂肪酸分解或醇、醛氧化的产物,果酒中的乙酸、辛酸等有机酸,一方面来源于果实,另一方面可由酵母代谢产生[14]。
2.3.4 萜烯类物质分析
菌株J2樱桃汁发酵液中萜烯类物质总含量为39.61μg/L,比樱桃清汁高26.43 μg/L。其中α-萜品烯、异香叶醇、法呢醇只在菌株J2樱桃汁发酵液中检测到。这些萜烯类物质含量较低,阈值也较小,对果酒香气有重要作用[34],但在樱桃酒中较少报道。萜烯醇经酵母的葡萄糖苷酶作用,可由果汁中的糖苷类物质水解生成[35]。
2.3.5 芳香类物质分析
菌株J2樱桃汁发酵液中芳香类物质总含量为449.44 μg/L,比樱桃清汁高134.54 μg/L。苯乙醛、萘、4-乙基-2-甲氧基苯酚只在菌株J2樱桃汁发酵液中检测到。4-乙基-2-甲氧基苯酚是樱桃酒的香气成分[30]。菌株J2樱桃汁发酵液和樱桃清汁共有成分苯乙醇的含量差值较大,其差值达到60.64 μg/L。苯乙醇具有令人愉悦的玫瑰风味,是樱桃酒香气的骨架[33]。经研究发现,苯乙醇在酵母相关酶的作用下,经莽草酸或艾氏途径生成[36]。
菌株J2樱桃汁发酵液中共检测到11种挥发性物质与文献报道的樱桃酒的特征香气成分相一致[25,29-30],包括正己酸乙酯、正己醇、2-乙基己醇、糠醛、乙酸乙酯、乙酸苯乙酯、3-羟基-2-丁酮、2,3-丁二醇、乙酸、辛酸、苯乙醇。
3 结论
从樱桃及果园土壤样本中经嗅闻香气初筛、果汁发酵法复筛和混菌发酵樱桃酒三级筛选,初步获得一株可发酵产生果香、酯香香气的酵母菌,编号为J2,经鉴定其为季也蒙毕赤酵母(Meyerozyma caribbica)。菌株J2樱桃汁发酵液中共检测出42种香气成分,其中,有20种香气成分在樱桃清汁中未检测到,其总含量达443.64 μg/L;与樱桃清汁中共检测出22种相同的香气成分,其中17种香气成分含量显著增加,其总含量相较樱桃清汁增加了37.00%。这些香气成分主要来源于樱桃果实或者经酵母发酵产生。菌株J2樱桃果汁发酵液中共检测到11种挥发性物质与文献报道的樱桃酒的特征香气成分相一致,包括正己酸乙酯、正己醇、2-乙基己醇、糠醛、乙酸乙酯、乙酸苯乙酯、3-羟基-2-丁酮、2,3-丁二醇、乙酸、辛酸、苯乙醇。因此,菌株J2为一株具有产香能力的酵母,可应用于樱桃酒的酿造,有利于果酒的风味及品质的提升,在保持樱桃酒典型性的同时,给酒体带来独特的香气成分,增加香气的丰富度。今后将进一步探索这些重要香气成分的产生机制及其对樱桃酒品质的影响,也可进一步拓展应用于其他发酵产品领域。

