聚集诱导发光紫檀芪衍生物分子的制备及活性研究
王 程,郑慧琳,常雨薇,柴科杰,章鹏飞,徐伟明
(杭州师范大学材料与化学化工学院,浙江 杭州 311121)
自从人类第一次用气相沉积法制成了电致发光(EL)装置后,有机发光二极管(OLED)的研究越来越引起大家的兴趣[1-4].它的各种光学和电子特性稳定,这正好契合了高效有机材料以及制造技术的需要.在传统的发光材料中,发光物质在溶液中能发出很强的荧光,但在聚集态或固态却没有荧光发出.最近,具有聚集诱导发光(AIE)的分子引起了人们的热捧.在这其中,四苯基乙烯(TPE)(图1)是一种结构简单且具有明显的聚集诱导发光的分子[5-8].科学家们利用TPE分子去构建不同的固态发光物质和其他功能性材料,尤其在有机发光二极管和生物检测等方面[9-10].传统的发光物质在聚集状态的荧光往往是猝灭的,这就是聚集导致的荧光猝灭现象(ACQ).这种荧光猝灭现象很大程度上限制了生物样品的标记浓度,让研究者不得不采用稀溶液来做生物检测,从而降低了检测的灵敏度.而利用四苯基乙烯具有的聚集诱导发光特性,可以使高浓度的分子在聚集状态也发出很强的荧光,并用于生物检测.
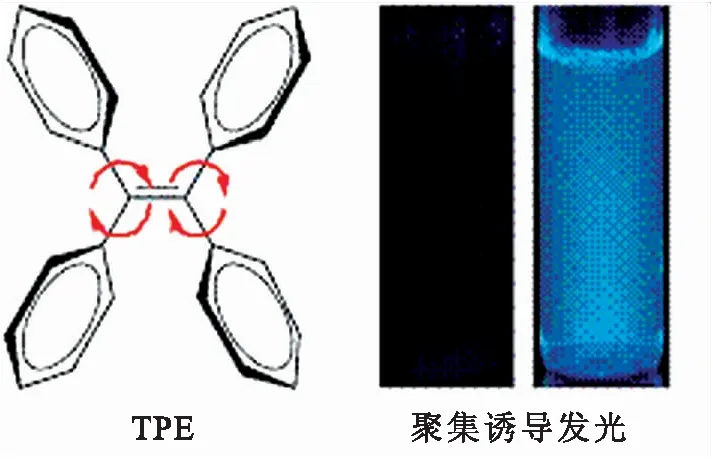
图1 TPE结构图Fig.1 The structure of TPE
本研究将TPE分子连接到紫檀芪和叠氮取代的三嗪分子上,得到了一种含有四苯基乙烯结构的聚集诱导发光紫檀芪衍生物分子,进一步研究了分子的毒性及细胞摄取等相关生物活性和药理学性质.这种优质低毒的荧光探针物质的引入,使之在作为药物载体的同时,可以更直观地观察到药物在体内的移动和释放.
1 实验部分
1.1 仪器和试剂
SHB-ⅢA循环水式多用真空泵、2XZ-2型旋片真空油泵、R-201旋转蒸发仪、ZF-1型紫外分析仪、XS204电子天平、HZ-9310K型恒温振荡培养箱、酶标仪(BIO-RAD680,配570 nm滤光片)、倒置荧光显微镜、磁力搅拌器、离心机、烘箱及其他有机合成玻璃仪器.
1-(4-溴苯基)-1,2,2-三苯基乙烯、四三苯基膦钯、碘化亚铜、2-甲基-3-丁炔-2-醇、三乙胺、石油醚、乙酸乙酯、甲苯、氢氧化钾、2-叠氮-4-氯-6-[4-(3,5-二甲氧基苯乙烯基)苯氧基]三嗪、介孔铜氧化物、叔丁醇、水、盐酸、无水硫酸镁、四氢呋喃、HELA细胞、COS-7细胞、CHL细胞、GSE细胞、乙醇、二甲基亚砜等.
试剂均系市售商品或工业品,用前未经处理.
1.2 四苯乙烯基乙炔的制备(图2)
称取0.822 g 1-(4-溴苯基)-1,2,2-三苯基乙烯、0.15 g Pd(Ph3P)4、0.025 g CuI、0.242 mL 2-甲基-3-丁炔-2-醇,NEt3作为溶剂,剧烈加热回流4 h后,冷却至室温,过滤,将滤液转干,以石油醚和乙酸乙酯(体积比为3∶1)作为洗脱剂柱层析分离得0.692 g黄色油状物1,产率为83.5%.
称取0.828 g(2 mmol)产物1、0.112 g(2 mmol)KOH,甲苯作为溶剂,加热回流3 h后,冷却至室温,用10 mL质量分数为10%的盐酸洗涤1次,再用100 mL水洗涤2次,干燥过滤,旋干,以石油醚作为洗脱剂柱层析分离得到0.400 g白色固体2,产率为56.1%.

图2 合成路线1Fig.2 Synthesis route 1
1.3 2-氯-4-[4-(3,5-二甲氧基苯乙烯基)苯氧基]-6-{4-[4-(1,2,2-三苯基乙烯基)苯基]-1H-1,2,3-三唑-1-基}三嗪的制备(图3)
将0.493 g(1.2 mmol)2-叠氮-4-氯-6-[4-(3,5-二甲氧基苯乙烯基)苯氧基]三嗪(化合物3)、0.356 g(1 mmol)产物2、0.008 g(0.1 mmol)介孔铜氧化物、20 mL叔丁醇、2 mL水,搅拌溶解加热至90 ℃,反应10 h.过滤,把叔丁醇旋干,用10 mL乙酸乙酯萃取洗涤,无水硫酸镁干燥,用石油醚和乙酸乙酯(体积比为15∶1)作为洗脱剂柱层析的方法分离,得到0.430 g产物4,产率为56%.

图3 合成路线2Fig.3 Synthesis route 2
1.4 产物的表征
[2-(4-Ethynylphenyl)ethene-1,1,2-triyl]tribenzene (产物2)[11]
Mp: 152~153 ℃.
MS (ESI):m/z(%) 357.164 0 [M+H]+.
IRvmax/cm-1: 3 440, 3 276, 3 072, 3 020, 1 519, 1 442, 1 262, 1 071, 1 028.
1H NMR (500 MHz, CDCl3) δ 7.28~6.96 (m, 19H), 3.05 (s, 1H).
2-Chloro-4-[4-(3,5-dimethoxystyryl)phenoxy]-6-{4-[4-(1,2,2-triphenylvinyl)phenyl]-1H-1,2,3-triazol-1-yl}-1,3,5-triazine (产物4)[12]
Mp: 165~166 ℃.
MS (ESI):m/z(%) 767.253 8 [M+H]+.
IRvmax/cm-1: 3 445, 3 072, 3 020, 2 961, 2 916, 2 849, 2 190, 1 752, 1 623, 1 588, 1 532, 1 465, 1 420, 1 365, 1 295, 1 120, 1 051, 1 023.
1H NMR (500 MHz, CDCl3) δ 8.58 (s, 1H), 7.68 (d,J=8.3 Hz, 2H), 7.62 (d,J=8.6 Hz, 2H), 7.26 (d,J=8.6 Hz, 2H), 7.11 (dddd,J=14.1, 10.0, 8.7, 6.6 Hz, 19H), 6.71 (d,J=2.1 Hz, 2H), 6.45 (s, 1H), 3.87 (s, 6H).
1.5 化合物的紫外及荧光检测
图4(a)为产物2和化合物3在99%的水和100%的四氢呋喃(THF)中的荧光图谱,图4(b)为产物4在99%的水和100%的THF中的荧光图谱.如图4(a)所示,在350 nm波长的激发下,产物2在THF中几乎没有荧光,而在含99%水的溶液中,具有很强的荧光,且发射波长为494 nm,说明产物2具有明显的AIE现象,即聚集诱导发光效应.而在相同条件下,化合物3在THF和含99%水的溶液中都无明显的荧光现象.图4(b)中350 nm波长的激发下,产物4在THF中也几乎没有荧光,而在99%水的溶液中,具有很强的荧光,其发射波长为496 nm.与产物2相比,略有红移,但不是很明显.图4(c)紫外吸收光谱显示,化合物3在310 nm处有吸收,产物2在321 nm处有吸收,产物4在333 nm处有吸收.

(a)化合物3、产物2的荧光紫外谱图;(b)产物4的荧光紫外谱图;(c)化合物3、产物2、产物4的紫外吸收光谱图.
1.6 MTT法测定产物2和产物4的细胞毒性
1)细胞接种: ①HELA细胞用含10%小牛血清的DMEM培养液配成单个细胞悬液; ②用0.25%胰蛋白酶消化单层COS-7细胞,用含10%小牛血清的RPMI1640培养液配成单个细胞悬液; ③CHL细胞用含10%小牛血清的RPMI1640培养液配成单个细胞悬液; ④GSE细胞用含10%胎牛血清的DMEM培养液配成单个细胞悬液,将细胞接种到96孔板上,每孔8 000个细胞,每孔体积200 μL.
2)细胞培养:将培养板放入CO2培养箱,在37 ℃、5% CO2及饱和湿度条件下培养16~18 h.
3)吸去培养液,用PBS清洗细胞,加入无血清培养液,在细胞板孔中分别加入产物2和产物4的DMSO溶液,使每孔中产物2和产物4的质量浓度分别为20、40、60、80、120、160、200、240 μg/mL,每孔液体的总体积为200 μL(每个样品每种浓度均为三复孔).
4)产物2和产物4与细胞共孵育24 h.
5)吸去培养基,每孔加入90 μL无血清培养液和10 μL质量浓度为5 mg/mL的MTT溶液,37 ℃孵育3 h.
6)翻板法弃去液体,每孔加入100 μL DMSO,在微量振荡器上振荡10 min.
7)在酶标仪上测570 nm波长处OD值.
8)统计细胞活力.
由图5可见,产物2对4种细胞的活性影响不大,属于低毒范围.产物4则毒性较大,在GSE和HELA细胞中当其质量浓度达到80 μg/mL时,细胞毒性低于50%,而在CHL和COS-7细胞上其质量浓度达到40 μg/mL时,细胞已经全部失活.分析研究发现,产物4对上皮组织细胞的毒性较大,而紫檀芪属于抗氧化的抗癌辅助天然化合物,理论上属于低毒化合物,所以可能是由于该化合物中含有活泼的氯原子,对上皮组织中的某种酶有影响,故毒性较大.

图5 产物2和产物4对4种不同细胞在不同浓度下的细胞毒性
1.7 产物2和产物4的细胞摄取实验
1)细胞接种.
将普通洁净盖玻片放入70%乙醇中浸泡5 min,于超净台内吹干.将盖玻片置于24孔板内,种入细胞培养过夜,使细胞密度为70%~80%.将圆形载玻片放入24孔板的每个孔中.
神经胶质瘤细胞用含10%小牛血清的DMEM培养液配成细胞悬液,将细胞接种到24孔板上,每孔2×104个细胞,每孔体积500 μL.于CO2培养箱中培养24 h,待细胞密度为70%~80%时进行摄取实验.
2)产物2和产物4的溶液分别用DMSO配制成20 μg/mL的溶液.
3)细胞摄取实验.
孵育24 h后,将24孔板中的培养液吸去,加入400 μL无血清的DMEM培养液,将配好的两种溶液分别加入24孔板中,在37 ℃、5% CO2培养箱中培养2.5 h后取出,重复前一步骤,再吸去两个孔板中的培养液,加入400 μL无血清的DMEM培养液,将配好的两种溶液分别加入24孔板中,在37 ℃、5% CO2培养箱中培养0.5 h.
吸去培养液,用PBS洗涤3次,每次200 μL,吸去PBS,每孔加入200 μL 0.5 μg/mL的Hoechst溶液,孵育6 min后,吸去Hoechst溶液,用PBS洗涤3次.
4)倒置荧光显微镜观察.
由图6可发现,产物4在细胞吞噬3 h后荧光负载的药物比0.5 h的要多,且与产物2比较发现,无论是3 h还是0.5 h,产物4的细胞吞噬效果都要比产物2好.分析其原因,可能是由于分子量的增大使得细胞更易吞噬且不易流出,所以分子量大的产物4更易被细胞吞噬.这一结果使笔者将荧光与药物相结合的设想成为可能,可以更直观地看出药物被细胞吞噬的形态、数量及分布状况[13].

(a)0.5 h产物2;(b)0.5 h产物4;(c)3 h产物2;(d)3 h产物4.
2 结果与讨论
本研究把具有AIE聚集诱导发光效应的四苯乙烯基引入到三氯三嗪分子中,同时连载上具有抗氧化性的辅助抗肿瘤分子紫檀芪,通过荧光测定,确定分子在水中仍具有聚集诱导发光的特性.MTT检测发现,产物2在不同细胞中毒性较小,但随着浓度的增加毒性有所加强,在相同条件下,产物4由于分子中有氯元素的存在,毒性更大.细胞摄取实验发现在一定时间内,吞噬时间越长,细胞摄取效果越好,产物4因含有抗氧化性的紫檀芪且分子量较大,所以细胞摄取情况优于产物2.
这一系列的检测说明,我们可以利用产物4荧光显色的特性,研究其被细胞吞噬后药物的分布、数量及形态等,使得对三嗪化合物产物4的研究不再停留在最基础的化学合成阶段,对它的药理性能也有了更多的认识,为下一步靶向药物分子设计奠定了良好基础.

