Riok3条件基因打靶小鼠模型的构建
李 艳,王思怡,章 微,陈露易,李斐雪
(1. 杭州师范大学生命与环境科学学院,浙江 杭州311121; 2. 杭州师范大学理学院,浙江 杭州 311121)
0 引言
卵巢作为雌性哺乳动物重要的生殖器官,呈卵圆形,位于子宫两侧,可以释放成熟的卵母细胞(oocytes),还可以合成并分泌类固醇激素如雌激素、孕激素等.卵巢发育异常会引起多囊卵巢综合征(polycystic ovarian syndrome,PCOS)及卵巢早衰(premature ovarian failure,POF)等多种疾病,导致不孕不育[1].目前,建立理想的卵巢异常动物模型成为预防和治疗卵巢疾病的关键所在,也是深入理解和研究卵巢异常发病机制、发展和治疗的基础.
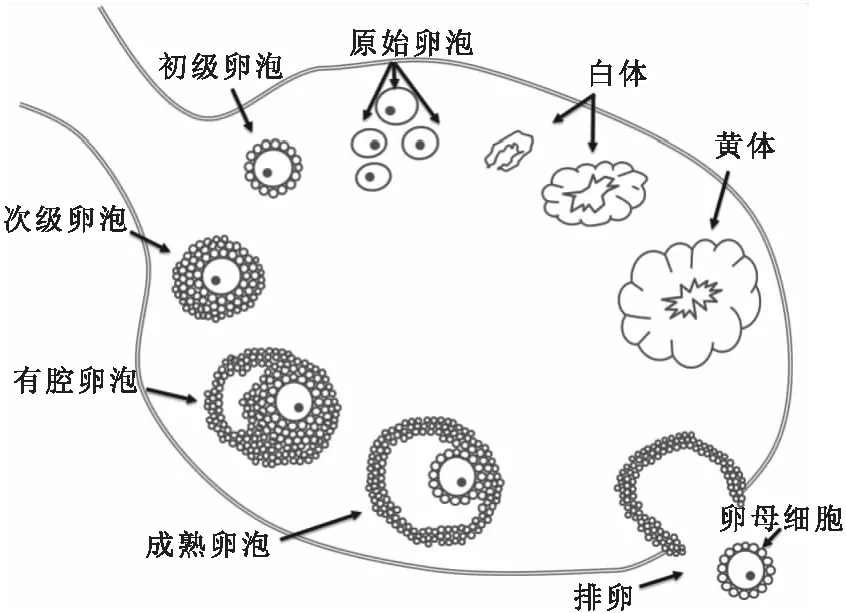
图1 卵泡发育示意图Fig.1 Schematic illustration of follicular development
小鼠的卵巢和睾丸都从成对的生殖脊(genital ridge)发育而来[2].小鼠卵巢内存在不同发育阶段的卵泡(follicular)和黄体(corpus luteum).卵泡是卵巢的基本功能单位,从静止的原始卵泡(primordial follicle)状态被激活,经过初级卵泡(primary follicle)、次级卵泡(secondary follicle)、有腔卵泡(antral follicle)等阶段发育至成熟卵泡(mature follicle)[3],其发育过程见图1.原始卵泡由一个直径小于20 μm的卵母细胞和其周围单层扁平的前体颗粒细胞以及外周鞘细胞组成.在小鼠出生后第3天(P3)出现由立方形颗粒细胞包围的初级卵泡.随着颗粒细胞不断增殖,卵泡膜细胞形成,成为次级卵泡.卵泡刺激素(follicle-stimulating hormone,FSH)调节从次级卵泡到排卵期前卵泡颗粒细胞的增殖与发育[4].次级卵泡的颗粒细胞分离,其间充满卵泡细胞分泌的卵泡液,形成直径达70 μm的卵泡腔.出生后第7天(P7)的小鼠卵巢中可见个别有腔卵泡,第21天(P21)时有腔卵泡明显增多.随之卵泡液增多,卵泡腔变大,形成成熟卵泡[5].成熟卵泡扩展至整个皮质部而突出卵巢表面.
黄体生成素(luteinizing hormone,LH)激活卵泡颗粒细胞中的多个信号通路,使其黄体化,卵丘扩展,卵泡壁裂解,卵细胞被释放,该过程即为排卵[6].排卵后,颗粒细胞转化为具有分泌功能的粒黄体细胞,与卵泡膜血管、成纤维细胞及巨噬细胞一起填满卵泡腔;卵泡膜细胞分化为周边的膜黄体细胞,共同形成黄体[7].黄体的主要功能是产生发情周期与维持妊娠所需的孕酮(progesterone).若卵细胞未经受精或着床失败,黄体将经历结构和功能的退化,逐渐萎缩变成白体(corpus albicans),从而失去分泌功能[5].
体内信号转导过程中的重要调节蛋白——蛋白激酶,在体内转录、分化、凋亡、代谢、细胞周期、细胞运动和骨架重排中扮演着重要的角色.人体内已知的蛋白激酶有518种,它们负责催化磷酸基团向苏氨酸、酪氨酸和丝氨酸转移[8].激酶可以分为常规激酶和非常规激酶两大类.大部分激酶属于常规激酶,具备典型的激酶结构,由二级结构上保守的序列组成其催化区域.非常规激酶种类较少,在人类基因组中已知的只有40余种.两类激酶在结构上有的相似有的则差别较大,在序列上不相似,但都有激酶的特征性结构.
非常规激酶RIO(right open reading frame)家族蛋白都有相对保守的RIO结构域[8-10],其中家族成员Riok1和Riok2最早都在酵母中发现[9,11].现已发现从古细菌到哺乳动物中都存在Riok1和Riok2,而Riok3则在较高等的真核生物中存在[12].
在酵母细胞中,Riok1或Riok2任一蛋白激酶的缺失都会导致20S rRNA前体加工受限[11,13].在人体细胞中,Riok3的缺失会使产生18S rRNA过程中21S rRNA前体水平升高[14].然而,在许多真核生物有机体中rRNA前体的加工过程是40S 核糖体亚基成熟的关键环节[15].因此,RIO蛋白激酶在哺乳动物细胞核糖体生物合成中扮演着关键角色.
许多核糖体生物合成相关蛋白在细胞周期过程中发挥着重要的作用[16].RIO激酶家族也不例外.Riok1基因敲除能抑制S期细胞周期进程及酵母细胞的有丝分裂[9,16-17].Riok2是PLK1(polo-like kinase1)的新型靶分子,PLK1介导的Riok2磷酸化能调节HeLa细胞从中期向后期的转换[18].这些研究暗示RIO激酶家族控制细胞周期过程,对细胞的生长有潜在作用.
近期本课题组发现Riok3在小鼠卵巢卵母细胞中表达较高.卵母细胞在卵泡的发育成熟中意义重大,影响卵巢的发育.鉴于RIO激酶家族在细胞周期过程中发挥重要作用,若使卵母细胞中Riok3缺失或失活,是否会影响卵泡的发育导致卵巢早衰?由此,本研究构建了Riok3条件基因打靶的小鼠模型,为进一步研究Riok3在卵巢发育中的功能及其分子机理奠定基础.
1 材料和方法
1.1 实验材料
实验动物:本研究中小鼠的饲养和使用参照《杭州师范大学实验动物管理办法》,受杭州师范大学动物管理委员会的监督.所用材料为SPF(specific pathogen free)级别小鼠,购自杭州师范大学实验动物中心.实验用受精卵由健康7周龄C57BL/6J雌鼠30只与雄鼠10只交配而得;假孕母鼠由健康7周龄ICR(Institute of Cancer Research)雌鼠20只与结扎雄鼠7只交配检阴栓后而得.
实验材料:胎牛血清(Gibco,10099-141),非必需氨基酸 (Gibco,11140-050),丙酮酸钠 (Gibco,11360-070),谷氨酰胺(Gibco,35050-061),青霉素-链霉素(Gibco,15140-122),0.05%胰酶-EDTA(Gibco,25300-054),DMEM(Gibco,11960-069),DPBS(Gibco,14190-250),ESGRO mLIf(Millipore,ESG1107),M16(Sigma,M7292),干细胞129细胞系W4,来源于杭州师范大学张遵义教授实验室.
1.2 实验方法
1.2.1 原位杂交
收集野生型C57BL/6J雌性小鼠P1、P3、P5的卵巢,通过4%多聚甲醛(PFA)固定、石蜡包埋.组织切成12 μm厚度,经4%PFA固定、蛋白酶K处理、乙酸酐处理后,杂交液室温封闭1 h,加入地高辛标记的RNA探针在65 ℃条件下孵育过夜.寡核苷酸引物根据小鼠cDNA通过PRIMER3软件设计:Riok3For: 5’-ACCCCTCAAAACACAGTATCC;Riok3Rev: 5’-GTTCCTTCTTCTCGTGTAGACG.次日,样品分别经SSC、Tris-HCl缓冲液浸洗,加入偶联碱性磷酸酶的抗地高辛的抗体经4 ℃孵育过夜后再次用Tris-HCl缓冲液浸洗,最后加入底物BM Purple(Roche,11442074001)显色,在PBS缓冲液中终止反应,加伊红对染,中性树脂封片、拍照.
1.2.2 免疫组化
收集野生型C57BL/6J雌性小鼠P1、P3、P5的卵巢,通过4%PFA固定、石蜡包埋.组织切成5 μm厚度,经脱蜡水化、高压抗原修复、H2O2处理、0.1%PBS-Triton X-100清洗、5%BSA室温封闭后加入一抗Riok3单克隆抗体(proteintech,13593-1-AP),4 ℃孵育过夜.次日加入二抗,经DAB 显色(VECTOR,SK-4100)、快红对染后中性树脂封片、拍照.
1.2.3 基因打靶载体的构建
以基因打靶的干细胞基因组DNA为模板,在Riok3基因起始密码子上游扩增4 kb作为同源重组的长臂(5’arm),在起始密码子下游扩增2.5 kb作为同源重组的短臂(3’arm),分别进行TA克隆.然后通过酶切、连接的方法将两个片段整合到含有Neo(指新霉素抗性基因,选择性筛选的阳性标记)和DTA(指白喉毒素A亚基的负性筛选标记)筛选基因的打靶载体内,其中LoxP-LoxP-Neo(LoxP指Cre-Loxp重组酶系统中在外显子两侧的序列)位于两个重组臂的中间.构建成功的载体进行测序,测序正确后用Qiagen的无内毒素质粒抽提试剂盒进行质粒抽提.
1.2.4 胚胎干细胞基因打靶
用限制性内切酶Pac Ⅰ(NEB,#R0547L)将300 μg基因打靶载体线性化,经过酚-氯仿纯化后用于胚胎干细胞基因打靶.复苏MEF和NeoR MEF细胞,用丝裂霉素C处理的MEF细胞作为基因打靶ES细胞的饲养层细胞,在ES细胞生长至指数生长期时用于基因打靶实验.将收集的ES细胞与线性化的打靶载体DNA混合、静置,转移至电击杯中,用伯乐电击仪电击,冰上静止后,铺到含有NeoR MEF的培养皿中,从第2天开始,细胞每天换含有G418(Sigma,A1720-5G)的新鲜培养基.G418筛选的第8天,挑单克隆.在解剖镜下选取饱满的、边缘清晰的细胞集落,挑至96孔板中.
1.2.5 胚胎干细胞阳性克隆筛选
将96孔板胚胎干细胞单克隆用碱裂解法提取基因组DNA,并用乙醇沉淀,以得到的基因组DNA为模板,用PCR的方法进行胚胎干细胞阳性克隆筛选.为鉴定5’arm 是否重组,将正向引物设计在基因组上5’arm 上游200 bp 以外,反向引物设计在基因打靶载体5’arm 的下游;为鉴定3’arm 是否重组,正向引物设计在打靶载体3’arm 的上游,反向引物设计在基因组上3’arm 下游200 bp以外.只有当两个PCR条带大小都正确,才可以确定这些克隆发生了同源重组,作为阳性克隆.
1.2.6 基因打靶小鼠模型的构建
1.2.6.1 超数排卵
向供体雌鼠腹腔注射孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)10 IU,46~48 h后再注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)5 IU.随后将其与雄鼠合笼过夜,次日清晨7:00检查阴栓(见栓后标记为E0.5).
1.2.6.2 囊胚的获取
小鼠见栓后第3天(E3.5),用1 mL注射器抽取冲卵液,将针头插入输卵管子宫体结合处,将子宫置于培养皿中并进行冲洗.将冲出的液体在体视显微镜下进行观察,用移卵针捡出发育阶段和质量较好的胚胎进行实验,一般选用桑葚胚到囊胚期的胚胎.
1.2.6.3 显微注射
用嘴控移卵管转移胚胎至显微镜台上的注射操作室,固定住囊胚,将具有内细胞团(inner cell mass,ICM)的胚胎放在6点或12点位置,瞄准后注射针快速准确地穿过透明带,慢慢地释放ES细胞进入囊胚腔,再慢慢抽出注射针.定期把注射过的胚胎转移到二氧化碳培养箱里,于M16培养基中培养.
1.2.6.4 胚胎移植
麻醉受体假孕母鼠,暴露受体雌鼠子宫,将注射ES细胞的胚胎吸入移卵针,在输卵管子宫结合部几毫米处避开血管开孔,将囊胚吹入子宫.术后将小鼠放置于干净的鼠笼里,用50 W的灯泡保温,并放在保温台上,直到其苏醒.
1.2.7 嵌合体小鼠的判定与交配
胚胎移植后21 d左右小鼠产仔,10 d左右可根据毛色显性判断其是否为嵌合体(chimera)以及嵌合率情况.将雄性嵌合体小鼠与C57BL/6J野生型小鼠交配,后代通过基因型鉴定,含有目的基因片段的杂合子小鼠为构建成功的Riok3条件基因打靶小鼠F1代.
2 结果及分析
2.1 原位杂交实验检测Riok3在小鼠卵巢中的表达
通过Riok3mRNA基因编码序列的原位杂交实验,发现在P1、P3和P5小鼠的卵母细胞中Riok3均有特异性的表达(图2).故推测Riok3基因可能参与小鼠卵泡的发育过程,进而参与卵巢发育.

注:箭头表示卵母细胞.图2 原位杂交实验检测Riok3在小鼠卵巢中的表达Fig.2 Detection of Riok3 expression in mouse ovary by in situ hybridization注:箭头表示卵母细胞.图3 免疫组化检测Riok3在小鼠卵巢中的表达Fig.3 Immunohistochemical assay of Riok3 expression in mouse ovary
2.2 免疫组化实验检测Riok3在小鼠卵巢中的表达
对P1、P3和P5的小鼠卵巢进行Riok3抗体的免疫组化实验,结果显示,Riok3在出生后小鼠第1、第3和第5天的卵巢卵母细胞中都有明显信号(图3),表明Riok3参与卵泡的发育过程,进而参与卵巢发育.
2.3 Riok3基因打靶的载体构建及基因打靶
将成功构建的Riok3条件基因打靶质粒线性化后,经胚胎干细胞的基因打靶,利用PCR方法筛选阳性重组克隆.3’同源臂鉴定PCR长度为3.9 kb,5’同源臂鉴定的长度为5 kb,打靶载体构建如图4所示.经琼脂糖凝胶电泳图显示,E号克隆为阳性克隆(图5).

注:E1—E6表示外显子1—6.

a b
2.4 Riok3基因打靶小鼠模型构建

图6 显微注射原理图
将得到的阳性干细胞进行囊胚显微注射、胚胎移植,得到嵌合体小鼠(图6).本研究经胚胎移植的代孕母鼠共4只,最终得到3窝存活的嵌合体小鼠共12只.根据毛色挑选嵌合率较高的雄性嵌合体小鼠4只与C57BL/6J雌鼠进行交配,得到F1代小鼠.收取其尾部组织,经过碱裂解法提取基因组DNA,通过琼脂糖凝胶电泳进行基因型鉴定.阳性条带大小为246 bp,野生型条带大小为147 bp.Riok33 LoxP鉴定For1:AGCTTTAGCGTCTGACTGG;Riok33 LoxP鉴定Rev1:TGAGTGCTTTTTTGAGTGTCC.实验结果显示2、3、6、7、8、9、10、13和16号为杂合子小鼠,其余均为野生型小鼠(图7).

1~17:F1代小鼠代号;M:电泳marker.
3 讨论
蛋白激酶在体内信号转导中扮演着重要的角色,其中Riok3被发现在真核生物中参与细胞周期过程中核糖体的生物合成[12,16].Riok3mRNA基因编码序列的原位杂交实验和Riok3抗体的免疫组化实验均发现Riok3在P1、P3和P5小鼠卵巢卵母细胞中高表达,表明Riok3可能参与小鼠卵母细胞的发育过程.为此,本研究构建了Riok3条件基因打靶载体,通过基因打靶、干细胞囊胚注射和胚胎移植,得到了Riok3条件基因打靶的嵌合体小鼠.至此,成功构建Riok3条件基因打靶的小鼠模型(Riok3loxP/loxP).
接下来可将Riok3loxP/loxP基因型小鼠与在卵母细胞中特异性表达的GDF9-Cre基因型小鼠杂交,以获得卵母细胞中特异性敲除Riok3的突变型小鼠(Riok3loxP/loxP/GDF9-Cre),进一步研究Riok3在卵母细胞发育中的功能,深入了解Riok3在卵巢发育过程中的分子调控机制.

