巴马拟缨鱼源嗜水气单胞菌分离鉴定及其致病力分析
张曼 王振光 高峰 胡珅华 武琳 程光平 陈秀荔


摘要:【目的】明確巴马拟缨鱼暴发性死亡的原因,为该病的临床诊断和科学防治提供参考依据,进而为巴马拟缨鱼健康养殖提供保障。【方法】从病源地采集患病巴马拟缨鱼样本,采用常规的细菌分离纯化方法从心脏、肝脏和脾脏等组织病料中分离优势菌株,经形态特征观察、API 20NE生理生化鉴定及16S rRNA序列和gyrB基因PCR扩增分析后,进行人工感染试验及毒力基因检测以确定其致病力,最后采用K-B药敏纸片扩散法检测其药敏性。【结果】从患病巴马拟缨鱼的心脏、肝脏和脾脏等组织中分离获得1株优势菌株(命名为BM178),综合其形态特征、API 20NE生理生化鉴定谱及分子生物学鉴定结果,可确定为嗜水气单胞菌(Aeromonas hydrophila)。经腹腔注射感染BM178菌株后,巴马拟缨鱼的胸鳍、腹鳍和臀鳍基部不同程度出血,肛门红肿,剖检可观察到内脏团有点状出血、肝脏充血、脾脏肿大和肠道充血等症状,与自然发病巴马拟缨鱼的症状基本一致;BM178菌株对健康巴马拟缨鱼的半数致死剂量(LD50)为1.26×102 CFU/g。在BM178菌株中6种常见毒力基因(hly、aer、act、alt、ahp和ahal)的检出率为100.0%,即毒力基因型为hly+aer+act+alt+ahp+ahal+。药敏试验结果显示,BM178菌株对头孢曲松、头孢哌酮、庆大霉素、多西环素、诺氟沙星、复方磺胺甲噁唑和氟苯尼考等7种抗菌药物高度敏感,而对青霉素G已产生较强的耐药性。【结论】嗜水气单胞菌是引起巴马拟缨鱼暴发性死亡的主要病原菌,具有较强的致病性,实际生产中可选用多西环素、复方磺胺甲噁唑或氟苯尼考进行防治。
关键词: 巴马拟缨鱼;嗜水气单胞菌;致病力;毒力基因;药敏试验
中图分类号: S941.42 文献标志码: A 文章编号:2095-1191(2020)09-2051-10
Isolation, identification and pathogenicity analysis of Aeromonas hydrophila from Pseudocrossocheilus bamaensis
ZHANG Man1,2, WANG Zhen-guang1, GAO Feng1, HU Shen-hua1,3, WU Lin1,
CHENG Guang-ping1, CHEN Xiu-li3*
(1College of Animal Science and Technology/Guangxi Colleges and Universities Key Laboratory of Aquatic Healthy Breeding and Nutrition Regulation, Guangxi University, Nanning 530004, China; 2School of Marine Sciences, Guangxi University, Nanning 530004, China; 3Guangxi Academy of Fishery Sciences, Nanning 530021, China)
Abstract:【Objective】This study was to clarify the cause of fulminant death of Pseudocrossocheilus bamaensis and provide the basis for clinical diagnosis and scientific prevention of this disease. In turn, it would provide guarantee for the healthy breeding of P. bamaensis. 【Method】Samples of diseased P. bamaensis were collected from disease origin, and the dominant strains were isolated from the heart, liver, and spleen tissues by conventional bacterial isolation and purification methods. Morphological characteristics observation, API 20NE physiological and biochemical identification, PCR amplification analysis based on 16S rRNA and gyrB gene, artificial infection test as well as virulence gene detection were ca-rried out to determine the pathogenicity. Finally, K-B drug susceptibility disc diffusion method was used to detect the drug sensitivity. 【Result】A dominant strain(named BM178) was isolated from the heart, liver, and spleen tissues of the diseased P. bamaensis. Based on its morphological traits, API 20NE physiological and biochemical identification spectrum and molecular biological identification results, it could be identified as Aeromonas hydrophila. After artificial abdominal infection of strain BM178, P. bamaensis showed hemorrhage on the base of pectoral, pelvic and anal fins, anus swelling, punctate bleeding in visceral mass, liver congestion, spleen swelling and intestinal congestion, which were in accordance with na-tural infection. The median lethal dose(LD50) of the BM178 strain to healthy P. bamaensis was 1.26×102 CFU/g. The detection rate of six common virulence genes(hly, aer, act, alt, ahp and ahal) in BM178 strain was 100.0%, and virulence genotype was hly+aer+act+alt+ahp+ahal+. The results of drug sensitivity test showed that the BM178 strain was highly sensitive to seven antibiotics including ceftriaxone, cefoperazone, gentamicin, doxycycline, norfloxacin, trimethoprim-sulfamethoxazole and florfenicol, but had strong resistance to penicillin G. 【Conclusion】A. hydrophila is the main pathogen leading to sudden death of P. bamaensis and has strong pathogenicity. Doxycycline, trimethoprim-sulfamethoxazole or florfenicol can be used for prevention and treatment in actual production.
Key words: Pseudocrossocheilus bamaensis; Aeromonas hydrophila; pathogenicity; virulence gene; drug sensitivity test
Foundation item:Guangxi Natural Science Foundation(2017GXNSFAA198044); Guangxi Science and Technology Key Project(GuikeAA17204088-3); Project of Basic Ability Improving of Young Teachers in Guangxi(KY2016YB021)
0 引言
【研究意义】巴马拟缨鱼(Pseudocrossocheilus bamaensis)原名巴马繐唇鲃,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)拟缨鱼属(Pseudocrossocheilus),主要分布于广西境内的红水河水系(张鹗和陈景星,1997)。巴马拟缨鱼骨刺松软、可整体食用,且富含脂肪,是广西地区名贵的土著经济鱼类(程光平等,2008)。目前,市售巴马拟缨鱼均为野外捕获,受过度捕捞及自然栖息生境恶化等因素的影响,巴马拟缨鱼捕获量逐年减少,且呈群体低龄化和个体小型化趋势,其野生资源濒临枯竭(Zhang et al.,2018)。为恢复巴马拟缨鱼种群资源及满足当前市场需求,程光平等(2008)从2004年起开始对巴马拟缨鱼进行驯养和人工繁殖研究,但由于巴马拟缨鱼对人工养殖环境要求较高,特别是在水温较高时易暴发以败血病为主的细菌性病害,极大制约了巴马拟缨鱼苗种的规模化繁育。因此,有针对性开展巴马拟缨鱼病害研究与防治,对实行健康养殖及种质资源保护均具有重要意义。【前人研究进展】至今,关于巴马拟缨鱼的研究主要集中在肉质营养评价(庞卫等,2010)、基础生物学(Wang et al.,2015)和遗传学(Zhang et al.,2018)等方面,而针对其病害防治的研究尚无相关报道。近年来,已有研究人员从其他鲤科鱼类如禾花鲤(Cyprinus carpio)、黄河鲤(C. carpio haematopterus)、草鱼(Ctenopharyngodon idellus)和长丝裂腹鱼(Schizothorax dolichonema)等体内分离获得多种可引起败血症等疾病的细菌性病原,主要為气单胞菌(Aeromonas spp.)(龙苏等,2016a;赵贤亮等,2017;何涛等,2018;雷雪平等,2019)。最常见的气单胞菌是嗜水气单胞菌(A. hydrophila),其广泛分布于自然界,是引起鱼类气单胞菌败血症的主要病原,临床症状表现为鱼类体表有不同程度出血,剖检可见脏器充血肿大,发病率和死亡率极高(曹青等,2017),给水产养殖业造成巨大经济损失的同时,严重制约其产业的持续健康发展。黄新财等(2013)研究证实,黄颡鱼(Pelteobagrus fulvidraco)源嗜水气单胞菌耐药株对盐酸沙拉沙星的耐药性在短期内很难消除,且具有稳定的遗传性,因此在实际生产中不宜常用或滥用盐酸沙拉沙星;陈婷婷(2014)研究发现团头鲂(Megalobrama amblycephala)源嗜水气单胞菌的致病力与气溶素基因(aerA)、丝氨酸蛋白酶基因(ahpA)和溶血素基因(hlyA)具有显著相关性;秦莉(2014)研究表明,白斑狗鱼(Esox lucius)源嗜水气单胞菌不同菌株间的致病力差异是其携带基因水平不同所致,对青霉素G、左氧氟沙星、强力霉素和环丙沙星呈高度或中度敏感且敏感性基本一致;牛志伟等(2016)基于Meta分析对我国耐喹诺酮类嗜水气单胞菌毒力基因及耐药基因的检出情况进行系统评价,结果显示检测我国致病性嗜水气单胞菌时,淮河以南地区应以毒力基因actA和aerA为致病性强的判断标准,而淮河以北地区建议以毒力基因hlyA和aerA为致病性强的判断标准。【本研究切入点】2018年5月广西大学水产基地人工驯养的巴马拟缨鱼出现暴发性死亡(发病水温28 ℃),主要临床症状为摄食减少、反应迟钝,鳍条基部出血,肛门红肿;剖检可见内脏团出血、脾脏肿大、肝脏和肠道充血;2 d内的累计死亡率高达85.0%。因此,迫切需要探明发病原因并科学防治,以降低该病造成的经济损失。【拟解决的关键问题】对患病巴马拟缨鱼进行病原菌分离鉴定、致病力检测及药敏性分析,明确巴马拟缨鱼暴发性死亡的原因,为该病的临床诊断和科学防治提供参考依据,进而为巴马拟缨鱼健康养殖提供保障。
1 材料与方法
1. 1 试验材料
患病巴马拟缨鱼采自广西大学水产基地,体质量25.1±1.8 g/尾;健康巴马拟缨鱼购自广西大化县农贸市场,体质量21.6±1.3 g/尾,暂养3周后用于人工感染试验。营养肉汤、营养琼脂培养基和MHA培养基均购自广东环凯微生物科技有限公司;API 20NE试剂条和药敏纸片购自法国生物梅里埃公司;2×Bench TopTM Taq Master Mix购自杭州倍沃医学科技有限公司;细菌基因组DNA提取试剂盒购自广州飞扬生物工程有限公司;所有扩增引物委托生工生物工程(上海)股份有限公司合成。
1. 2 病原菌分离与鉴定
1. 2. 1 病原菌分离 在无菌条件下,以MS-222麻醉鱼体,从患病巴马拟缨鱼的心脏、肝脏和脾脏等组织病料中取样,划线接种于营养琼脂培养基上,28 ℃恒温培养24 h,挑取单个优势菌落连续纯化培养3次,分离纯化的菌株于-80 ℃下保存备用。
1. 2. 2 病原菌形态观察及理化特性鉴定 肉眼观察分离菌株的菌落形态特征,并进行革兰氏染色和氧化酶试验。若分离菌株为革兰氏阴性且氧化酶试验呈阳性,则选用API 20NE试剂条对其进行各项理化指标鉴定。
1. 2. 3 分子生物学鉴定 提取病原菌DNA,采用16S rRNA和gyrB基因引物(表1)进行PCR检测。PCR反应体系20.0 μL,包括DNA模板(50.0 ng/μL)1.0 μL,上、下游引物(10.0 μmol/L)各0.3 μL,2×Bench TopTM Taq Master Mix (Taq DNA聚合酶0.05 U/μL,MgCl2 4.0 mmol/L,dNTPs 0.4 mmol/L)10.0 μL,ddH2O 8.4 μL。扩增程序:95 ℃预变性5 min;95 ℃ 45 s,55/64 ℃ 45 s,72 ℃ 90 s,进行29个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,送至生工生物工程(上海)股份有限公司测序。测序结果通过BLAST比对进行核苷酸序列相似性分析,采用MEGA 7.0的邻接法(Neighbor-joining,NJ)构建系统发育进化树,并以1000次Bootstrap进行置信度检测。
1. 3 病原菌致病力分析
1. 3. 1 人工感染试验与半数致死剂量(LD50)测定
对低温保存的病原菌株进行活化,接种于营养肉汤培养基,28 ℃振荡培养6~8 h,离心去除培养基后以无菌PBS制成菌悬液,并稀释为1.00×106、1.00×105、1.00×104、1.00×103和1.00×102 CFU/mL等5个浓度梯度。试验设5个试验组和1个对照组,每组20尾巴马拟缨鱼,经MS-222麻醉后,试验组巴马拟缨鱼腹腔注射菌悬液(60.0 μL/尾),对照组注射等量无菌PBS。试验期间持续泵气增氧,水温(28±1)℃,连续观察7 d,每天记录各组巴马拟缨鱼的死亡情况,观察其病症并对死亡个体进行剖检。根据死亡统计结果采用SPSS 24.0计算病原菌株对巴马拟缨鱼的LD50,并再次对人工感染后具有典型症状的病鱼进行病原菌分离鉴定,检验其与原致病菌是否一致。
1. 3. 2 毒力基因检测 选取气单胞菌属中已报道的6种常见毒力基因进行PCR检测(表1),包括4种外毒素基因[溶血素基因(hly)、气溶素基因(aer)、细胞毒性肠毒素基因(act)和细胞兴奋性肠毒素基因(alt)]、1种胞外蛋白酶基因——丝氨酸蛋白酶基因(ahp)和1种黏附素基因(ahal)。PCR反应体系同1.2.3,扩增程序参照相关文献(表1)并稍加改进。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,委托生工生物工程(上海)股份有限公司测序。
1. 4 药敏试验
参照美国临床和实验室标准化协会(CLSI)公布的抗菌药物敏感试验执行标准及相關文献(罗土炎等,2018),采用K-B药敏纸片扩散法检测病原菌对9种抗菌药物的敏感性。取50.0 μL菌悬液(约1.00×108 CFU/mL)均匀涂布于MHA培养基上,将药敏纸片平铺于培养基表面,28 ℃恒温培养24 h后观察并测量抑菌圈直径,判定病原菌对药物的敏感性。
2 结果与分析
2. 1 病原菌分离与鉴定结果
从患病巴马拟缨鱼的心脏、肝脏和脾脏等组织中分离获得1株优势菌株(命名为BM178)。将BM178菌株接种至营养琼脂培养基上,其菌落形态特征为圆形,中央凸起,边缘光滑,颜色呈灰白色(图1-A);革兰氏染色结果显示BM178菌株为革兰氏阴性短杆菌(图1-B)。API 20NE生理生化鉴定结果(表2)表明,BM178菌株与胡子鲶源嗜水气单胞菌参考菌株HZN-500(龙苏等,2016b)的生理生化特性基本一致,仅在阿拉伯糖发酵方面存在差异,故初步判定BM178菌株为嗜水气单胞菌。
PCR扩增获得BM178菌株的16S rRNA序列和gyrB基因,其序列长度分别为1325和1044 bp,对应的GenBank登录号为MN559379和MN587713。基于16S rRNA序列的BLAST比对及系统发育进化分析结果表明,BM178菌株与豚鼠气单胞菌(A. caviae)QW14株和嗜水气单胞菌GX5株的相似性均达100.0%,且聚在同一分支上(图2),三者的亲缘关系最近;基于gyrB基因的系统发育进化分析则显示,BM178菌株与嗜水气单胞菌NSAH-05株的相似性达100.0%,亲缘关系最近,随后与其他嗜水气单胞菌聚类,最后与豚鼠气单胞菌聚为一大支(图3)。综合BM178菌株的形态特征、API 20NE生理生化鉴定谱及分子生物学鉴定结果,可确定其为嗜水气单胞菌。
2. 2 病原菌致病力分析结果
以不同浓度梯度(1.00×102~1.00×106 CFU/mL)的菌悬液分别对健康巴马拟缨鱼进行腹腔注射,结果(表3)显示,最小菌悬液浓度组(1.00×102 CFU/mL)的7 d累计死亡率为0;随着菌悬液浓度的增加,各组巴马拟缨鱼均有死亡,且死亡率呈上升趋势;当菌悬液浓度达1.00×106 CFU/mL,腹腔注射后8~12 h即出现暴发性死亡现象,2 d内的累计死亡率达100.0%;而注射无菌PBS的巴马拟缨鱼未出现任何病变及死亡现象。根据巴马拟缨鱼死亡统计结果,计算得到BM178菌株对健康巴马拟缨鱼的LD50为1.26×102 CFU/g。人工感染发病巴马拟缨鱼的临床症状主要表现为鱼体游动缓慢、反应迟缓、摄食减少;胸鳍、腹鳍和臀鳍基部不同程度出血,肛门红肿(图4-A);内脏团有点状出血,肝脏充血,脾脏肿大(图4-B),肠道充血(图4-C),与自然发病巴马拟缨鱼的症状基本一致,均有别于健康巴马拟缨鱼(图4-D~图4-F)。对人工感染发病的巴马拟缨鱼再次进行病原菌分离,经鉴定与初次分离获得的BM178菌株相同,因此判定BM178菌株是引起巴马拟缨鱼暴发性死亡的致病菌。
毒力基因检测结果(图5)显示,在BM178菌株中6种常见毒力基因(hly、aer、act、alt、ahp和ahal)的检出率为100.0%,即毒力基因型为hly+aer+act+alt+ahp+ahal+。PCR扩增得到的毒力基因片段大小与预期结果一致,对应的GenBank登录号分别为MN587716(hly基因)、MN587717(aer基因)、MN 587720(act基因)、MN587718(alt基因)、MN587715(ahp基因)和MN587714(ahal基因)。
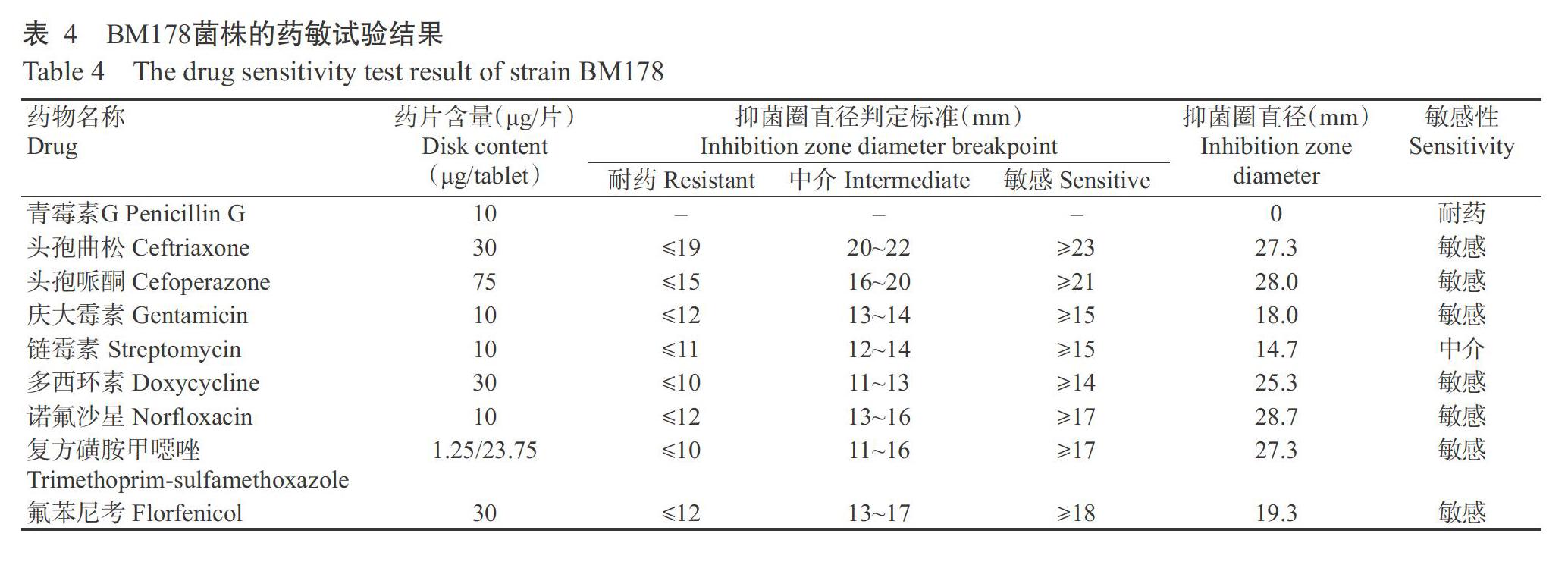
2. 3 病原菌药敏试验结果
由表4可知,BM178菌株对头孢曲松、头孢哌酮、庆大霉素、多西环素、诺氟沙星、复方磺胺甲噁唑和氟苯尼考等7种抗菌药物高度敏感,而对青霉素G已产生较强的耐药性。
3 讨论
嗜水气单胞菌广泛分布于自然界,是典型的人—畜—水生动物共患病原菌。近年来,先后从胡子鲶(Clarias fuscus)、異育银鲫(Carassius auratus gibe-lio)、山瑞鳖(Palea steindachneri)和西伯利亚鲟(Acipenser baerii)等不同感染宿主体内分离鉴定出嗜水气单胞菌(龙苏等,2016b;曹青等,2017;韩书煜等,2017;叶彩燕等,2018),且该细菌可引发急性出血性败血症,导致水产动物暴发性死亡,给水产养殖业带来巨大经济损失。本研究首次从患病巴马拟缨鱼的内脏组织中分离获得1株优势菌株(BM178),综合其形态特征、生理生化特性及分子生物学鉴定和致病力分析结果,确定引起巴马拟缨鱼暴发性死亡的致病菌为嗜水气单胞菌。其中,BM178菌株的阿拉伯糖试验结果呈阴性,与绝大多数鱼源嗜水气单胞菌的阿拉伯糖代谢特性(曹青等,2017;王艺等,2019)存在差异,但与加州鲈源嗜水气单胞菌LY4株的结果(叶伟东等,2018)一致。在分解已二酸和柠檬酸等方面,BM178菌株与怀头鲇源嗜水气单胞菌NY-12株(李绍戊等,2018)和禾花鲤源嗜水气单胞菌TH3株(邓小红等,2017)间存在差异,可能是种间差异所致,也可能与地域来源有关。分子生物学鉴定是在核酸水平上快速、准确地对细菌种属进行鉴定的方法。高度保守的16S rRNA序列是细菌鉴定的理想靶基因;而gyrB基因是相对保守但又存在一定变异率的管家基因,其碱基替换率(7.0%~8.0%/千万年)远高于前者(0.2%/千万年),更适用于相似度较高的属内近缘种鉴定(徐先栋等,2016)。本研究在生理生化鉴定的基础上,选用16S rRNA序列和gyrB基因进行鉴定,结果显示,在基于16S rRNA序列相似性构建的系统发育进化树中BM178菌株与豚鼠气单胞菌QW14株和嗜水气单胞菌GX5株聚为一支,难以确定其种类;而基于gyrB基因序列相似性的聚类分析结果表明,BM178菌株与嗜水气单胞菌的相似性高于其与豚鼠气单胞菌的相似性,故确定BM178菌株为嗜水气单胞菌。
本研究的人工感染试验结果表明,BM178菌株在短时间内可导致巴马拟缨鱼暴发性死亡,对巴马拟缨鱼的LD50为1.26×102 CFU/g。依据Mittal等(1980)将嗜水气单胞菌LD50在104~105 CFU/g时判定为强毒株的标准,可知BM178菌株具有较强毒力,属于强致病菌株。嗜水气单胞菌的致病机理复杂,涉及到外毒素、胞外蛋白酶和黏附素等多种毒力因子(田佳鑫等,2017)。刘杰等(2015)研究发现hly和act基因是嗜水气单胞菌的重要毒力基因,由于这2种外毒素均具有溶血性和细胞毒性,可直接作用于宿主细胞导致其裂解死亡(胡安东等,2019)。此外,各种毒力因子在致病性方面具有协同效应,当嗜水气单胞菌携带hly和act基因,且同时携带aer、alt、ahp和ahal基因中的2种或2种以上毒力基因时,即认定为强毒株。本研究对BM178菌株常见毒力基因的PCR扩增结果显示,hly、aer、act、alt、ahp和ahal等6种毒力基因在BM178菌株中均有表达,符合强毒株的特征。综合人工感染试验结果,可判定BM178菌株即为强毒株,且对巴马拟缨鱼的强致病力是多个毒力基因协同作用的结果。
目前,在水产养殖过程中使用抗菌药物仍是疫病防控的主要手段。因此,有针对性开展药敏试验,对科学用药和疫病防治均具有重要指导意义。本研究的药敏试验结果表明,BM178菌株对头孢曲松、头孢哌酮、庆大霉素、多西环素、诺氟沙星、复方磺胺甲噁唑和氟苯尼考等7种抗菌药物高度敏感。其中,对复方磺胺甲噁唑和氟苯尼考的敏感性与罗土炎等(2018)、时少坤等(2019)的研究结果一致,而对头孢曲松、头孢哌酮、庆大霉素、多西环素和诺氟沙星等5种药物的敏感性与李绍戊等(2018)、时少坤等(2019)的研究结果存在一定差异,可能与菌株来源及地区间的用药差异有关,但具体原因有待进一步探究。此外,BM178菌株对青霉素G已产生耐药性,与多数研究结果(徐先栋等,2016;王艺等,2019)一致。Penders和Stobberingh(2008)研究认为,嗜水气单胞菌对青霉素类药物具有固有耐药性,可能与其拥有多重可诱导的β-内酰胺酶有关。β-内酰胺酶可破坏青霉素类药物结构中的β-内酰胺环,从而导致此类药物失去抗菌效果(李梅等,2018)。药敏试验结果可为水产养殖过程中的疾病防控提供科学依据,但实际用药仍需严格执行国家的相关规定及政策。农业农村部发布的《水产养殖用药明白纸2019年1号》文件中明确指出,头孢曲松、头孢哌酮和诺氟沙星等抗生素属于禁用药物;而在《水产养殖用药明白纸2019年2号》文件中,多西环素、复方磺胺甲噁唑和氟苯尼考是国务院兽医行政管理部门已批准的水产用兽药,因此建议选用这3种药物进行防治。
4 结论
嗜水气单胞菌是引起巴马拟缨鱼暴发性死亡的主要病原菌,具有较强的致病性,实际生产中可选用多西环素、复方磺胺甲噁唑或氟苯尼考进行防治。
参考文献:
曹青,张向阳,庞茂达,王楠楠,Furqan Awan,陆承平,刘永杰. 2017. 南京地区某渔场嗜水气单胞菌流行菌株的鉴定及分子分型[J]. 水产学报,41(1):134-141. [Cao Q,Zhang X Y,Pang M D,Wang N N,Furqan A,Lu C P,Liu Y J. 2017. Identification and molecular typing of the epidemic Aeromonas hydrophila strains in one farm of Nanjing[J]. Journal of Fisheries of China,41(1):134-141.]
陈婷婷. 2014. 团头鲂源嗜水气单胞菌流行病调查及致病性、耐药性研究[D]. 武汉:华中农业大学. [Chen T T. 2014. The study of the epidemiology investigation and pathogenicity,drug-resistance characteristics of Aeromonas hydrophila isolated from Megalobrama amblycephala[D]. Wuhan:Huazhong Agricultural University.]
程光平,高天翔,薛彥霞,韦绍军,游永珍,马旦梅. 2008. 巴马繐唇鲃年龄与生长特性[J]. 中国海洋大学学报,38(4):547-550. [Cheng G P,Gao T X,Xue Y X,Wei S J,You Y Z,Ma D M. 2008. Age and growth characteristics of Crossocheilus bamaensis Fang. sp nov[J]. Periodical of Ocean University of China,38(4):547-550.]
邓小红,梁静真,黎姗梅,吕小丽,韦慕兰,韩书煜,蒙兰丽,黄钧,蒋经运. 2017. 禾花鲤致病性嗜水气单胞菌的分离鉴定、耐药性及毒力基因检测[J]. 西南农业学报,30(4):952-956. [Deng X H,Liang J Z,Li S M,Lü X L,Wei M L,Han S Y,Meng L L,Huang J,Jiang J Y. 2017. Isolation,identification,antibiotic resistance and virulence genes detection of pathogenic Aeromonas hydrophila in Cyprinus carpio[J]. Southwest China Journal of Agricultural Sciences,30(4):952-956.]
韩书煜,梁静真,覃志彪,黄艳华,韦慕兰,蒙兰丽,黄维,胡大胜,黄钧. 2017. 山瑞鳖细菌性败血症病原菌的分离鉴定及其毒力基因检测[J]. 水产学报,41(9):1443-1454. [Han S Y,Liang J Z,Qin Z B,Huang Y H,Wei M L,Meng L L,Huang W,Hu D S,Huang J. 2017. Isolation,identification and virulence genes detection of pathogenic bacteria from Palea steindachneri with bacterial septicemia[J]. Journal of Fisheries of China,41(9):1443-1454.]
何涛,邹升,龚亮,赵峰,周朋吉,李艳平,曹丽娜,丁学知,夏立秋. 2018. 草鱼病原菌AvX005的分离鉴定及其拮抗菌筛选研究[J]. 水产科学,37(1):15-23. [He T,Zou S,Gong L,Zhao F,Zhou P J,Li Y P,Cao L N,Ding X Z,Xia L Q. 2018. Isolation of pathogenic strain AvX005 and screening of its antagonistic bacteria in grass carp Ctenopharyngodon idellus[J]. Fisheries Science,37(1):15-23.]
胡安东,张明洋,张飘,杨霞,程振涛,姜海波,文明. 2019. 鲤源嗜水气单胞菌分离鉴定、耐药性及毒力基因检测[J]. 中国畜牧兽医,46(7):2167-2175. [Hu A D,Zhang M Y,Zhang P,Yang X,Cheng Z T,Jiang H B,Wen M. 2019. Isolation,identification,drug resistance and virulence genes detection of Aeromonas hydrophila from carp[J]. China Animal Husbandry & Veterinary Medicine,46(7):2167-2175.]
黄新财,彭民毅,黄钧,胡大胜,彭亚,黄艳华,施金谷,温华成,韦贵花. 2013. 黄颡鱼源嗜水气单胞菌对盐酸沙拉沙星耐药性获得与消失速率的测定[J]. 南方农业学报,44(10):1731-1734. [Huang X C,Peng M Y,Huang J,Hu D S,Peng Y,Huang Y H,Shi J G,Wen H C,Wei G H. 2013. Acquisition and vanishing rate of drug resistance of Aeromonas hydrophila in Pelteobagrus fulvidraco against sarafloxacin hydrochloride[J]. Journal of Southern Agriculture,44(10):1731-1734.]
雷雪平,耿毅,邓龙君,甘维熊,黄小丽,陈德芳,欧阳萍. 2019. 长丝裂腹鱼温和气单胞菌的分离鉴定及药敏检测[J]. 水产科学,38(1):109-114. [Lei X P,Geng Y,Deng L J,Gan W X,Huang X L,Chen D F,Ouyang P. 2019. Isolation,identification and antibiotic susceptibility of pathogenic bacterium Aeromonas sobria from fish Schizothorax dolichonema[J]. Fisheries Science,38(1):109-114.]
李梅,孙灵灵,袁宗辉,黄玲利. 2018. 兽用头孢菌素类抗生素研究进展[J]. 中国畜牧兽医,45(7):1978-1989. [Li M,Sun L L,Yuan Z H,Huang L L. 2018. Research progress on veterinary cephalosporins[J]. China Animal Husban-dry & Veterinary Medicine,45(7):1978-1989.]
李绍戊,王荻,曹永生,刘红柏,卢彤岩. 2018. 怀头鲇体表溃烂症病原鉴定及致病性分析[J]. 水产学报,42(9):1446-1453. [Li S W,Wang D,Cao Y S,Liu H B,Lu T Y. 2018. Identification of the causative pathogen causing skin-ulcer in Silurus soldatovi and its pathogenicity[J]. Journal of Fisheries of China,42(9):1446-1453.]
刘杰,黄艳华,黄钧,胡大胜,梁静真,彭亚,龙苏,牛志伟,韩书煜,植淇业. 2015. 黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J]. 中国水产科学,22(4):698-706. [Liu J,Huang Y H,Huang J,Hu D S,Liang J Z,Peng Y,Long S,Niu Z W,Han S Y,Zhi Q Y. 2015. Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J]. Journal of Fishery Sciences of China,22(4):698-706.]
龙苏,邓小红,梁静真,牛志伟,韩书煜,范华龙,黄钧. 2016a. 禾花鲤鱼种暴发性死亡征病原菌的分离鉴定及药敏试验[J]. 南方农业学报,47(7):1241-1246. [Long S,Deng X H,Liang J Z,Niu Z W,Han S Y,Fan H L,Huang J. 2016a. Isolation,identification and drug sensitivity test of pathogen causing fulminant death of Procypris merus fingerling[J]. Journal of Southern Agriculture,47(7):1241-1246.]
龙苏,韩书煜,牛志伟,梁静真,胡大胜,黄钧,李鸿骥,刘齐,苏江华. 2016b. 胡子鲶致病性气单胞菌的分离鉴定及其致病力与毒力基因型相关性[J]. 水产学报,40(3):308-317. [Long S,Han S Y,Niu Z W,Liang J Z,Hu D S,Huang J,Li H J,Liu Q,Su J H. 2016b. Isolation and identification of pathogenic Aeromonas in Clarias fuscus and analysis of the correlation between its pathogenicity and virulence genotypes[J]. Journal of Fisheries of China,40(3):308-317.]
罗土炎,饶秋华,刘洋,张志灯,罗钦,陈美珍,任丽花,黄敏敏,翁伯琦. 2018. 澳洲龙纹斑源致病菌嗜水气单胞菌TPF-2的分离鉴定及药敏特性研究[J]. 中国预防兽医学报,40(11):1009-1014. [Luo T Y,Rao Q H,Liu Y,Zhang Z D,Luo Q,Chen M Z,Ren L H,Huang M M,Weng B Q. 2018. Isolation and identification of Aeromonas hydrophila strain TPF-2 from murray cod(Maccullochella peelii peelii) and its antibiotic sensitivity[J]. Chinese Journal of Preventive Veterinary Medicine,40(11):1009-1014.]
牛志偉,吕小丽,范华龙,梁静真,蒙兰丽,韩书煜,黄钩. 2016. 我国耐喹诺酮类嗜水气单胞菌毒力基因及耐药基因检出情况的系统评价[J]. 南方农业学报,47(9):1587-1595. [Niu Z W,Lü X L,Fan H L,Liang J Z,Meng L L,Han S Y,Huang J. 2016. Systematic review on virulence genes of quinolones-resistant Aeromonas hydrophila and detection of drug-resistangt genes in China[J]. Journal of Southern Agriculture,47(9):1587-1595.]
庞卫,潘艳云,覃志彪,冯健,蒋步国,罗波. 2010. 野生巴马拟缨鱼肌肉营养成分研究[J]. 水生生物学报,34(4):885-889. [Pang W,Pan Y Y,Qin Z B,Feng J,Jiang B G,Luo B. 2010. The analysis of biochemical composition in muscle of wild Pseudocrossocheilus bamaensis[J]. Acta Hydrobiologica Sinica,34(4):885-889.]
秦莉. 2014. 白斑狗鱼嗜水气单胞菌败血症病原的分离鉴定及致病性研究[D]. 乌鲁木齐:新疆农业大学. [Qin L. 2014. The Aeromonas hydrophila sepsis pathogen of nor-thern pike(Esox lucius) isolaton,identification and pa-thogenic research[D]. Urumqi:Xinjiang Agricultural University.]
时少坤,喻大鹏,雷美华,黄浦江,周文川,赵秋龙,鲁义善,冯卫权. 2019. 深圳黄喉拟水龟致病嗜水气单胞菌的分离、鉴定及药敏分析[J/OL]. 基因组学与应用生物学. http://kns.cnki.net/kcms/detail/45.1369.Q.20190620.1044.002.html. [Shi S K,Yu D P,Lei M H,Huang P J,Zhou W C,Zhao Q L,Lu Y S,Feng W Q. 2019. Isolation and identification of pathogenic Aeromonas hydrophila isolated from Mauremys mutica in Shenzhen[J/OL]. Genomics and Applied Biology. http://kns.cnki.net/kcms/detail/45. 1369.Q.20190620.1044.002.html.]
田佳鑫,张冬星,康元环,安鼎杰,孙武文,单晓枫,王桂芹. 2017. 团头鲂致病嗜水气单胞菌的分离鉴定与毒力基因的检测及耐药分析[J]. 中国兽医科学,47(1):100-108. [Tian J Z,Zhang D X,Kang Y H,An D J,Sun W W,Shan X F,Wang G Q. 2017. Isolation and identification,virulence factor detection and susceptibility test of pathogen Aeromonas hydrophila isolated from Megalobrama amblycephala[J]. Chinese Veterinary Science,47(1):100-108.]
王艺,刘文珍,傅松哲,吴葵,夏与晴,华昕彤,刘鹰,欧阳敏. 2019. 一株从草鱼中分离的嗜水气单胞菌的病原学及基因组特征[J]. 水产学报,43(4):1181-1191. [Wang Y,Liu W Z,Fu S Z,Wu K,Xia Y Q,Hua X T,Liu Y,Ou-yang M. 2019. Etiology and genomic characteristics of an Aeromonas hydrophila strain isolated from Ctenopharyngodon idella[J]. Journal of Fisheries of China,43(4):1181-1191.]
徐先栋,付辉云,饶毅,盛银平,王海华,傅义龙,李彩刚,周永灿. 2016. 草鱼暴发性出血病病原分离、毒力基因检测与药敏分析[J]. 上海海洋大学学报,25(3):350-358. [Xu X D,Fu H Y,Rao Y,Sheng Y P,Wang H H,Fu Y L,Li C G,Zhou Y C. 2016. The virulence characteristics and drug susceptibility of outbreak hemorrhage disease pathogen isolated from grass carp Ctenopharyngodon idllus[J]. Journal of Shanghai Ocean University,25(3):350-358.]
叶彩燕,汪开毓,刘韬,贺扬,王二龙,杨倩,何琦瑶,谢恒,何晟毓. 2018. 西伯利亚鲟致病性嗜水气单胞菌的分离鉴定[J]. 中国预防兽医学报,40(3):195-199. [Ye C Y,Wang K Y,Liu T,He Y,Wang E L,Yang Q,He Q Y,Xie H,He S Y. 2018. Isolation and identification of pathogenic Aeromonas hydrophila isolated from Acipenser baerii[J]. Chinese Journal of Preventive Veterinary Medicine,40(3):195-199.]
叶伟东,郭成,曹海鹏,杨先乐. 2018. 加州鲈出血病嗜水气单胞菌的分离鉴定、致病性和体外抑菌药物研究[J]. 淡水渔业,48(5):54-60. [Ye W D,Guo C,Cao H P,Yang X L. 2018. Isolation,identification,pathogenicity and in vitro antibacterial drugs of pathogenic Aeromonas hydrophila from Micropterus salmoides with hemorrhagic disease[J]. Freshwater Fisheries,48(5):54-60.]
張鹗,陈景星. 1997. 中国缨鱼属鱼类的分类整理及一新属描述(鲤形目:鲤科)[J]. 动物分类学报,22(3):321-326. [Zhang E,Chen J X. 1997. A taxonomical revision of the genus Crossocheilus in China and a description of a new genus from China(Pisces:Cyprinidae)[J]. Acta Zootaxonomica Sinica,22(3):321-326.]
赵贤亮,陈鹤,杨潇,巴新霞,李莉,孔祥会. 2017. 黄河鲤嗜水气单胞菌的分离、毒力及用药分析[J]. 水产科学,36(5):642-646. [Zhao X L,Chen H,Yang X,Ba X X,Li L,Kong X H. 2017. Isolation,virulence,resistance and medication of Aeromonas hydrophila from common carp Cyprinus carpio[J]. Fisheries Science,36(5):642-646.]
Borrell N,Acinas S G,Figueras M J,Martínez-Murcia A J. 1997. Identification of Aeromonas clinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes[J]. Journal of Clinical Microbiology,35(7):1671-1674.
Mittal K R,Lalonde G,Leblanc D,Olivier G,Lallier R. 1980. Aeromonas hydrophila in rainbow trout:Relation between virulence and surface characteristics[J]. Canadian Journal of Microbiology,26(12):1501-1503.
Penders J,Stobberingh E E. 2008. Antibiotic resistance of motile aeromonads in indoor catfish and eel farms in the southern part of the Netherlands[J]. International Journal of Antimicrobial Agents,31(3):261-265.
Wang C,Xie S,Chang X L,Huang D M. 2015. Length-weight relationships of ?ve ?sh species from the Hongshui River,China[J]. Journal of Applied Ichthyology,31(6):1180-1181.
Yá?ez M A,Catalán V,Apráiz D,Figueras M J,Martínez-Murcia A J. 2003. Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology,53(3):875-883.
Zhang M,Liu B W,Cheng G P,Bian L,Zhou Q J,Yan W J,Li W H. 2018. The complete mitochondrial genome of Pseudocrossocheilus bamaensis(Cypriniformes:Cyprinidae:Labeoninae)[J]. Conservation Genetics Resources,10(3):371-374.
(責任编辑 兰宗宝)

