牛轮状病毒VP4基因RT-qPCR检测方法的建立
拜小强,耿金静,白生菊,魏锁成*,李琼毅
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030)
轮状病毒(Bovine rotavirus,BRV)是引起哺乳期犊牛群发病毒性腹泻的主要病原之一,约占犊牛腹泻病例的46%[1]。7日龄内的新生犊牛因消化系统和免疫系统尚未发育完全,而易发感染且病症严重,以食欲废绝、消化道机能紊乱及水样粪便为典型临床症状[2]。该病毒具有株型众多、易发重排、宿主广泛、传播迅速等生物学特性,加之该病致死率最高达50%,尚无高效疫苗和特效药物,使得牛养殖业遭受了巨大的经济损失[3]。另外,已证实RV可在人畜间交叉传播,也对人类公共卫生安全存在潜在威胁[4-7]。
BRV为双链RNA病毒,属呼肠孤病毒科、轮状病毒属成员,病毒粒子呈直径60~80 nm的二十面体立体对称结构,其双链RNA基因组由11个不连续的基因片段组成,共编码6个结构蛋白(VP1~4、VP6、VP7)和6个非结构蛋白(NSP1~6)[8]。其中第4片段编码的VP4黏附蛋白,由776个氨基酸组成,相对分子量约为88 kDa,现已被证实与BRV的毒力、血凝作用及抗原特性存在密切联系[9]。有研究表明,轮状病毒入侵宿主细胞过程中,VP4蛋白被胰蛋白酶水解为VP5和VP8两个多肽[10]。VP5(60 kDa)与病毒吸附及侵入功能相关,进而破坏细胞抑制机制,而VP8(28 kDa)含血凝素抗原和中和抗原,聚集着VP4的主要抗原位点,在疫苗研发过程中发挥着至关重要的作用[11]。因此,经胰酶消化激活的VP4结构蛋白使得BRV的致病性大大增强[12]。轮状病毒株型众多,根据VP4抗原特性,将BRV分为不同的P型(P-serotype)[13],基于VP4的分型功能和抗原特性,该基因片段可用作BRV的检测靶点,为建立特异的病原检测方法提供了理论支持。目前,实验室检测BRV的方法主要有经典病原检测(电镜和病毒分离)、免疫学检测(ELISA)和基因检测(PCR)三类,荧光定量PCR能快速鉴别诊断病原,具有灵敏度高、特异性强、可实时定量监控等优点,被用于目的基因测试、基因表达分析、病原体检测中[14]。本研究以BRV VP4基因作为检测靶基因设计引物,建立了EvaGreen荧光定量RT-PCR检测方法,为牛轮状病毒的快速检测诊断提供一种经济高效的检测手段。
1 试验材料与方法
1.1 毒株、细胞及病料
牛轮状病毒NCDV株购自中国兽医微生物菌种保藏中心(保存编号:AV51),MA-104细胞接毒培养物-80℃保存;感受态细胞BL-21、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、牛冠状病毒(Bovine coronavirus,BCV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)和牛结核分枝杆菌(Mycobacterium bovis,MB)保存于西北民族大学生物工程与技术国家民委重点实验室;1月龄以下犊牛腹泻(持续腹泻3 d以上)粪便样品共47份采集自甘肃兰州市、张掖市和甘南州。
1.2 主要试剂
主要试剂和来源见表1。
1.3 病料样本处理
将采集的犊牛腹泻粪便样品与PBS按1∶10混合,涡旋振荡混匀后25℃、3 000 rpm离心20 min,吸取上清液,按轮状病毒诊断试剂盒(酶联免疫法)说明书步骤进行定性检测,测得的阳性样品保存于-80℃冰箱中。
1.4 引物设计
参考Genbank(Accession:JF693029)发表的BRV VP4核苷酸序列,利用Primer Premier 5.0设计引物(BRV-VP4-F/BRV-VP4-R),经NCBI Primer-BLAST分析验(见表2),完成设计的引物交由北京擎科生物技术有限公司合成。
1.5 重组质粒标准品制备
取BRV毒液和ELISA检测阳性样本,用病毒RNA提取试剂盒提取RNA,反转录得cDNA作为模板进行PCR,产物经琼脂糖凝胶电泳验证,凝胶DNA回收试剂盒回收目的条带连接至pMD 18-T克隆载体,用质粒提取试剂盒提取质粒,送北京擎科生物技术有限公司测序。经核酸蛋白检测系统测定的阳性重组质粒保存于-20℃备用。

表1 主要试剂和来源

表2 引物序列信息
1.6 优化反应条件
RT-qPCR反应体系:EvaGreen RT-qPCR Master Mix 25 μl;上下游引物(BRV-VP4-F/R)各1 μl;待测cDNA模板5 μl;DEPC水18 μl;总体积50 μl。对设定的变性、退火、延伸反应条件进行系统优化。pMD 18-T-VP4质粒标准品以10-1~103共5个梯度稀释(copies/μl)后重复3次EvaGreen荧光定量检测,建立横轴为模板起始拷贝数对数值,纵轴为Ct值的标准曲线。
1.7 敏感性检测
对构建的pMD 18-T-VP4质粒标准品进行 10-1、100、101、102和103梯度稀释,用优化后的反应条件进行3次重复检测,对比分析得出最低检测限度。
1.8 特异性试验
用建立的EvaGreen荧光定量检测方法对BRV、BVDV、BCV、CSFV、PEDV和MB进行检测,每个样品做3次重复试验,同时设置空白和阴性对照。
1.9 重复性试验
对pMD 18-T-VP4质粒标准品作5个倍比稀释(10-1、10-2、10-3、10-4、10-5),进行RT-qPCR检测,记录Ct值,根据建立的标准曲线可得出VP4基因含量(copies/μl)。组内重复试验:将5个梯度稀释的阳性质粒进行RT-qPCR检测,以标准曲线方程计算拷贝数,每个浓度重复测量3次,求组内平均值、标准差和变异系数。组间重复试验:不同质粒含量的标准品进行RT-qPCR 3次独立重复试验,求组间平均值、标准差和变异系数。
2 结果
2.1 BRV VP4基因的扩增
以反转录的cDNA为模板,用VP4基因引物进行扩增,经琼脂糖凝胶电泳验证,结果表明扩增的条带约为890 bp,与测序结果一致(见图1)。

图1 VP4基因扩增条带
2.2 RT-qPCR标准曲线
对建立的RT-qPCR反应条件进行优化,最佳反应条件:95 ℃预变性15 min;95 ℃变性15 s、55 ℃退火30 s、72 ℃延伸40 s,共40个循环;72 ℃再延伸10 min。以优化后的RT-qPCR检测5个不同浓度(10-1~103)的重组质粒pMD 18-T-VP4,其Ct值分别为29.02、25.35、20.78、17.86和14.73。得出标准曲线(见图2)。
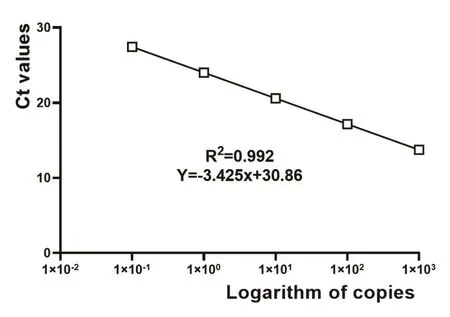
图2 重组质粒标准曲线
标准曲线的斜率为-3.425,截距为30.86,相关系数 R2=0.992,Ct值之间呈良好的线性关系。回归方程为Y=-3.425X+30.86;X为阳性质粒模板拷贝数以10为底的对数值。从而可以得出X与Ct值之间的线性关系曲线方程式为Ct=30.86-3.425X。不同浓度重组质粒的Ct值,从试验结果中直接读取,Ct值代入标准曲线方程可计算出VP4初始拷贝数。
表3 RT-qPCR检测BRV VP4重复性试验结果
2.3 敏感性试验结果
5个梯度稀释(10-1~103)的pMD 18-T-VP4质粒标准品的Ct值分别为29.02、25.35、20.78、17.86和14.73,用标准曲线方程计算出的拷贝数分别为1.72×103、3.25×102、5.76×101、7.21×100和9.36×10-1,表明该方法的最低检出量为7.21 copies/μl。
2.4 特异性试验结果
用建立的RT-qPCR检测BRV、BVDV、BCV、CSFV、PEDV和MB。试验结果显示,仅BRV出现扩增曲线,其他病毒和细菌无任何扩增,阴性对照亦无扩增,即只对BRV的cDNA有良好的扩增,表明建立的方法有良好的特异性(见图3)。
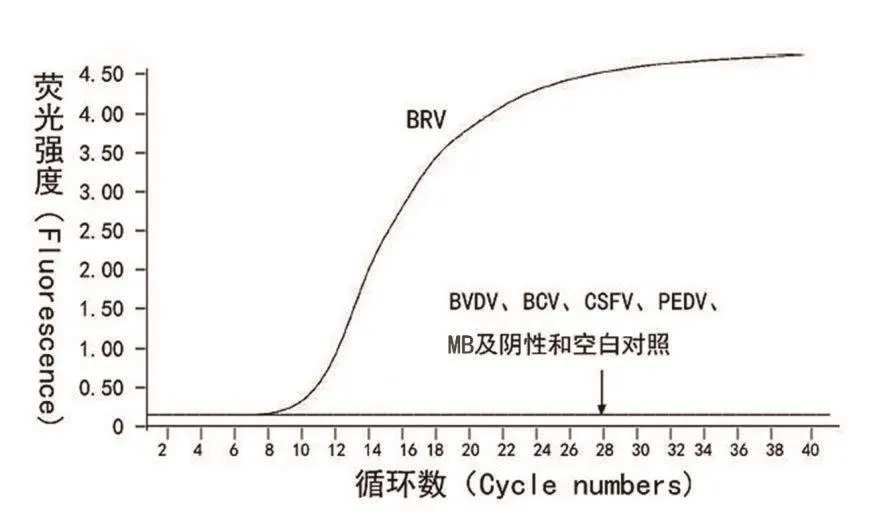
图3 BRV RT-qPCR特异性检测
2.5 重复性试验结果
通过对5个稀释度的pMD 18-T-VP4重复检测,组内CV为0.95 %~1.12 %;组间CV为1.55 %~2.18%(见表3),表明RT-qPCR方法稳定可靠。
2.6 临床样本检测
应用本研究建立的RT-qPCR检测方法检测21份ELISA阳性粪样,结果显示:19份呈阳性,2份为阴性,与ELISA检测的阳性符合率为90.47 %。
3 讨论
轮状病毒在人与动物、不同动物之间有一定的交叉感染,婴幼儿和低龄动物容易通过粪-口途径感染RV,造成小肠绒毛缩短,绒毛上皮细胞凋亡,机能减退为病症的急性胃肠道传染病[14,15]。在牛群中感染A组轮状病毒最为常见[16],1980年福建畜牧兽医研究所首次在我国发现BRV的存在[17],随后在各地牛群中陆续分离出不同株型的BRV[18-20],以G10和G6株型最为普遍[21]。VP4基因编码衣壳黏附蛋白,通常根据VP4确定BRV的基因型。尽管VP4蛋白在病毒蛋白总量的约为1.5 %[22],但同基因型毒株比对,VP4的核苷酸序列和氨基酸序列高度保守,同源性可达94.6 %~97.8 %[23],在保证病毒毒力的情况下,可以将该基因作为靶基因进行BRV病原检测。持续感染(PI)动物是主要的传染源,成年牛只隐性感染BRV且持续排毒,能高效、准确地检测隐性持续感染动物成为阻断BRV传播、净化牛养殖场的关键一步。
实时荧光定量PCR根据荧光信号的变化对PCR过程进行实时监控,在畜禽传染病原检测中得到广泛的应用[24-26]。目前以VP4基因作为靶点建立的BRV荧光定量PCR报道较少,本试验应用相对保守的VP4基因作为检测靶点,扩增目的片段后连接载体,重组获得质粒标准品,稀释后绘制标准曲线。建立的RT-qPCR最低检测量为7.21 copies/μl;同步检测5种病毒/菌均无扩增曲线,阴性对照亦无扩增;组内重复和组间重复变异系数分别为0.95%~1.12 %和1.55%~2.18%;应用该方法检测21份ELISA阳性样本,检测符合率为90.47 %。经临床样品检测,证实本方法可行,为牛轮状病毒的初步筛查诊断提供了一种可参考的检测手段。

