甘氨酸通过PTEN/Akt通路减轻脑出血大鼠神经损伤
韩鲜艳,张 芾,孙贵祥
(如皋市人民医院神经内科,江苏 南通 226500)
脑出血是脑卒中最严重的一种亚型,具有高发病率、高致残率和高致死率,严重威胁着人们的身体健康,给家庭和社会带来了沉重的经济负担[1],目前还没有好的方法可以提高脑出血患者的生存率并改善其生活质量。甘氨酸作为一种非必需氨基酸在细胞代谢过程中发挥着非常重要的作用。
甘氨酸是一种神经递质抑制剂,通过与甘氨酸受体的结合抑制突触后神经元的活动。有研究发现,甘氨酸在缺血再灌注、缺氧、低氧以及活性氧造成的脑组织神经损伤的疾病中具有神经保护作用[2-4]。本实验旨在探讨甘氨酸对脑出血造成的神经损伤的作用及其机制。
1 材料与方法
1.1 试剂与仪器
甘氨酸(美国sigma公司),磷酸酶与张力蛋白同源物基因(phosphatase and tensin homologous gene,PTEN)多克隆抗体(美国Millipore公司),蛋白激酶B(protein kinase B,Akt)多克隆抗体(美国Millipore公司),β-actin抗体(美国Millipore公司),羊抗鼠/兔IgG(北京中杉金桥生物技术有限公司),伊文思蓝染液(美国Invitrogen公司),RNA提取试剂盒,反转录试剂盒(美国Illumina公司)。超声破碎仪(上海欧河机械设备有限公司),稳压稳流电泳仪(北京六一仪器厂),立体定定位仪(美国Thermo Scientific公司),PCR反应扩增仪(美国Bio-Rad公司)。
1.2 实验动物及分组
SPF级SD大鼠,雄性,280~300 g,48只,由中国医科大学动物实验中心提供,保持室温在(25±2) ℃,相对湿度(55±10)%,12 h的昼/夜循环,大鼠可以自由的摄入食物和水。侧脑室注射自体血建立大鼠脑出血模型并称取体质量编号后,采用随机数字表法将大鼠分为假手术组、模型组、甘氨酸0.5 mg/kg组和甘氨酸2 mg/kg组,每组各12只。
1.3 方法
1.3.1 脑出血模型的制备 按照Rosenberg法进行大鼠脑出血模型的建立[5]:用10%的水合氯醛对大鼠进行麻醉,将大鼠固定在立体仪上,局部消毒后,于头部正中纵向切口,使骨膜剥离,于前囱之前2.0 mm、中线右侧3.0 mm处钻孔(1 mm),用微量进样器取大鼠股动脉血适量,借助立体定位仪从钻孔处垂直进针与右侧尾状壳核处,注入80 μL血液,留针10 min后撤针,缝合,消毒。假手术组步骤同上,但是不注入血液。
术后清醒的大鼠按照Zeal Longar 5级评分法判断脑出血模型的建立是否成功。0分:无明显神经病学症状;1分:不能完全伸展左前肢;2分:向左侧旋转;3分:行走时向左侧倾倒;4分:不能自行行走,有意识障碍。累计1分以上即判定为造模成功。造模第二天,甘氨酸0.5 mg/kg组和甘氨酸2 mg/kg组侧脑室注射甘氨酸,给药剂量分别为0.5 mg/kg和2 mg/kg[6-7],假手术组和模型组侧脑室给等量的生理盐水,给药后48 h处死。
1.3.2 脑组织含水量的测定 每组随机取4只大鼠,麻醉后断头处死,取大鼠的脑组织,称重,记为湿重。然后将大鼠的脑组织置于100 ℃的烘箱中72 h,再称重,记为干重。脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.3.3 血脑屏障通透性检测 每组随机取4只大鼠,尾静脉注射2%伊文思蓝染液(evans blue dye,EB,5 mL/kg),2 h后水合氯醛麻醉,左心室灌流。取大鼠的脑组织,称重,加入适量的甲酰胺,60 ℃水浴24 h,匀浆后1 000 r/min离心10 min,取上清液,635 nm波长处检测吸光度,计算EB含量。
1.3.4 血肿块体积检测 取剩余4只大鼠脑组织,准备好连续的血肿块冠状切片后,拍照,然后用Image J软件测量血肿块体积。
1.3.5 TUNEL染色法检测脑组织细胞凋亡的情况 取实验2.2.4中大鼠脑组织,将大鼠脑血肿组织做成石蜡切片,过氧化氢(3%)室温孵育5 min,柠檬酸盐(0.01 mol/L)100 ℃修复10 min,BSA(5%)室温封闭1 h,TUNEL(1∶500)室温孵育90 min,荧光素抗体(1∶500)37 ℃孵育60 min,Hoechst室温孵育5 min,封片,荧光显微镜观察。
1.3.6 Real-timePCR检测大鼠脑组织Akt mRNA和PTEN mRNA的表达 取适量大鼠脑组织,液氮研磨后加入适量的Trizol提取RNA,根据Prime Script RT试剂盒说明书进行反转录,根据SYBR Premix Ex TaqTMII试剂盒说明书进行PCR操作。采用相对定量的方法计算样本间的相对百分比。△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照。目的mRNA的量=2-ΔΔCt。

表1 引物序列
1.3.7 Western blot检测PTEN蛋白和Akt蛋白的表达水平 取适量大脑组织加入适量的含PMSF的RIPA裂解液,用超生破碎仪裂解,4 ℃离心(12000 g,10 min),取上清液,用BCA试剂盒测蛋白浓度,然后加入适量的上样缓冲液,沸水浴变性。将各组蛋白加入到12%的SDS-聚丙烯酰胺凝胶中电泳,电泳完毕后转膜,PVDF膜用1∶1 000的PTEN、Akt和β-actin抗体进行孵育。二抗的稀释比例为1∶4 000,然后用凝胶成像分析仪显影,用ImageJ进行半定量分析。
1.4 统计学方法
2 结 果
2.1 大鼠脑组织含水量、EB含量、脑肿块体积
4组大鼠脑组织含水量、EB含量比较见表2。与假手术组比较,模型组脑组织含水量、EB含量升高。与模型组比较,甘氨酸2 mg/kg组脑组织含水量、EB含量显著性降低。与甘氨酸0.5 mg/kg组比较,甘氨酸2 mg/kg组脑组织含水量、EB含量显著降低。与假手术组比较,模型组脑肿块体积明显增大,与模型组比较,给予脑甘氨酸干预后显著性降低,其中甘氨酸2 mg/kg组脑肿块体积降低显著。
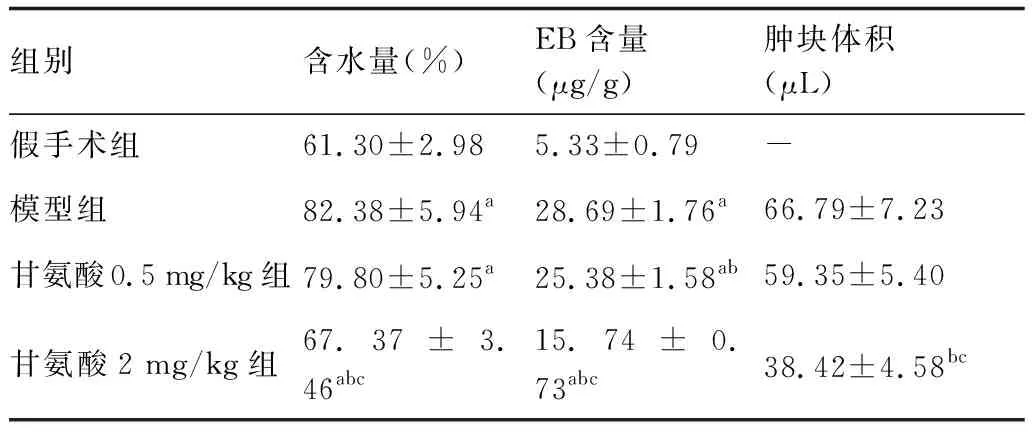
表2 各组大鼠脑组织含水量、EB含量及脑肿块体积的比较
2.2 各组大鼠脑组织细胞凋亡情况
与假手术组比较,模型组大鼠脑组织凋亡细胞数量显著升高;与模型组比较,给予甘氨酸后,凋亡细胞的数量降低,而且随着给药剂量的增加,凋亡细胞的数量进一步降低,见图1。
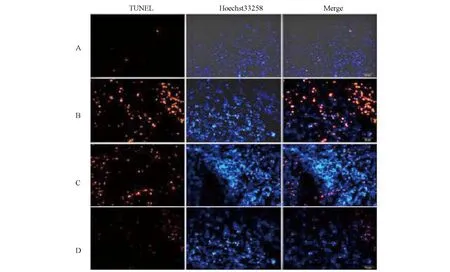
图1 甘氨酸对ICH后脑组织细胞凋亡的影响(200×)A:假手术组;B:模型组;C:甘氨酸0.5 mg/kg组;D:甘氨酸2 mg/kg组
2.3 大鼠脑组织Akt mRNA、PTEN mRNA的表达水平
4组大鼠脑组织Akt mRNA、PTEN mRNA表达水平比较见表3。与假手术组比较,模型组Akt mRNA表达水平降低,PTEN mRNA表达水平升高。与模型组比较,甘氨酸可升高Akt mRNA表达水平,降低PTEN mRNA表达水平,其中2 mg/kg甘氨酸最为显著。
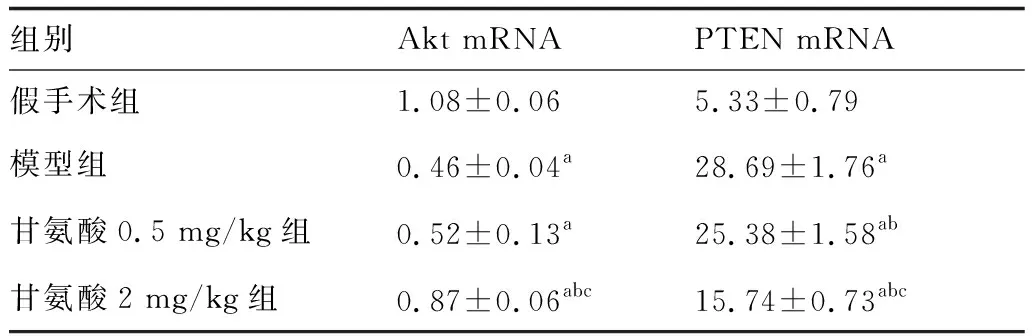
表3 各组脑组织Akt mRNA、PTEN mRNA的表达水平比较
2.4 大鼠脑组织Akt蛋白、PTEN蛋白表达水平
4组脑组织Akt、PTEN蛋白表达水平比较见图2和表4。与假手术组比较,模型组Akt、p-Akt蛋白水平降低,PTEN蛋白水平升高。与模型组比较,甘氨酸可升高Akt、p-Akt蛋白水平,降低PTEN蛋白水平,其中甘氨酸2 mg/kg作用最为显著。
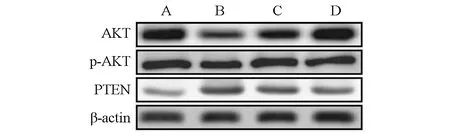
图2 各组大鼠脑组织Akt蛋白、PTEN蛋白的表达A:假手术组;B:模型组;C:甘氨酸0.5 mg/kg组;D:甘氨酸2 mg/kg组
3 讨 论
甘氨酸作为结构最简单的非必需氨基酸,参与机体很多的病理生理学过程。在中枢神经系统中甘氨酸可以作为神经递质参与信号的传递[8]。PTEN/Akt信号通路在细胞增殖、分化和凋亡等过程中发挥着非常重要的作用[9]。PTEN是人的第10号染色体缺失的磷酸酶及张力蛋白同源的基因,主要的作用底物是PIP3,使其脱磷酸变成PIP2,从而抑制Akt的激活,抑制细胞的分裂,最终造成细胞凋亡[10]。而PTEN的突变或者缺失会造成Akt的激活,活化的Akt可以调节细胞的转录因子,降低细胞凋亡的发生,使蛋白质的表达水平升高从而促进细胞分裂、转化、迁移以及代谢[11]。
本实验发现,与假手术组比较,模型组PTEN蛋白及mRNA的表达显著性升高,而Akt蛋白及mRNA的表达显著性的降低,给予甘氨酸干预后,PTEN蛋白和mRNA的表达水平降低,Akt蛋白和mRNA的表达升高。此外,模型组脑组织中凋亡细胞的数量显著升高,给予甘氨酸干预后凋亡细胞的数量降低,这可能是由于甘氨酸通过下调PTEN基因的表达,使Akt活性增强,间接抑制下游凋亡基因的表达,从而使神经细胞的凋亡受到抑制,发挥保护神经组织的作用。有研究也发现,在缺氧缺糖造成的大鼠神经损伤的模型中,甘氨酸可以通过抑制PTEN的表达发挥神经保护的作用[12]。
脑出血不仅通过直接的机械作用导致原发性脑损伤,也会引起继发性的脑损伤例如血脑屏障通透性的破坏。血脑屏障的破坏引发脑水肿,进而引起神经组织的损伤以及细胞凋亡,加重细胞功能障碍和坏死[13]。脑水肿使脑组织液体增多致使脑容积变大,根据血脑屏障是否受到破坏,可以将脑水肿分为血管源型水肿以及细胞毒性水肿。本实验研究发现,模型组大鼠脑组织血脑屏障通透性降低,脑水肿情况加剧,甘氨酸干预后,大鼠脑组织血脑屏障通透性升高而且脑水肿减轻,由此可见,甘氨酸具有较好的保护脑组织的作用。
综上所述,甘氨酸能够通过抑制PTEN的表达从而导致Akt的激活,进一步抑制下游凋亡基因的表达,从而减轻脑细胞凋亡、降低血脑屏障通透性、减轻脑水肿,发挥神经保护的作用。

