白藜芦醇通过介导内脏脂肪NPY表达改善限食后重饲大鼠胰岛素敏感性
王素星,李会英,吕彩霞,邵伟华,李秀芩,姚丽霞(河北省人民医院老年病二科,石家庄 05005;河北省人民医院超声科;通信作者,E-mail:83383@qq.com)
人体的各种生理活动都离不开能量的支持,能量供应产生波动,可影响人体的各种生理活动,导致机体代谢发生一系列改变[1]。限食后的重饲为短期热卡限制后重新开放饮食,可导致能量摄入的波动。不适当限食减肥后饮食反弹、疾病和疾病的康复等均伴随热卡摄取的波动[2]。有研究显示,成年期追赶生长以胰岛素抵抗和内脏脂肪堆积为重要特征[3],追赶生长即较短期内能量摄入的波动,可导致胰岛素敏感性的降低和内脏脂肪增多。内脏脂肪细胞既是能量储存器官,又具有强大的内分泌功能[4]。它可产生大量脂肪细胞因子、激素、炎症介质等直接进入肝脏及全身组织,在胰岛素信号转导水平诱导胰岛素抵抗[5]。神经肽Y(neuropeptide Y,NPY)是食欲刺激因子,与能量波动密切相关[6]。多项研究表明,NPY过表达可以造成大鼠内脏脂肪增多的肥胖表型,而低表达则促进能量代谢,有助于减轻体质量,促使白色脂肪向棕色脂肪转化,阻止代谢性疾病的发生发展[7]。
白藜芦醇是一种主要存在于虎杖、葡萄、藜芦、花生等植物中的多酚类化合物。以往的研究表明,白藜芦醇可以抑制脂肪生成,刺激脂肪分解,增加脂肪酸氧化和热生成[8]。口服白藜芦醇亦可以安全地减少小鼠过量热量摄入导致的诸多负面后果,缓解与肥胖有关的外周和中枢炎症和代谢紊乱,总体上改善健康和生存[9]。目前,白藜芦醇对限食后重饲大鼠胰岛素敏感性改善作用机制尚未明确。所以本研究以此为切入点,观察白藜芦醇对限食后重饲大鼠内脏脂肪NPY表达的影响以及对胰岛素敏感性的改善作用,以期为与白藜芦醇的有关保健产品与食品的开发利用提供参考依据。
1 材料与方法
1.1 实验动物
48只健康SPF级6周龄SD雄性大鼠,体质量160-180 g,由河北医科大学科研实验动物饲养中心提供,实验动物生产许可证号SCXK(冀)2018-004,饲料垫料生产许可证号SCXK(冀)2018-003。动物房温度控制在20-25 ℃,湿度在50%-60%,自由饮水,光照时间12 h(7:00-19:00)。
1.2 主要试剂与仪器
Western blot一抗兔抗大鼠NPY抗体(英国,Abcam Company公司),二抗山羊抗兔IgG(重链+轻链,辣根过氧化物酶);DEXA仪由美国GE Lunar公司生产。TNF-α、IL-6、FFA、胰岛素测定采用ELASA试剂盒(Pierce公司),微量输注泵(浙江大学医学仪器有限公司),稳步血糖仪(强生),重组人胰岛素(诺和诺德),一次性留置针。
1.3 研究方法
48只大鼠适应性喂养1周后,随机分为6组,每组10只:正常饮食4周(NC4)组、热卡限制4周(R4)组,热卡限制白藜芦醇干预(R4R)组;以及正常饮食12周(NC12)组、限食后重饲组(RN)、限食后重饲白藜芦醇干预(RNR)组。分别在实验第4和12周末进行相关指标检测,统计学分析仅限于相同时间点组别之间进行。其中,热卡限制4周组和限食后重饲组给予正常饮食组相同体质量大鼠进食量60%的标准基础饲料4周,限食后重饲组在接下来的8周给予正常饮食组相同体质量大鼠等量的标准基础饲料和100 mg/(kg·d)白藜芦醇干预,热卡限制白藜芦醇干预组在热卡限制同时亦给予白藜芦醇[100 mg/(kg·d)]干预4周。普通饲料购自河北医科大学实验动物学部。所有实验程序均经河北省人民医院伦理委员会批准。白藜芦醇用生理盐水配制成浓度15 mg/ml的悬浊液,根据体质量每天灌胃给予白藜芦醇(100 mg/kg)干预,热卡限制4周组和限食后重饲组灌胃给予以同体积生理盐水。
1.4 指标检测
1.4.1 体脂成分检测 大鼠禁食过夜,精确称量体质量,腹腔注射戊巴比妥(30 mg/kg)麻醉,待大鼠肌力消失,呼吸平稳,仰卧位将四肢用胶带固定于硬纸板,选用美国GE Lunar公司生产的DEXA仪行躯干脂肪含量及躯干与全身脂肪比例测定。
1.4.2 高胰岛素-正糖钳夹实验第60-120分钟的平均葡萄糖输注速率(average glucose infusion rate during 60-120 min,GIR60-120)测定 大鼠限食过夜后,进行120 min清醒状态下大鼠尾动静脉插管高胰岛素-正糖钳夹试验(以下简称正糖钳夹),计算GIR60-120。糖钳开始前尾静脉留取空腹血。具体操作过程参阅课题组以前操作[10]。糖钳结束后,以致死量戊巴比妥钠(150 mg/kg)腹腔注射处死大鼠,迅速完整剥离肾周脂肪组织,一部分迅速10%甲醛固定用于形态学观察,其余组织液氮罐冻存留作Western blot检测。
1.4.3 空腹血糖、胰岛素检测 采用葡萄糖氧化酶法测定空腹血糖(fasting plasma glucose,FPG),放免法测定空腹胰岛素(fasting insulin,FINS)的浓度,遵照胰岛素放免试剂盒说明书逐步进行。
1.4.4 肾周脂肪细胞形态学测定 肾周脂肪组织10%多聚甲醛固定,梯度酒精脱水,二甲苯透明石蜡包埋切片,厚8 μm。常规HE染色,封片后光学显微镜下观察。
1.4.5 Western blot测定NPY表达 选取肾周脂肪组织,参照既往文献[11]方法提取并定量组织蛋白。取80 μg蛋白样品行SDS-PAGE电泳、转膜、封闭,分别用NPY、β-actin 4 ℃孵育过夜;次日洗膜、二抗孵育1 h、采用BIO-RAD Image Lab软件进行灰度值分析。
1.4.6 胰岛素抵抗相关指标测定 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)、游离脂肪酸(free fatty acid,FFA)测定采用酶联免疫吸附剂测定试剂盒,具体操作步骤严格按照试剂盒说明书进行。
1.5 统计学方法
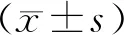
2 结果
2.1 躯干脂肪含量比较
热卡限制4周后,R4组躯干脂肪含量及躯干与全身脂肪比例与NC4组相比,差异无统计学意义(P>0.05);重饲8周后,RN组躯干脂肪含量及躯干与全身脂肪比例与NC12组相比显著升高(P<0.01)。白藜芦醇干预后,R4R组躯干与全身脂肪比例较R4组显著下降(P<0.05),RNR组躯干脂肪含量及躯干与全身脂肪比例较RN组均显著下降(P<0.05),达到NC组水平,但R4R组躯干脂肪含量较R4组差异无统计学意义(P>0.05,见表1,2)。

表1 白藜芦醇干预前后4周组大鼠躯干脂肪含量和躯干与全身脂肪比例比较

表2 白藜芦醇干预前后12周组大鼠躯干脂肪含量和躯干与全身脂肪比例比较
2.2 肾周脂肪细胞HE染色
与NC12组相比,RN组肾周脂肪细胞体积显著增大,形状不规则,胞膜破裂、融合。白藜芦醇干预后,RNR组肾周脂肪细胞体积较RN组明显变小,形状规则、胞膜完整,接近NC12组(见图1)。
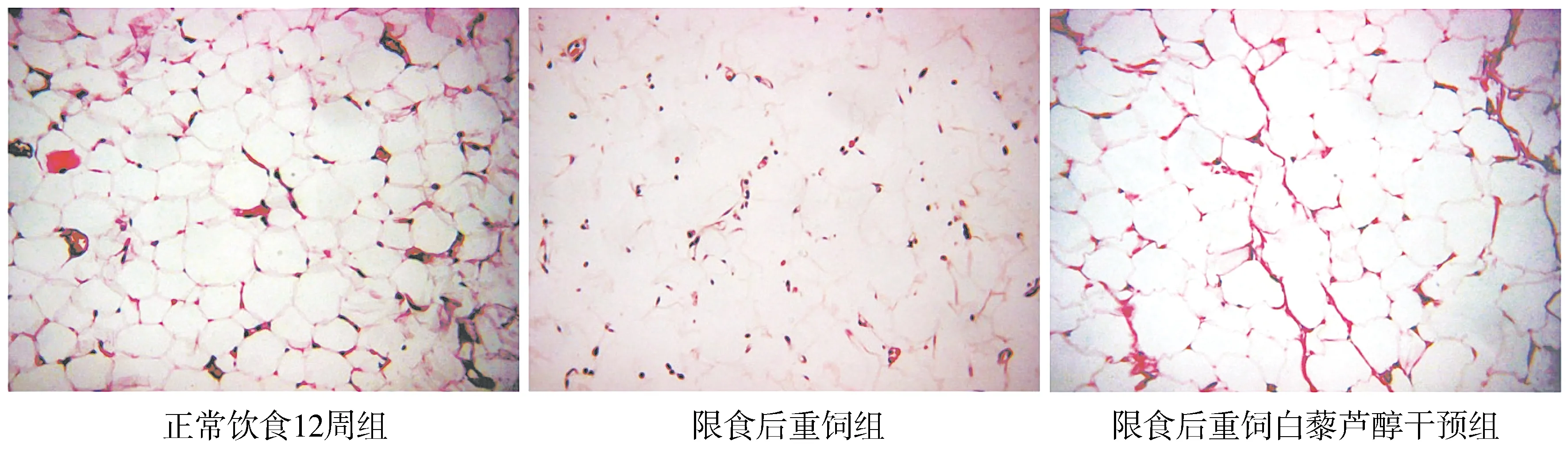
图1 白藜芦醇干预前后12周组大鼠肾周脂肪细胞HE染色 (×400)Figure 1 HE staining of perirenal adipocytes in rats in 12-week groups before and after resveratrol intervention
2.3 胰岛素敏感性检测结果
与NC4组相比,R4组FPG、FINS、GIR60-120差异均无统计学意义(P>0.05);开放饮食后,与NC12组相比,RN组FINS显著升高,GIR60-120明显下降(P<0.01),FPG变化无统计学意义(P>0.05)。白藜芦醇治疗后,RNR组FINS水平较RN组显著降低(P<0.01),但仍较NC12组高(P<0.05);R4R组FPG和FINS,RNR组FPG与未干预前相比,差异无统计学意义(P>0.05);R4R组GIR60-120较R4组无明显差异(P>0.05),RNR组GIR60-120明显高于RN组(P<0.01),恢复至NC12组水平(P>0.05,见图2-4)。

图2 白藜芦醇干预前后4周组和12周组大鼠空腹血糖比较Figure 2 Comparison of fasting plasma glucose of rats between 4-week groups and between 12-week groups before and after resveratrol intervention
与正常饮食4周组比较,△P<0.05;与正常饮食12周组比较,*P<0.05,**P<0.01;与限食后重饲组比较,##P<0.01图3 白藜芦醇干预前后4周组和12周组大鼠空腹胰岛素比较Figure 3 Comparison of fasting insulin of rats between 4-week groups and between 12-week groups before and after resveratrol intervention

与正常饮食12周组比较,**P<0.01;与限食后重饲组比较,##P<0.01图4 白藜芦醇干预前后4周组和12周组大鼠第60-120 min平均葡萄糖输注率比较Figure 4 Comparison of average glucose infusion rate during 60-120 min of rats between 4-week groups and between 12-week groups before and after resveratrol intervention
2.4 胰岛素抵抗相关指标比较
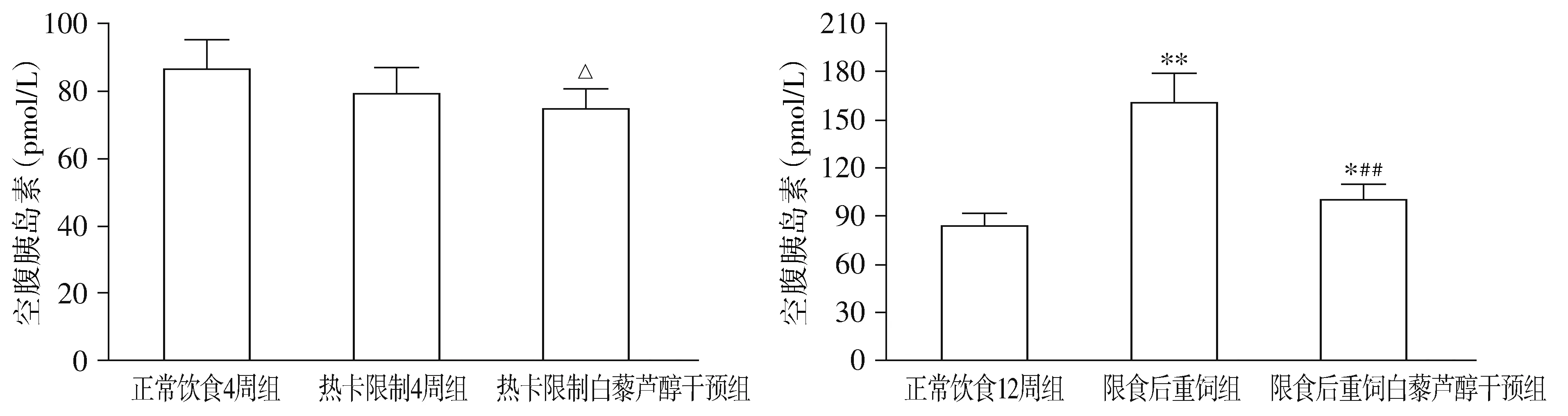
与NC4组相比,R4组热卡限制使血清TNF-α、IL-6水平明显降低(P<0.01),FFA水平升高(P<0.05)。重饲后,与NC12组相比,RN组血清TNF-α、IL-6及FFA水平均显著升高(P<0.01)。白藜芦醇干预后,与R4组相比,R4R组血清TNF-α、IL-6的浓度差异无统计学意义;FFA水平明显下降(P<0.05);与RN组比较,RNR组血清TNF-α、IL-6及FFA的浓度均显著下降(P<0.01),除RNR组血清IL-6水平降至NC12组水平(P>0.05),其他两指标仍较NC12组高(P<0.05,见图5-7)。
与正常饮食4周组比较,▲▲P<0.01;与正常饮食12周组比较,*P<0.05,**P<0.01;与限食后重饲组比较,##P<0.01图5 白藜芦醇干预前后4周组和12周组大鼠肿瘤坏死因子α比较Figure 5 Comparison of tumor necrosis factor-α in rats between 4-week groups and between 12-week groups before and after resveratrol intervention
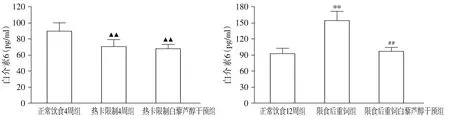
与正常饮食4周组比较,▲▲P<0.01;与正常饮食12周组比较,**P<0.01;与限食后重饲组比较,##P<0.01图6 白藜芦醇干预前后4周组和12周组大鼠白介素6比较Figure 6 Comparison of interleukin-6 in rats between 4-week groups and between 12-week groups before and after resveratrol intervention
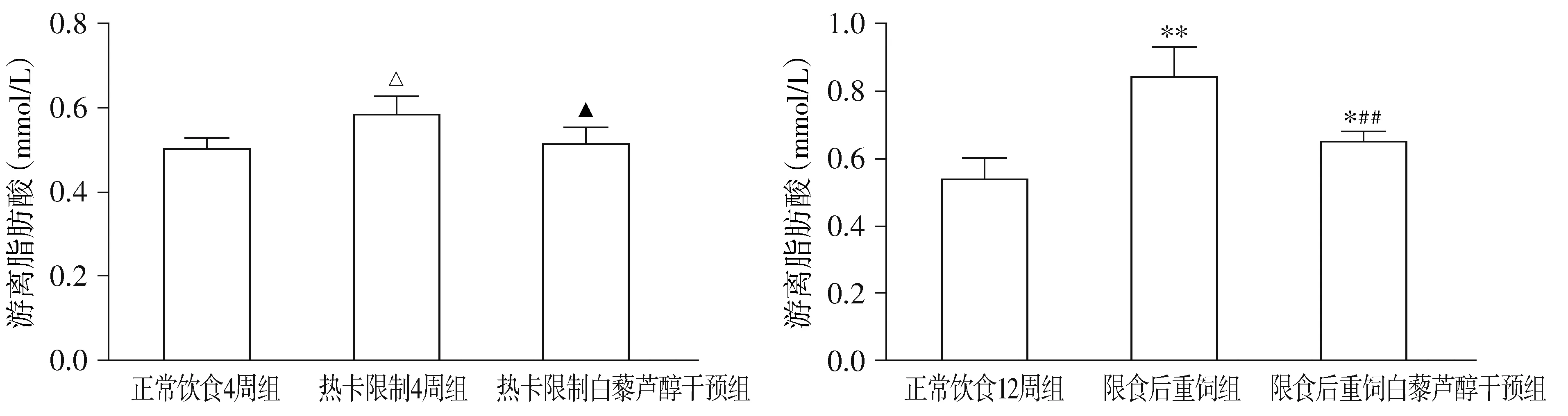
与正常饮食4周组比较,△P<0.05;与热卡限制4周组比较,▲P<0.05;与正常饮食12周组比较,*P<0.05,**P<0.01;与限食后重饲组比较,##P<0.01图7 白藜芦醇干预前后4周组和12周组游离脂肪酸比较Figure 7 Comparison of free fatty acid in rats between 4-week groups and between 12-week groups before and after resveratrol intervention
2.5 GIR60-120与胰岛素抵抗相关指标的相关性分析
GIR60-120与FFA、FINS、IL-6及TNF-α均呈显著负相关(r值分别为-0.701,-0.797,-0.695,-0.761,均P<0.01)。
2.6 Western blot结果
与NC4组相比,R4组热卡限制使肾周脂肪组织NPY蛋白表达显著增加(P<0.01);开放饮食8周后,RN组肾周脂肪组织NPY的蛋白表达轻度下降,但至实验结束,仍显著高于NC12组(P<0.01)。经白藜芦醇治疗后,R4R组和RNR组肾周脂肪组织NPY表达分别较R4组和RN组显著下降(P<0.01),其中RNR组恢复至NC12组水平(P>0.05),R4R组仍较NC4组为高(P<0.01,见图8)。

与正常饮食4周组比较,▲▲P<0.01;与热卡限制4周组比较,##P<0.01;与正常饮食12周组比较,**P<0.01;与限食后重饲组比较,△△P<0.01图8 白藜芦醇干预前后4周组和12周组大鼠肾周脂肪组织NPY蛋白表达的比较Figure 8 Comparison of NPY protein expression in perirenal adipose tissue of rats between 4-week groups and between 12-week groups before and after resveratrol intervention
3 讨论
NPY是明显的食欲刺激因子,其表达受能量摄入影响[6]。它不仅存在于中枢神经系统中,也存在于外周脂肪组织、骨骼、血管、肾脏等组织,参与调节机体多种重要的生理活动,对脂肪代谢亦有重要调节作用[12]。NPY作为外周脂肪增殖和分化相关细胞、外周脂肪细胞的生物效应分子,通过与其受体结合,在肥胖的形成中发挥重要作用[13]。本研究结果显示,肾周脂肪组织NPY的表达在热卡限制期间明显增加,恢复饮食后,虽有轻度下降,但至实验结束,其表达水平仍较正常对照组增加明显。有研究发现局部脂肪组织NPY表达增多,可促进新生脂肪形成[14]。该研究将包有NPY的缓释药片植入到鼠的皮下组织中,发现在药片植入的周围有新的脂肪生成[14]。故限食后重饲过程中,NPY在肾周脂肪组织的持续高表达,虽在限食阶段因没有充足营养供给使这种促进脂质生成的能力无法实现,但恢复饮食后促进脂肪生成增多,导致躯干部脂质含量及比例均显著增加,同时亦使脂肪细胞的体积越来越大,胞膜破裂,脂质外溢,炎症因子释放显著增多。正糖钳夹试验中葡萄糖输注率是评价胰岛素敏感性的重要指标,本研究结果亦显示,能量摄入改变过程中RN组出现GIR60-120下降、胰岛素水平升高,同时伴FFA、TNF-α、IL-6水平增加的胰岛素抵抗现象。本研究结果显示GIR60-120与FFA、TNF-α、IL-6水平呈显著负相关。炎症因子的激活使胰岛β细胞的结构和功能受到损伤、外周组织对胰岛素的敏感性降低[15],同时高水平FFA通过降低靶细胞膜上胰岛素受体的数目及其与胰岛素的亲和力,抑制胰岛素与受体的结合,降低胰岛素的生物效应[16]。以上因素均可导致胰岛素抵抗的形成。
NPY与脂肪代谢密切相关,RN组高表达的NPY使躯干脂肪含量增加,而内脏脂肪的增多与胰岛素敏感性关系密切。本研究结果显示,限食后重饲动物胰岛素敏感性的下降可能与内脏脂肪堆积有关。白藜芦醇治疗后,RNR组肾周脂肪的NPY表达大幅降低,与之伴行的,RNR组躯干部脂质含量及比例均显著降低,肾周脂肪细胞形态及胞膜完整性明显改善,FFA及炎症因子浓度亦明显降低,GIR60-120恢复至正常水平,胰岛素敏感性显著提高。故白藜芦醇通过降低内脏脂肪的NPY表达,减少内脏脂肪生成,改善胰岛素抵抗,增强机体胰岛素敏感性。关于白藜芦醇对NPY的影响,研究目前主要集中在白藜芦醇对下丘脑NPY的影响。研究发现,白藜芦醇可使高脂饮食的小鼠下丘脑弓状核NPY生成减少,进而影响脂肪生成,降低体质量[17]。白藜芦醇亦能够通过过度表达厌食肽(前阿片蛋白)和/或抑制食欲肽(神经肽Y/刺鼠相关肽)来恢复神经元中的瘦素信号,从而减少食物摄入[18]。白藜芦醇是沉默信息调节因子1(silencing information regulator 1,SIRT1)的强力激活剂,有研究显示NPY的缺失可激活SIRT1信号传导[19]。亦有研究显示,外源注射烟酰胺腺嘌呤二核苷酸可抑制NPY的转录活性,这种抑制作用部分是由SIRT1介导的[20]。以上研究可得出SIRT1与NPY的表达存在负性调控作用,故推测白藜芦醇亦可通过激活SIRT1,后者进一步抑制内脏脂肪NPY的表达,进而发挥抑制脂质合成的作用。
需要注意的是,白藜芦醇并不是在所有组均表现出了增加GIR60-120的效应。我们发现R4R组大鼠的GIR60-120不升高反而轻度降低。相对于RNR组白藜芦醇可显著增加实验模型GIR60-120的结果,我们分析R4组实验大鼠在热卡限制期末,GIR60-120轻度升高,空腹血糖、胰岛素水平轻度下降,虽较NC4组无统计学差异,但综合评估胰岛素的敏感性已呈轻度增高现象。在此基础上,即使白藜芦醇可抑制内脏脂肪NPY的表达,但对内脏脂肪含量本就不高、胰岛素敏感性已经很好的R4组大鼠,要想使胰岛素敏感性得到进一步提升,白藜芦醇的生物学效应就微乎其微。其中涉及的其他信号通路作用机制需进一步研究。
综上所述,白藜芦醇可能通过抑制以肾周脂肪为代表的内脏脂肪NPY表达进而减少躯干部脂肪堆积,减少内脏脂肪脂质外溢、炎症因子释放,最终改善限食后重饲大鼠胰岛素敏感性。

