氧化石墨烯纳米粒对SH-SY5Y细胞增殖和凋亡的影响
王凯旋,李明新,陈 玲,彭驰伟,陈 薇(桂林医学院药学院药理实验室,桂林 5400;桂林医学院附属医院药剂科;通信作者,E-mail:daicw04@63.com)
近年来,大量的纳米材料被不断地制备和研究,在工业生产中,纳米粒子是冶炼中常见的副产物,金属氧化物纳米颗粒可以通过各种冶金过程分散到空气中[1],有研究表明停留在鼻黏膜上的纳米粒子被认为可以进入中枢神经系统[2,3]。在生物医学领域中,因为纳米材料独特的结构与性质,可以更容易地跨过血脑屏障,避免药物传递问题[4],所以纳米粒子用于神经诊断和神经治疗要比传统方法更好[5,6];与此同时有研究发现部分纳米颗粒可导致神经毒性、神经炎症和神经退行性变等[7-10]。因此纳米粒子对中枢神经系统潜在的毒性也将成为评价纳米材料生物安全性的一项重要指标。
氧化石墨烯(graphene oxide,GO)又称功能化石墨烯,是一种由碳原子组成的单层蜂窝晶格材料,作为化学转化石墨烯的前体,目前在新能源汽车、橡胶等方面研究和产业化已取得较大进展。且因GO具有生产成本低、比表面积大、溶解度高、表面含有氧化基团易于引入功能基团进行功能改进等优势,其在生物医学,包括微生物检测、生物元件、疾病诊断和药物输运系统等的领域研究日渐瞩目[11-13]。无论是通过环境暴露还是直接接触,氧化石墨烯纳米粒子的暴露都对神经系统的稳定具有潜在的风险。本研究拟采用具有神经细胞特性,又可稳定传代的人神经母细胞瘤细胞SH-SY5Y细胞与纳米氧化石墨烯纳米共孵育,观察其对神经细胞增殖及凋亡的影响。研究氧化石墨烯纳米粒子对人神经系统的影响,为纳米氧化石墨烯的神经生物领域安全应用提供依据。
1 材料与方法
1.1 材料与仪器
SH-SY5Y细胞(南昌大学眼科实验室);胎牛血清(S711-001S,GIBCO公司);DMEM培养液(C11995500BT,GIBCO公司);PBS缓冲液,0.25%胰蛋白酶(GIBCO公司);氧化石墨烯(XF020,江苏先丰纳米材料科技有限公司);CCK-8试剂(CK04,日本同仁化学研究所);Bcl-2抗体(ab32124,英国Abcam公司)Bax抗体(ab32503,英国Abcam公司);超净工作台(上海苏净实验设备公司);多功能酶标仪(Infinite F500,,瑞士TECAN);Zeta电位仪(英国马尔文仪器有限公司);倒置荧光显微镜(IX73,日本OlYMPUS);实时荧光定量PCR仪(美国应用生物系统公司)。
1.2 方法与步骤
为研究纳米粒径的氧化石墨烯对神经细胞增殖及凋亡的影响。首先制备纳米级氧化石墨烯并测定其表征;然后采用人神经母细胞瘤细胞SH-SY5Y细胞,加入不同浓度已制备的氧化石墨烯(40,80,120,160,200,240,280,320,360 μg/ml)分别处理24 h和48 h,不加氧化石墨烯(0 μg/ml)设为正常对照组。采用CCK8试剂盒检测了各组浓度的GO对SH-SY5Y细胞增殖的影响。为探究GO抑制SH-SY5Y细胞增殖的作用机制,分别运用Western blot法检测线粒体凋亡关键蛋白Bcl-2和Bax的表达;RT-PCR法检测凋亡基因caspase-3,Bcl-2和Bax的水平。具体方法如下。
1.2.1 氧化石墨烯纳米材料的制备 使用超声破碎仪对购买的氧化石墨烯进行超声,将GO的粒径控制在300 nm以内。采用含血清的DMEM稀释成不同浓度40,80,120,160,200,240,280,320,360 μg/ml用于以下实验。
1.2.2 氧化石墨烯纳米材料的表征测定 粒径和Zeta电位测定:取适当浓度纳米级氧化石墨烯,加入比色皿和Zeta电位样品池中进行粒径和电位检测,重复3次。电镜观察:取适当浓度的GO滴一滴在铜网上,待其晾干后用透射电镜(TEM)观察。
1.2.3 SH-SY5Y细胞培养 液氮中取出细胞,用1 ml无菌枪头吸出细胞悬液加入到15 ml离心管内,加入2 ml DMEM培养液(含有10%胎牛血清、1% 100 U/ml的青霉素和链霉素混合液),1 000 r/min离心5 min,弃去上清液。在细胞沉淀中加入DMEM培养液,吹匀后接种于25 cm的细胞培养皿中,置于37 ℃,5% CO2的培养箱中培养。每两天换一次培养液,细胞生长至80%-90%时消化传代,取对数生长的的细胞进行下列实验。
1.2.4 CCK8法进行细胞毒性分析 取对数生长期的SH-SY5Y细胞以4×103/孔接种于96孔培养板,培养24 h,按照GO终浓度不同进行实验分组:0 μg/ml(即正常对照组)以及40,80,120,160,200,240,280,320,360 μg/ml,每组设置5个复孔,置于37 ℃,5% CO2的培养箱中培养24,48 h后弃去培养基,在每孔加入配置好的100 μl WST-8检测试剂,37 ℃孵育2 h后置于连续光栅型酶标仪,读取450 nm波长处吸光度值,然后计算细胞相对活力(%)=(OD实验组/OD对照组)×100%。
1.2.5 细胞形态学观察 取对数生长期的SH-SY5Y细胞以8×104/孔接种于6孔培养板,37 ℃,5% CO2培养24 h后加入含不同浓度GO(0,40,120,200,280,360 μg/ml)的培养液,再继续培养24,48 h,分别置于倒置显微镜下观察细胞形态变化并拍照。
1.2.6 Western blot法检测凋亡蛋白Bcl-2和Bax的表达 取对数生长期的SH-SY5Y细胞以2×105/孔接种于60 mm细胞培养皿,37 ℃,5% CO2培养24 h,按照1.2.5的给药浓度加入GO,分别继续培养24,48 h后,收集细胞,加入细胞裂解液,提取细胞总蛋白,并采用BCA试剂盒测定蛋白含量;经10% SDS-PAGE凝胶电泳分离,冰浴转移至PVDF膜上,5%脱脂牛奶室温封闭2 h,用1 ∶1 000稀释的Bcl-2、Bax一抗4 ℃孵育过夜,次日,采用对应1 ∶5 000浓度的二抗室温孵育1 h,应用化学发光显影,通过凝胶成像仪采集图片,蛋白表达水平采用Image-J进行定量分析。
1.2.7 RT-PCR法检测凋亡基因caspase-3、Bcl-2和Bax的水平 采用Trizol法提取各组细胞RNA,测定RNA浓度,按照逆转录试剂盒说明书将其逆转录成cDNA,反应条件:42 ℃,15 min,95 ℃,3 min,4 ℃结束。后续RT-PCR反应在95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火延伸30 s,40个循环条件下执行。结果采用2-ΔΔCt法计算各基因的表达水平。引物序列见表1。
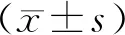
2 结果
2.1 GO的粒径及形貌
采用TEM对GO的形貌进行观察,结果显示:GO呈不规则片状分布,分散性良好,未发现明显聚集情况(见图1)。Zeta电位粒径仪结果显示GO的Zeta电位为(2.75±0.72)mV,平均有效粒径为(232.66±0.74)nm,多分散性指数(PDI)为0.018±0.006(见图2),表明粒径分布范围较窄,保证了本研究中GO的粒径均一性。
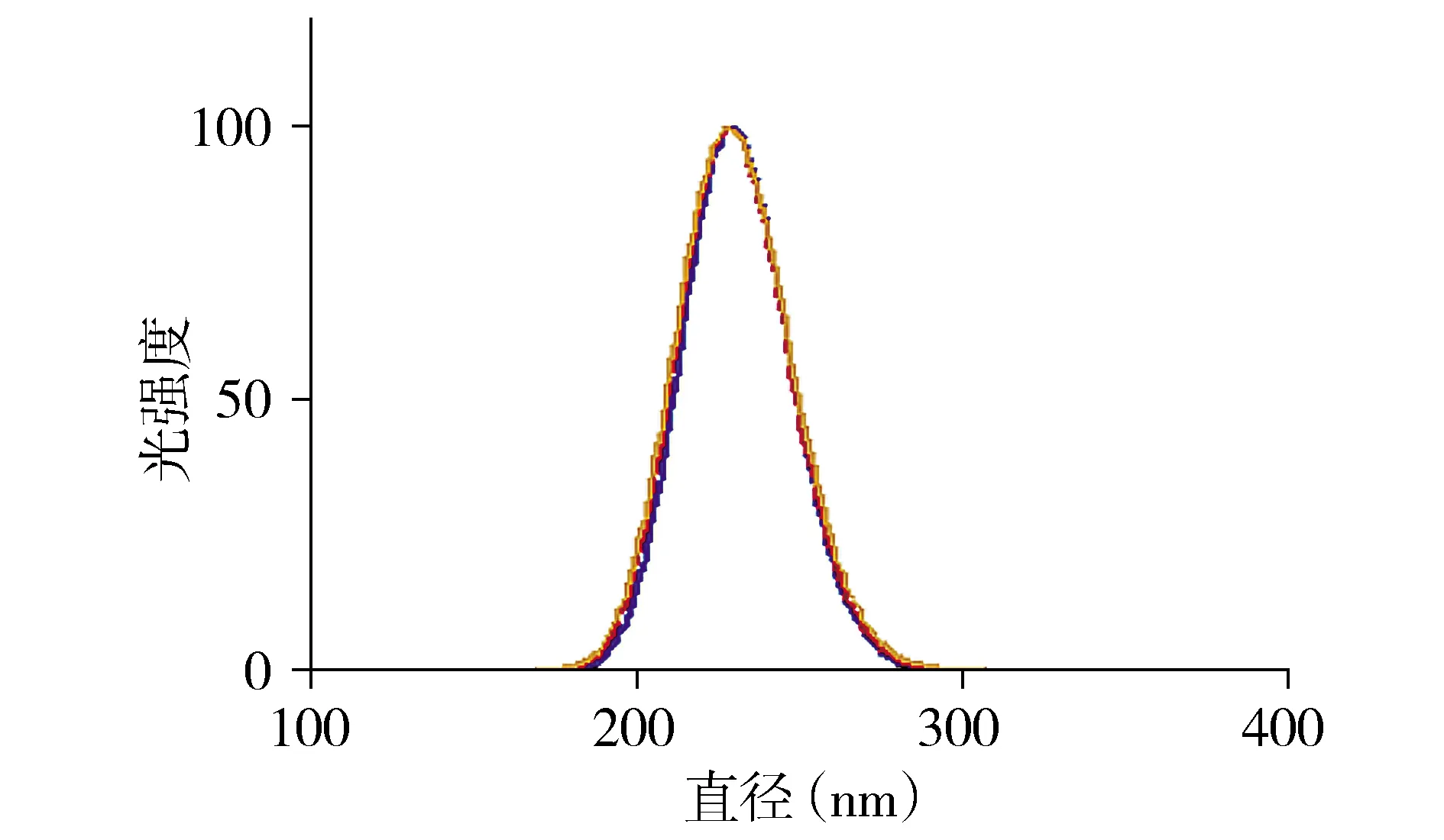
图2 氧化石墨烯粒径分布图Figure 2 The distribution of graphene oxide particle size
2.2 GO对细胞存活率的影响
CCK8结果显示,不同浓度的纳米GO悬液作用24,48 h,各组细胞的存活率受到不同程度的影响。细胞与GO悬液共孵育24 h,当GO浓度为40,80 μg/ml时,细胞相对活力(109.5%±21.5%,110.6%±18.5%)较正常对照组有增强趋势,并存在统计学差异(P<0.01,见图3),说明较低浓度的纳米GO有促进细胞生长作用;当GO浓度高于200 μg/ml时,细胞相对活力(82.5%±15.0%)与正常组比较降低,差异有统计学意义(P<0.001,见图3),说明高浓度(>200 μg/ml)纳米GO抑制细胞增殖,且从统计结果图中看出GO呈浓度依赖性抑制细胞活力。纳米GO作用48 h后,在160 μg/ml时可明显抑制细胞增殖,差异有统计学意义(P<0.001,见图3)。
2.3 GO对细胞形态的影响
不同浓度纳米GO悬液作用于SH-SY5Y细胞24 h,40 μg剂量组细胞形态和数量与正常组无明显区别;120 μg/ml剂量组多数细胞形态无明显变化,细胞密度稍有减少,生长略受抑制;200,280,360 μg/ml组的SH-SY5Y细胞生长明显受到抑制,可见细胞变圆,细胞数量减少,细胞间隙增大,且随着GO浓度增大,效果愈渐明显(见图4)。共孵育48 h,随着纳米GO浓度的增加,SH-SY5Y细胞的生长越受抑制,表现为细胞边缘逐渐模糊不规则,间隙增加及数量减少(见图4)。
A.GO与SH-SY5Y细胞共孵育24 h后细胞存活率变化 B.GO与SH-SY5Y细胞共孵育48 h细胞存活率变化与0 μg/ml相比,*P<0.05,**P<0.01,***P<0.001图3 不同浓度GO共孵育不同时间后对SH-SY5Y细胞存活率影响Figure 3 The cell viability of SH-SY5Y cells coincubated with different concentrations of GO for 24 h and 48 h
2.4 Western blot法检测Bax和Bcl-2蛋白表达
Western blot结果显示,随着GO的浓度增加,细胞内Bax蛋白上调,Bcl-2蛋白下调(见图5)。共孵育24 hBcl-2/Bax值分别为1.85±0.11,1.78±0.08,0.96±0.07,0.87±0.02,0.53±0.03,0.29±0.04;孵育48 h分别为1.24±0.09,0.98±0.11,0.68±0.07,0.52±0.04,0.18±0.02,0.07±0.01。120 μg/ml组Bcl-2/Bax值与正常组比较差异均有统计学意义(P<0.001,见图5),表明大于120 μg/ml的GO与细胞共孵育后会使SH-SY5Y细胞凋亡水平显著增加。
2.5 RT-PCR检测caspase-3,Bax和Bcl-2基因表达
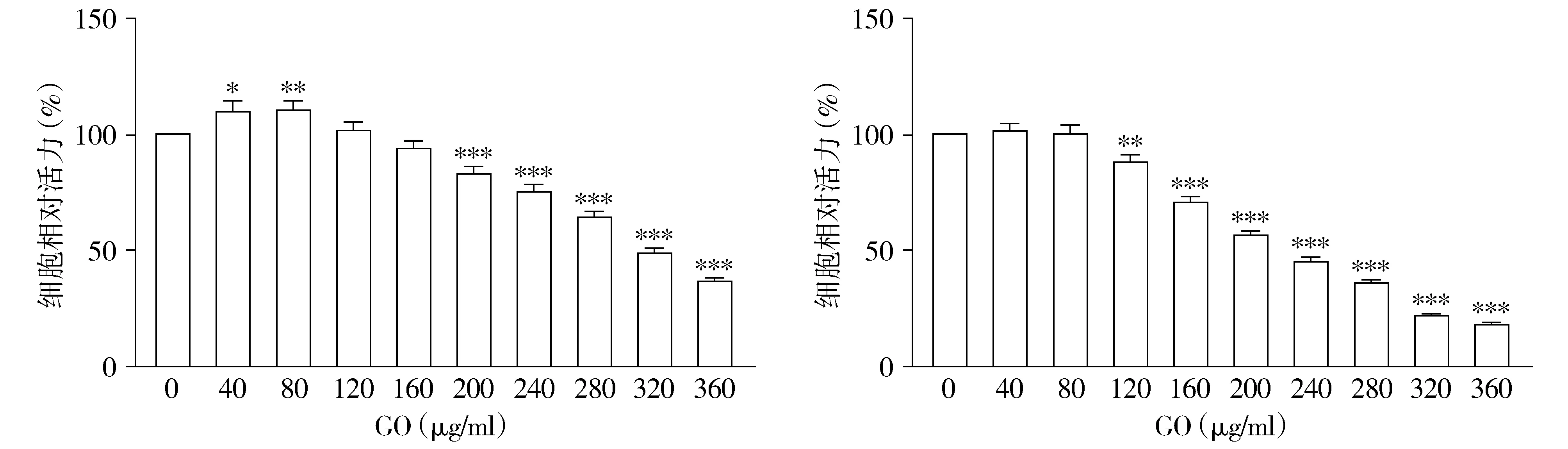
RT-PCR结果显示,共孵育24 h后GO各浓度组(40,120,200,280,360 μg/ml)和正常对照组中caspase-3的相对表达量分别为1.01±0.13,1.21±0.11,2.06±0.30,2.43±0.30,3.13±0.31;同样实验分组共孵育48 h caspase-3的相对表达量分别为0.94±0.13,1.69±0.26,2.52±0.42,3.19±0.54,3.29±0.58。不同干预时间中caspase-3的相对表达量均在120 μg/ml时与正常对照组差异有统计学意义(P<0.05);360 μg/ml组的表达量均约为正常组的3倍。Bax与Bcl-2基因相对表达量基本与Western blot结果一致,24 h和48 h共孵育后均Bax基因下调,Bcl-2基因上调,200 μg/ml组与同时间的正常组比较,差异有统计学意义(P<0.05);Bcl-2/Bax比值也呈下降趋势,分别于24 h时200 μg/ml,48 h时120 μg/ml差异有统计学意义(P<0.05,见图6)。
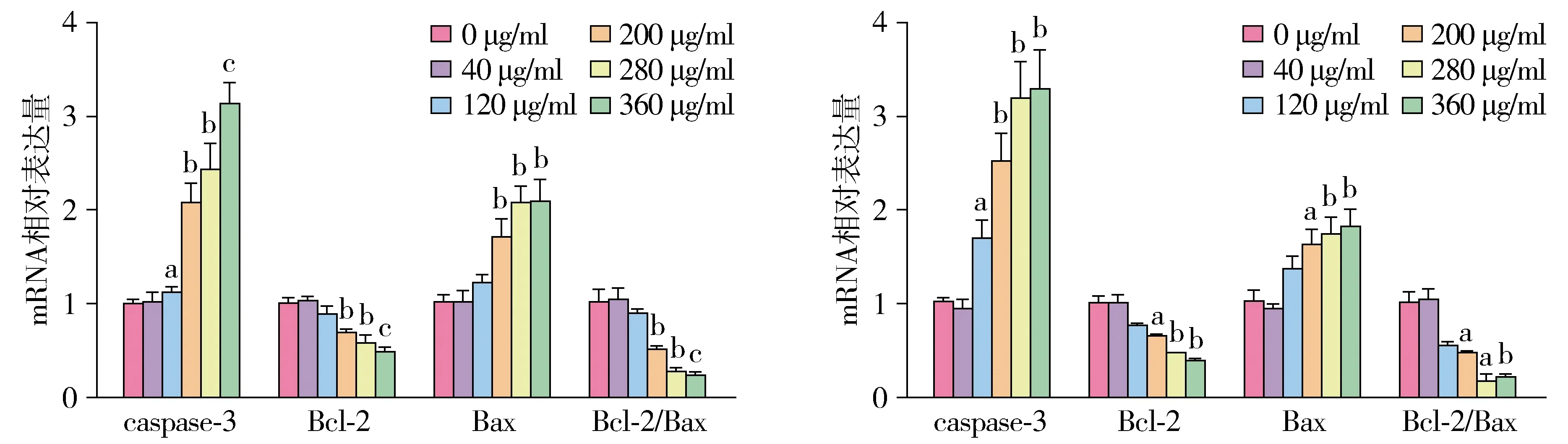
A.GO与SH-SY5Y细胞共孵育24 h B.GO与SH-SY5Y细胞共孵育48 h与0 μg/ml相比,aP<0.05,bP<0.01,cP<0.001图6 GO与SH-SY5Y细胞共孵不同时间对细胞凋亡相关基因的影响Figure 6 The effect of GO and SH-SY5Y cells incubated for different times on apoptosis-related genes
3 讨论
氧化石墨烯作为一种新型的纳米材料,由于其优异的物理化学性质,引起了人们的极大关注。近年来,氧化石墨烯作为新型给药载体靶向治疗癌症研究颇多,研究者将已修饰或功能化氧化石墨烯负载药物发挥抗癌疗效[14-16]。氧化石墨烯逐渐在生物科研领域应用的同时,随之而来的就是生物安全性的问题。已有研究报道GO对人纤维细胞有剂量依赖性毒性[17];经鼻吸入可沉积在肺部引起急性肺损伤及肺水肿[18]。本文通过GO纳米粒子与人神经细胞共孵育发现其对神经细胞也呈剂量依赖性毒性。
细胞凋亡又称程序性细胞死亡,是机体内为维持内环境稳态,细胞自主发生的死亡[19]。线粒体是调控细胞凋亡的中心,在受到刺激后,会释放出一系列凋亡相关蛋白,主要包括caspase、抗凋亡蛋白Bcl-2和促凋亡蛋白Bax。caspase-3被认为是细胞凋亡关键蛋白,是凋亡过程中的执行因子,降解各种细胞底物,最终导致细胞凋亡[20]。在凋亡信号刺激下,Bax构象发生变化,允许更多凋亡因子从线粒体释放,Bcl-2低表达能够增加线粒体膜通透性,总体来讲,Bax的激活和Bcl-2的抗凋亡是线粒体途径的细胞凋亡的关键[21]。本研究中,通过Western blot和RT-PCR的结果发现,当氧化石墨烯浓度大于120 μg/ml时,Bcl-2与Bax的蛋白表达的比值较正常组差异有统计学意义,相应的也上调了caspase-3的基因。提示氧化石墨烯纳米粒子穿过血脑屏障或者是通过嗅球-大脑转运途径进入到脑组织中,累积过量时,会促进神经细胞的凋亡,从而产生神经毒性效应,打破大脑内环境稳态,加重神经中枢系统负担的同时,还可能诱导加速帕金森、阿尔茨海默等中枢神经退行性疾病发生与发展。所以本研究建议在研究应用氧化石墨烯的诊断或治疗疾病效应的同时,也应关注其对神经系统潜在毒性。
综上所述,氧化石墨烯纳米粒子稳定性良好,低浓度时无神经细胞毒性甚至表现出促进细胞增殖现象,但当浓度达到120 μg/ml时开始抑制SH-SY5Y细胞增殖并诱导凋亡,其机制可能与激活线粒体的Bax和caspase级联反应有关,具体机制有待进一步研究。本实验为氧化石墨烯纳米粒载药应用提供安全浓度范围,在不损伤脑神经细胞的同时更好地发挥治疗效果。

