例说化学反应的活化能
◇ 甘肃 杨 丽
活化能是一个比较重要的概念,对理解化学反应与能量的关系或影响化学反应速率的因素有重要意义.
1 活化能和反应热的区别
活化能是指分子从常态转变为容易发生化学反应的活跃状态(活化分子)所需要的能量;反应热是反应过程放出或吸收的能量.
例1(1)图1中所示反应是____(填“吸热”或“放热”)反应,该反应______(填“需要”或“不需要”)加热,该反应的ΔH=______(用含E1、E2的代数式表示).
分析(1)由图可知,生成物的总能量小于反应物的总能量,该反应为放热反应,反应的

图1
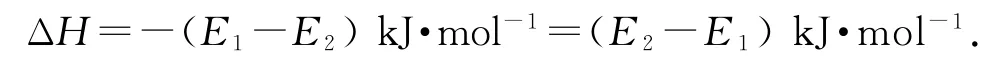
(2)该反应逆反应的活化能为

2 活化能与反应速率的关系及影响因素
活化能小→普通分子容易变成活化分子→活化分子的百分数增多→单位体积内活化分子数增多→单位体积内有效碰撞次数增多→化学反应速率增大.
例2反应物X转化为Y和Z的能量变化如图2所示.下列说法正确的是( ).
A.X→Y反应的活化能为E5
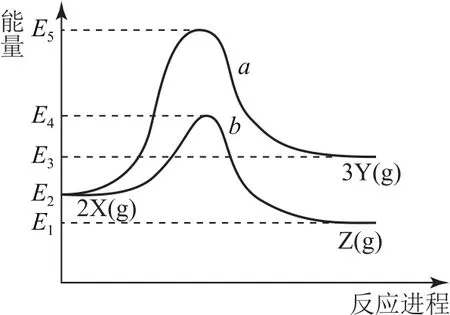
图2
B.加入催化剂后曲线a变为曲线b
C.升高温度增大吸热反应的活化能,从而使反应速率加快
D.压缩容器的容积不改变活化能,但增大单位体积活化分子数,使得反应速率加快
分析使用正催化剂能降低反应的活化能,但不能改变反应物、生成物的状态,不能改变反应的反应热.根据能量变化,X→Y活化能是(E5-E2),选项A错误;使用催化剂,活化能降低,产物不变,选项B错误;升高温度,增大了活化分子百分数,化学反应速率增大,选项C错误;压缩容器的体积,增大压强,增大单位容积活化分子数,反应速率加快,选项D正确.答案为D.
3 化学反应能量图中活化能的计算
活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,因此反应物的能量与反应过程最高能量差就是该反应的活化能;生成物的能量与反应过程中最高能量差是逆反应的活化能.
例3图3是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是( ).

图3
A.该反应的热化学方程式为N2(g)+3 H2(g)⇌2NH3(g) ΔH=-92 kJ·mol-1
B.正反应的活化能是508 kJ·mol-1
C.逆反应的活化能是600 kJ·mol-1
D.在一定温度下,通入1 mol N2和3 mol H2反应后放出的热量为92 kJ
分析催化剂能降低反应的活化能,但反应热没有变化.反应物能量高,生成物能量低,反应热ΔH=508 kJ·mol-1-600 kJ·mol-1=-92 kJ·mol-1,选项A说法正确;反应物的能量与反应过程最高能量差为508 kJ·mol-1,选项B说法正确;生成物的能量与反应过程中最高能量差是逆反应的活化能,选项C说法正确;合成氨为可逆反应,不能完全转化,通入1 mol N2和3 mol H2反应后放出的热量小于92 kJ,选项D说法错误.答案为D.

